9.5Violations de la Règle de l’Octet
Objectif d’apprentissage
- Reconnaître les trois principaux types de violations de la règle de l’octet.
Aussi importante et utile que la règle de l’octet soit dans la liaison chimique, il existe des violations bien connues. Cela ne signifie pas que la règle de l’octet est inutile — bien au contraire. Comme pour de nombreuses règles, il existe des exceptions ou des violations.
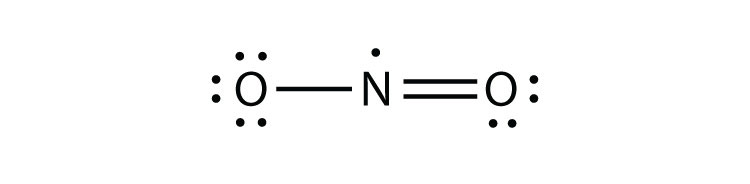
Il y a trois violations de la règle des octets. Molécules d’électrons impairesune molécule avec un nombre impair d’électrons dans la coquille de valence d’un atome. représente la première violation de la règle des octets. Bien qu’ils soient peu nombreux, certains composés stables ont un nombre impair d’électrons dans leurs coquilles de valence. Avec un nombre impair d’électrons, au moins un atome de la molécule devra violer la règle des octets. Des exemples de molécules d’électrons impairs stables sont NO, NO2 et ClO2. Le diagramme en points d’électrons de Lewis pour NO est le suivant:
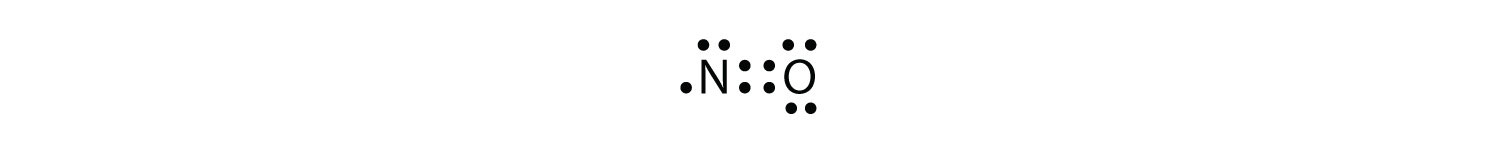
Bien que l’atome O ait un octet d’électrons, l’atome N n’a que sept électrons dans sa coquille de valence. Bien que le NO soit un composé stable, il est très réactif chimiquement, comme le sont la plupart des autres composés à électrons impairs.
Molécules déficientes en électronune molécule avec moins de huit électrons dans la coquille de valence d’un atome. représente la deuxième violation de la règle des octets. Ces composés stables ont moins de huit électrons autour d’un atome dans la molécule. Les exemples les plus courants sont les composés covalents du béryllium et du bore. Par exemple, le béryllium peut former deux liaisons covalentes, ce qui ne donne que quatre électrons dans sa coque de valence:
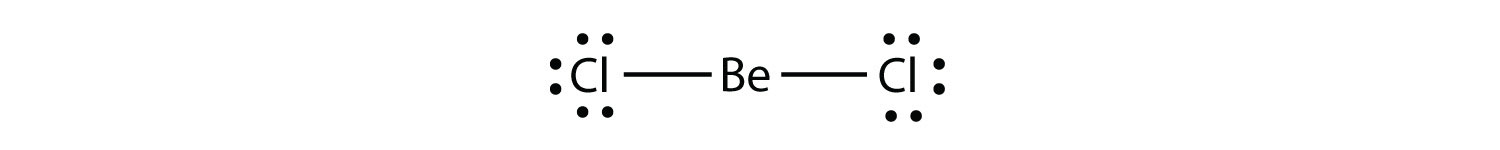
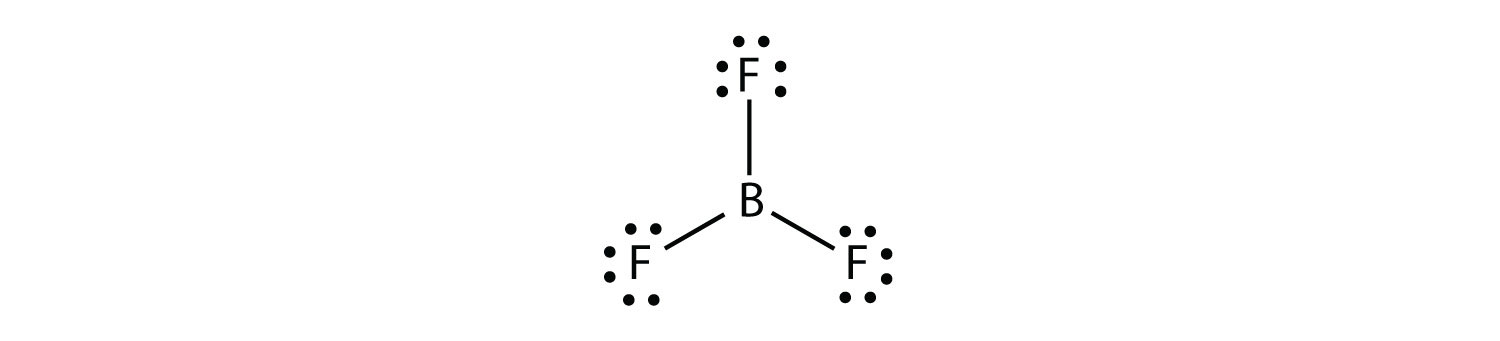
Le bore ne crée généralement que trois liaisons covalentes, ce qui ne donne que six électrons de valence autour de l’atome B. Un exemple bien connu est BF3:
La troisième violation de la règle des octets se trouve dans les composés avec plus de huit électrons affectés à leur coquille de valence. Ceux-ci sont appelés molécules de coquille de valence expanséeune molécule avec plus de huit électrons dans la coquille de valence d’un atome.. De tels composés ne sont formés que par des atomes centraux de la troisième rangée du tableau périodique ou au-delà qui ont des orbitales d vides dans leurs coquilles de valence qui peuvent participer à la liaison covalente. Un tel composé est PF5. Le seul diagramme en points d’électrons de Lewis raisonnable pour ce composé a l’atome P faisant cinq liaisons covalentes :
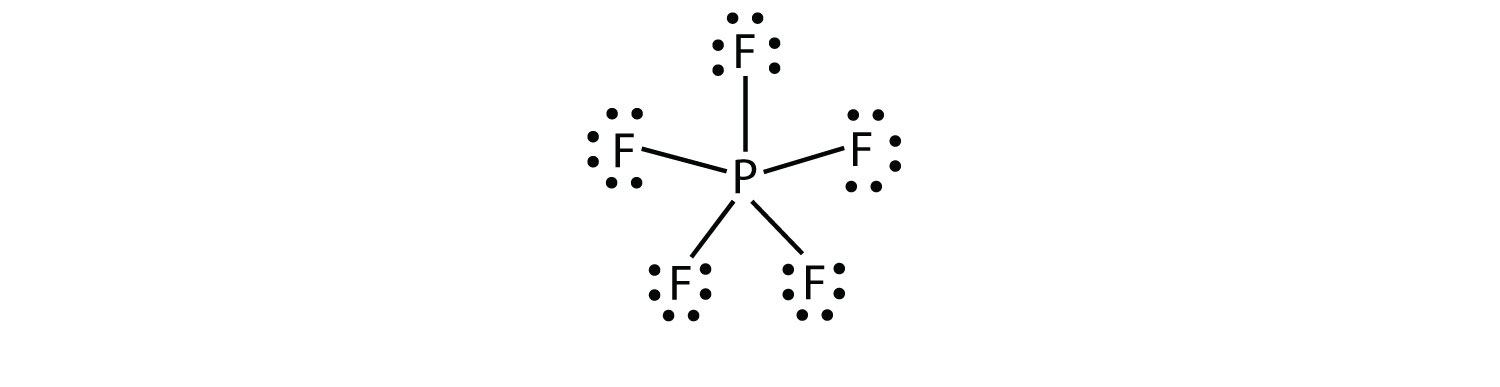
Formellement, l’atome P a 10 électrons dans sa coquille de valence.
Exemple 9
Identifiez chaque violation de la règle des octets en dessinant un diagramme à points d’électrons de Lewis.
- ClO
- SF6
Solution
-
Avec un atome Cl et un atome O, cette molécule a 6 + 7 = 13 électrons de valence, c’est donc une molécule d’électrons impairs. Un diagramme en points d’électrons de Lewis pour cette molécule est le suivant :

-
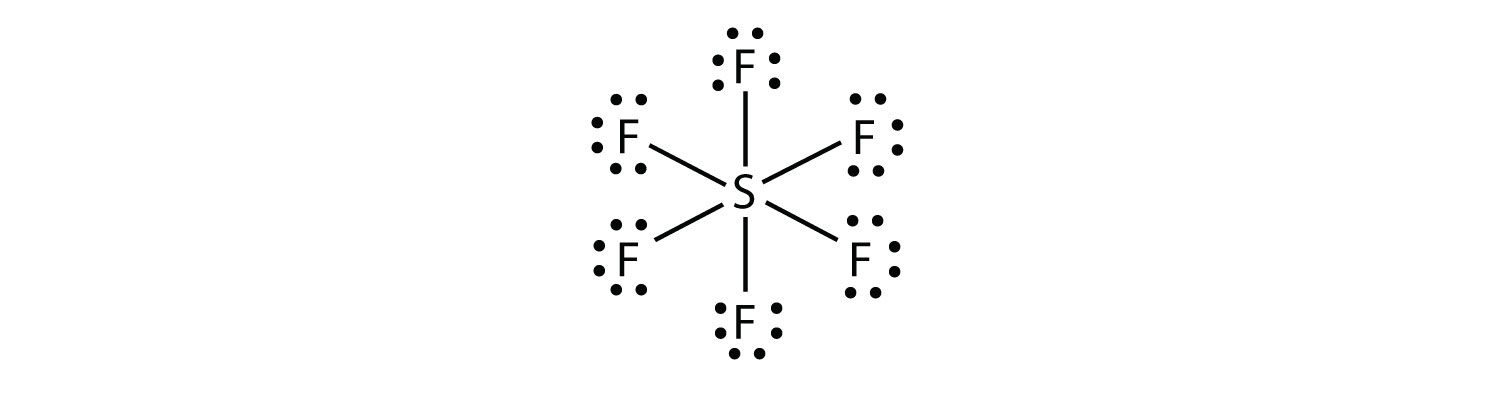
Dans SF6, l’atome S central établit six liaisons covalentes aux six atomes F environnants, il s’agit donc d’une molécule de coquille de valence expansée. Son diagramme en points d’électrons de Lewis est le suivant:
Testez-vous
Identifiez la violation de la règle des octets dans XeF2 en dessinant un diagramme de points d’électrons de Lewis.
Réponse
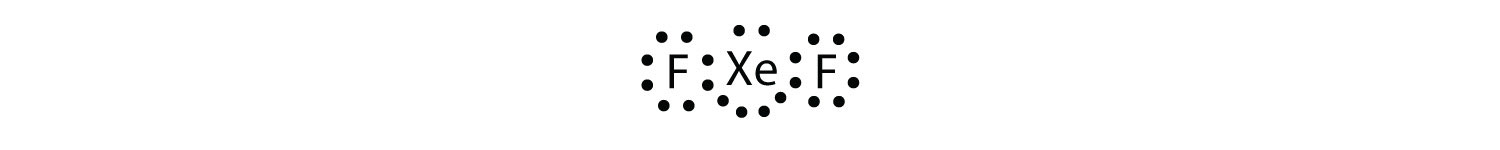
L’atome Xe a une coquille de valence élargie avec plus de huit électrons autour de lui.
À emporter
- Il y a trois violations de la règle des octets: les molécules à électrons impairs, les molécules déficientes en électrons et les molécules à coque de valence expansée.
Exercices
-
Pourquoi une molécule d’électrons impairs ne peut-elle pas satisfaire à la règle des octets?
-
Pourquoi un atome de la deuxième rangée du tableau périodique ne peut-il pas former de molécules de coquille de valence expansée?
-
Dessinez un diagramme en points d’électrons de Lewis acceptable pour ces molécules qui violent la règle des octets.
- NO2
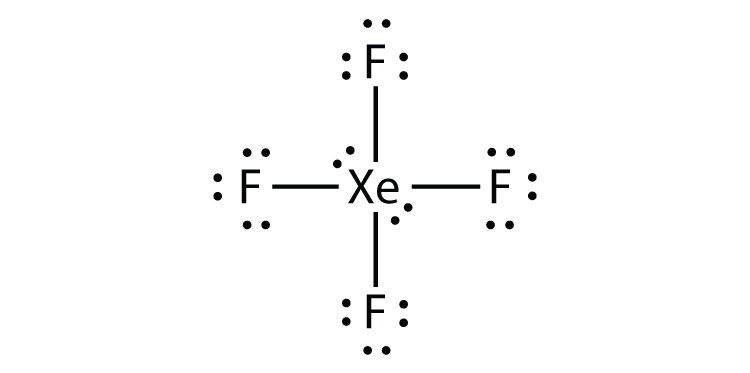
- XeF4
-
Dessinez un diagramme en points d’électrons de Lewis acceptable pour ces molécules qui violent la règle des octets.
- BCl3
- ClO2
-
Dessinez un diagramme en points d’électrons de Lewis acceptable pour ces molécules qui violent la règle des octets.
- POF3
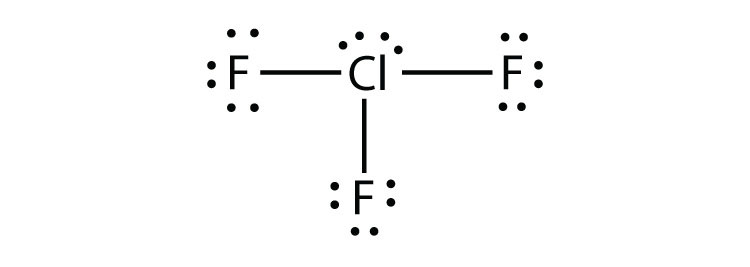
- ClF3
-
Dessinez un diagramme en points d’électrons de Lewis acceptable pour ces molécules qui violent la règle des octets.
- SF4
- BeH2
Réponses
-
Tous les électrons ne peuvent pas être appariés s’ils sont en nombre impair.
-
-
-
-