Le métabolisme cellulaire normal dépend du maintien du pH sanguin dans des limites très étroites (7,35-7,45).
Même des excursions relativement légères en dehors de cette plage de pH normale peuvent avoir des effets délétères, notamment une réduction de l’apport d’oxygène aux tissus, des perturbations électrolytiques et des modifications de la contractilité du muscle cardiaque; la survie est faible si le pH sanguin tombe en dessous de 6,8 ou dépasse 7,8.
Le problème pour le corps est que le métabolisme normal est associé à la production continue d’ions hydrogène (H +) et de dioxyde de carbone (CO2), qui ont tous deux tendance à réduire le pH. Le mécanisme qui surmonte ce problème et sert à maintenir un pH sanguin normal (c’est-à-dire à préserver l’homéostasie acido-basique) est une synergie complexe d’action impliquant des tampons chimiques dans le sang, les globules rouges (érythrocytes), qui circulent dans le sang, et la fonction de trois organes: poumons, reins et cerveau.
Avant d’expliquer comment ces cinq éléments contribuent au maintien global du pH sanguin, il serait utile de passer rapidement en revue certains concepts de base.
- Qu’est-ce qu’un acide, qu’est-ce qu’une base et qu’est-ce que le pH ?
- Qu’est-ce qu’un tampon? – le système tampon bicarbonate
- Fonction pulmonaire, transport du CO2 et équilibre acide-base
- Les reins et l’équilibre acido-basique
- PERTURBATIONS DE L’ÉQUILIBRE ACIDO-BASIQUE
- Causes de perturbations acido-basiques
- Acidose respiratoire – (augmentation de la pCO2 (a), pH réduit)
- Alcalose respiratoire – (réduction du CO2 (a), augmentation du pH)
- Acidose métabolique – (diminuéhco3-, pH diminué)
- Alcalose métabolique – (augmentéhco3-, augmentation du pH)
- Compensation – une conséquence de la perturbation à base d’acide
- Troubles mixtes acido-basiques
- Résumé
- Certains ont suggéré de lire plus loin
Qu’est-ce qu’un acide, qu’est-ce qu’une base et qu’est-ce que le pH ?
Un acide est une substance qui libère des ions hydrogènes (H +) lors de la dissociation en solution.
Par exemple: L’acide chlorhydrique (HCl) se dissocie en hydrogénions et en ions chlorure
HCl ![]() H++Cl-
H++Cl-
L’acide carbonique (H2CO3) se dissocie en ions hydrogène et en ions bicarbonate
H2CO3 ![]() div>H ++HCO3–
div>H ++HCO3–
Nous distinguons les acides forts comme l’acide chlorhydrique et les acides faibles comme l’acide carbonique. La différence est que les acides fortsdissocier plus que les acides faibles. Par conséquent, la concentration en hydrogène d’un acide fort est beaucoup plus élevée que celle d’un acide faible.
Une base est une substance qui, en solution, accepte les ions hydrogène.
Par exemple, le bicarbonate de base (HCO3–) accepte les ions hydrogène pour former de l’acide carbonique:
HCO3–+H +![]() H2CO3
H2CO3
Le pH est une échelle de 0 à 14 d’acidité et d’alcalinité. L’eau pure aun pH de 7 et est neutre (ni acide ni alcalin). pH supérieur à 7est alcalin et inférieur à 7 acide. Ainsi, le pH du sang (7,35-7,45) estlégèrement alcalin bien qu’en médecine clinique le terme alcalose soit, peut-être de manière confuse, réservé à un pH sanguin supérieur à 7.45et le terme acidose est réservé au pH sanguin inférieur à 7,35.
Le pH est une mesure de la concentration en ions hydrogène (H+).Les deux sont liés selon l’équation suivante:
pH=-log10
où est la concentration en ions hydrogène inmoles par litre (mol/L)
À partir de cette équation
pH 7,4= H + concentration de 40 nmol/L
pH 7,0 = H + concentration de 100 nmol /L
pH 6,0 = H + concentration de 1000 nmol /L
Il est clair que :
- les deux paramètres changent inversement; à mesure que la concentration en ions hydrogène augmente, le pH diminue
- en raison de la relation logarithmique, un changement important de la concentration en ions hydrogène est en fait un petit changement de pH. Par exemple, le doublement de la concentration en ions hydrogène entraîne une baisse du pH de seulement 0,3
Qu’est-ce qu’un tampon? – le système tampon bicarbonate
Les tampons sont des produits chimiques en solution qui minimisent la variation de pH qui se produit lorsque des acides sont ajoutés en « essuyant » des ions d’hydrogène. Un tampon est une solution d’un acide faible et de sonbase de conjugué. Dans le sang, le système tampon principal est le faibleacide, l’acide carbonique (H2CO3) et sa base conjuguée, le bicarbonate (HCO3–). Pour expliquer comment ce système minimise les changements de pH, supposons que nous ajoutions un acide fort, par exemple HCl, au tampon bicarbonate:
L’acide se dissociera, libérant des ions hydrogène:
HCl ![]() H ++Cl–
H ++Cl–
Le tampon bicarbonate « absorbe » ensuite les ions hydrogène, formant de l’acide carbonique dans le processus:
HCO3-+H + ![]() H2CO3 (acide carbonique)
H2CO3 (acide carbonique)
Le point important est que les ions hydrogène de HCL ont été incorporés dans l’acide carbonique faible, qui ne se dissocie pas aussi facilement, le nombre total d’ions hydrogène en solution et donc le pH ne changent pas autant que ce qui se serait produit en l’absence du tampon.
Bien qu’un tampon minimise considérablement le changement de ph, il ne l’élimine pas car même un acide faible (comme l’acide carbonique) se dissocie dans une certaine mesure. Le pH d’une solution tampon est fonction des concentrations relatives de l’acide faible et de sa base conjuguée.
pH = 6,1 +log(/)
Où =concentration de bicarbonate
=concentration d’acide carbonique
Cette relation, connue sous le nom d’équation de Henderson-Hasselbalch, montre que le pH est régi par le rapport entre la concentration en bases (HCO3–) et la concentration en acides (H2CO3).
Sous forme d’ions hydrogène sont ajoutés au tampon bicarbonate:
H ++HCO3–![]() H2CO3
H2CO3
le bicarbonate (base) est consommé (la concentration diminue) et l’acide carbonique est produit (la concentration augmente). Si des hydrogénions continuent à être ajoutés, tout le bicarbonate finirait par être consommé (converti en acide carbonique) et il n’y aurait pas d’effet de gonflement – le pH diminuerait alors fortement si plus d’acide était ajouté.
Cependant, si l’acide carbonique pouvait être éliminé en continu du système et que le bicarbonate se régénérait constamment, la capacité de remplissage et donc le pH pourraient être maintenus malgré l’ajout continu d’ions hydrogène.
Comme cela deviendra clair avec plus de détails sur la physiologie deéquilibre acide-base, c’est-à-dire, en effet, ce qui se passe dans le corps. Inessence, les poumons assurent l’élimination de l’acide carbonique (sous forme de carbondioxyde) et les reins assurent une régénération continue de bicarbonate.
Ce rôle des poumons dépend d’une caractéristique unique du système tampon de bicarbonate, à savoir la capacité de l’acide carbonique à être converti en dioxyde de carbone et en eau.
L’équation suivante décrit la relation de tous les éléments du système tampon de bicarbonate tel qu’il fonctionne dans le corps
H ++HCO3–![]() H2CO3
H2CO3 ![]() H2O + CO2
H2O + CO2
Il est important de noter que les réactions sont réversibles.La direction dépend de la concentration relative de chaqueélément. De sorte que, par exemple, une augmentation de la concentration de dioxyde de carbone force une réaction vers la gauche avec une formation accrue d’acide carbonique et finalement d’ions hydrogène.
Ceci explique le potentiel acide du dioxyde de carbone et nous amène à la contribution importante que les poumons et les globules rouges apportent à la balance acide-base globale.
Fonction pulmonaire, transport du CO2 et équilibre acide-base
Une quantité constante de CO2 dans le sang, essentielle à l’équilibre normalacide-base, reflète un équilibre entre celui produit par le métabolisme des cellules tissulaires et celui excrété par l’air inexpliqué des poumons.
En faisant varier la vitesse à laquelle le dioxyde de carbone est excrété, les poumons régulent la teneur en dioxyde de carbone du sang.La séquence des événements allant de la production de dioxyde de carbone dans les tissus à l’élimination dans l’air expiré est décrite à la Fig. 1.Le dioxyde de carbone se diffuse hors des cellules tissulaires vers le sang capillaire environnant (Fig. 1 bis). Une petite proportion se dissout dans le sangplasma et est transporté dans les poumons inchangé.
Mais la plupart diffusent dans les globules rouges où il se combine avec de l’eau pour former de l’acide carbonique.L’acide se dissocie avec la production d’ions hydrogène etbicarbonate. Les ions hydrogène se combinent avec l’hémoglobine désoxygénée (l’hémoglobine agit ici comme tampon), empêchant une chute dangereuse du pH cellulaire, et le bicarbonate diffuse le long d’une concentrationgradient des globules rouges au plasma.
Ainsi, la majeure partie du dioxyde de carbone produit dans les tissus est transportée vers les poumons sous forme de plasma sanguin bicarbonatéine.
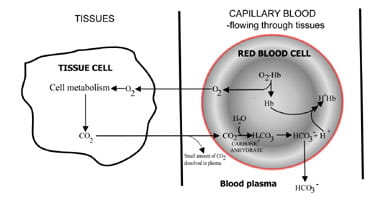
Fig. 1a. CO2 produit dans les tissusconverti en bicarbonate pour le transport vers les poumons.
|
|
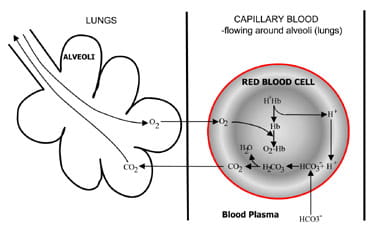
Fig. 1b. At the lungs bicarbonate convertedback to CO2 and eliminated by the lungs.
Au niveau des alvéoles des poumons, le processus est inversé (Fig. 1b).Les ions hydrogène sont déplacés de l’hémoglobine lorsqu’elle absorbe l’oxygènede l’air inspiré. Les ions hydrogène sont maintenant tamponnés parbicarbonate qui diffuse du plasma dans les globules rouges et de l’acide carbonique se forme. À mesure que la concentration augmente, il estconverti en eau et en dioxyde de carbone. Enfin, le dioxyde de carbone modifie un gradient de concentration allant des globules rouges aux alvéoles pour une excrétion dans l’air expiré.
Les chimiorécepteurs respiratoires dans le tronc cérébral réagissent aux changements de la concentration de dioxyde de carbone dans le sang, provoquant une augmentation de la ventilation (respiration) si la concentration de dioxyde de carbone augmente et une diminution de la ventilation si le dioxyde de carbone diminue.
Les reins et l’équilibre acido-basique
Le métabolisme cellulaire normal entraîne une production continue d’ions hydrogène. Nous avons vu qu’en combinant avec ces ions hydrogène, le tampon bicarbonate dans le sang minimise leur effet. Cependant, la mise en mémoire tampon n’est utile qu’à court terme et, en fin de compte, les ions hydrogène doivent être éliminés du corps.De plus, il est important que le bicarbonate utilisé pourbouffer les ions hydrogène soit remplacé en continu.
Ces deux tâches, l’élimination des ions hydrogène et la régénération du bicarbonate, sont accomplies par les reins. Les cellules tubulaires rénales sont riches enenzyme anhydrase carbonique, ce qui facilite la formation d’acide carboné à partir de dioxyde de carbone et d’eau. L’acide carbonique se dissocie des ions bicarbonate et hydrogène. Le bicarbonate est réabsorbé dansle sang et les ions hydrogène passent dans la lumière du tubule et sont éliminés du corps dans l’urine.
Cette élimination urinaire estdépend de la présence dans l’urine de tampons, principalement d’ions phosphates et d’ammoniac.
PERTURBATIONS DE L’ÉQUILIBRE ACIDO-BASIQUE
La plupart des perturbations acido-basiques résultent d’une maladie ou d’une atteinte d’organes (reins, poumons, cerveau) dont le fonctionnement normal est nécessaire à l’homéostasie acido-basique,
Les gaz du sang artériel sont le test sanguin utilisé pour identifier et surveiller les perturbations acido-basiques. Trois paramètres mesurés lors de l’analyse des gaz sanguins, le pH du sang artériel (pH), la pression partielle de dioxyde de carbone dans le sang artériel (pCO2(a)) et la concentration du bicarbonate (HCO3–) sont d’une importance cruciale (voir Tableau I pour la plage de référence (normale)).Les résultats de ces trois méthodes permettent de classer la perturbation à base d’acide dans l’une des quatre catégories étiologiques:
- Respiratory acidosis
- Respiratory alkalosis
- Metabolic acidosis
- Metabolic alkalosis
|
Adults |
Neonates |
|
|
pH |
7.35-7.45 |
7.30-7.40 |
|
pCO2 (kPa) |
4.7-6.0 |
3.5-5.4 |
|
Bicarbonate |
22-28 |
15-25 |
TABLE I. Plages de référence approximatives (normales)
Pour comprendre comment les résultats du pH, du pCO2(a) et du bicarbonate sont utilisés pour classer les perturbations acido-basiques de cette manière, nous devons revenir à l’équation de Henderson-Hasselbalch
pH = 6,1 + log(/)
Nous mesurons le pH et le bicarbonate mais pas l’acide carbonique (H2CO3). Cependant, il existe une relation entre pCO2(a) et H2co3 qui permet de retraiter l’équation de Henderson-Hasselbalch entre les trois paramètres (pH, pCO2(a) et bicarbonate) mesurés lors de l’analyse des gaz sanguins:
pH = 6,1 + log(/(pCO2(a) ×0.23))
En supprimant toutes les constantes de cette équation, la relation entre les trois paramètres mesurés peut être plus simplement définie :
pH ∝/pCO2(a)
Cette relation, cruciale pour comprendre tout ce qui concerne les perturbations acido-basiques, indique que le pH artériel du sang est proportionnel au rapport de concentration de bicarbonate sur pCO2(a). Il permet les déductions suivantes:
- Le pH reste normal tant que le rapport: pCO2(a) reste normal
- Le pH augmente (c’est-à-dire qu’une alcalose se produit) si soit augmente, soit pCO2 (a) diminue.
- Le pH diminue (c.-à-d. l’acidose se produit) si soit diminue, soit pCO2(a) augmente
- Si les deux pCO2 (a) et sont augmentés de relativement la même quantité, le rapport et donc le pH sont normaux
- Si les deux pCO2 (a) et sont diminués de relativement la même quantité, le rapport et donc le pH sont normaux.
Les perturbations acido-basiques affectent principalement soitpco2(a), auquel cas on parle de perturbation respiratoire ou, auquel cas on parle de perturbation anon-respiratoire ou métabolique:
- Si la perturbation primaire est une augmentation de la pCO2 (a) (qui provoque une acidose – voir ci–dessus), la condition est appelée acidose respiratoire
- Si la perturbation primaire est une réduction de la pCO2 (a) (qui provoque une alcalose – voir ci–dessus), la condition est appelée alcalose respiratoire
- Si la perturbation primaire est associée à une réduction du bicarbonate (qui entraîne une acidose – voir ci-dessus), la condition est appelée acidose métabolique
- Si la perturbation primaire est associée à une augmentation du bicarbonate (qui entraîne une alcalose – voir ci-dessus), la condition est appelée alcalose métabolique
Causes de perturbations acido-basiques
Acidose respiratoire – (augmentation de la pCO2 (a), pH réduit)
L’acidose respiratoire est caractérisée par une augmentationpco2 (a) due à une ventilation alvéolaire inadéquate (hypoventilation) et, par conséquent, une élimination réduite deCO2 du sang. Les maladies respiratoires, telles que la bronchopneumonie, l’emphysème, l’asthme et les maladies respiratoires obstructives chroniques, peuvent toutes être associées à une hypoventilation suffisante pour provoquer une acidose respiratoire.
Certains médicaments (p. ex. morphine etbarbituriques) peuvent provoquer une acidose respiratoire en déprimant lecentre respiratoire dans le cerveau. Des dommages ou des traumatismes à la paroi thoraciqueet la musculature impliquée dans la mécanique de la respiration peuvent réduire le taux de ventilation. Cela explique l’acidose respiratoirequi peut compliquer l’évolution de maladies telles que la poliomyélite, le syndrome de Guillain-Barre et la récupération d’un traumatisme thoracique sévère.
Alcalose respiratoire – (réduction du CO2 (a), augmentation du pH)
En revanche, l’alcalose respiratoire se caractérise par une diminution du CO2 (a) due à une ventilation alvéolaire excessive et à une élimination excessive du CO2 du sang.Maladie dans laquelle, en raison de la réduction de l’oxygène dans le sang (hypoxémie), le centre respiratoire est stimulé peut entraîner une alcalose respiratoire.
Les exemples ici incluent l’anémie sévère, l’embolismeet le syndrome respiratoire de l’adulte. Hyperventilation suffisante pourprovoquer une alcalose respiratoire peut être une caractéristique des crises d’anxiété etréponse à une douleur intense. L’une des propriétés les moins bienvenues dealicylate (aspirine) est son effet stimulant sur le centre respiratoire. Cet effet explique l’alcalose respiratoire quise produit après un surdosage en salicylate. Enfin, trop enthousiasmela ventilation mécanique peut provoquer une alcalose respiratoire.
Acidose métabolique – (diminuéhco3-, pH diminué)
Une réduction du bicarbonate est toujours une caractéristique de l’acidose métabolique. Cela se produit pour l’une des deux raisons suivantes: augmentation de l’utilisation de bicarbonate pour tamponner une charge acide anormale ou augmentation des pertes de bicarbonate du corps. L’acidocétose diabétique et l’acidocétose lactique sont deux conditions caractérisées par une surproduction d’acides métaboliques et un épuisement du bicarbonate qui en résulte.
Dans le premier cas, des concentrations sanguines anormalement élevées de cétoacides (acide b-hydroxybutyrique et acide acétoacétique) reflètent les perturbations sévères métaboliques résultant de l’insulindeficience.
Toutes les cellules produisent de l’acide lactique si elles sont déficientes en oxygène, de sorte qu’une augmentation de la production d’acide lactique et une acidose métabolique qui en résulte se produisent dans n’importe quelle condition dans laquelle l’apport d’oxygène aux tissus est gravement compromis.
Les exemples incluent l’arrêt cardiaqueet toute condition associée à un choc hypovolémique (par exemple, perte massive de liquide). Le foie joue un rôle majeur dans l’élimination de la petite quantité d’acide lactique produite au cours du métabolisme cellulaire normal, de sorte que l’acidose lactique peut être une caractéristique de l’insuffisance hépatique.
Une perte anormale de bicarbonate du corps peut survenir pendantdiarrhées graves. S’il n’est pas contrôlé, cela peut entraîner une acidose métabolique.Échec de la régénération du bicarbonate et de l’excrétion des ions hydrogènesexplique l’acidose métabolique qui se produit dans renalfailure.
Alcalose métabolique – (augmentéhco3-, augmentation du pH)
Le bicarbonate est toujours augmenté dans l’alcalose métabolique. Rarement, une administration excessive de bicarbonate ou l’ingestion d’une préparation antiacide à la bicarbonatéine peut provoquer une alcalose métabolique, mais elle est généralement transitoire. Une perte anormale d’ions hydrogène du corps peutêtre le problème principal. Le bicarbonate qui serait autrement consommé dans le tampon de ces ions hydrogène perdus s’accumule par conséquent dans le sang. Le suc gastrique est acide et gastriquel’aspiration ou tout processus pathologique dans lequel le contenu gastrique est perdu du corps représente une perte d’ions hydrogène.
Le vomissement par projectile du suc gastrique, par exemple, explique l’alcalose métabolique qui peut survenir chez les patients atteints de pyloricsténose. Une déplétion sévère du potassium peut provoquer une alcalose métaboliqueen raison de la relation réciproque entre l’hydrogène et les potassiumions.
Compensation – une conséquence de la perturbation à base d’acide
Il est vital pour la vie que le pH ne soit pas trop éloigné de la normale, et le corps tentera toujours de ramener un pH anormal vers la normale lorsque l’équilibre acido-basique est perturbé. Une compensation est également accordée à ce processus de préservation de la vie. Pour comprendre la compensation, il est important de rappeler que le pH est régi par la theratio: pCO2 (a). Tant que le rapport est normal, le pH sera normal.
Considérez le patient atteint d’acidose métabolique dont le pH est basparce que le bicarbonate est faible. Pour compenser le faible et restaurer le rapport essentiel à la normale, le patient doit abaisser hispCO2 (a). Les chimiorécepteurs dans le centre respiratoire du cerveau répondent à une augmentation de la concentration en ions hydrogène (pH bas), provoquant une ventilation accrue (hyperventilation) et une élimination accrue du dioxyde de carbone; LEPCO2 (a) chute et le rapport: pCO2 (a) revient à la normale.
La compensation de l’alcalose métabolique dans laquelle est élevée, en revanche, implique une dépression de la respiration et donc une rétention des dioxydes de carbone de sorte que le pCO2(a) s’élève pour correspondre à l’increasein. Cependant, la dépression de la respiration a l’effet secondaire indésirable de menacer l’adéquation de l’oxygénation des tissus. Pour cette raison, la compensation respiratoire del’alcalose métabolique est limitée.
Les perturbations primaires de la pCO2(a) (acidose respiratoire et alcalose) sont compensées par des ajustements rénaux de l’excrétion des ions hydrogène qui entraînent des modifications de celle-ci compensant de manière appropriée la modification primaire de la pCO2 (a). Ainsi, la rénoncompensation de l’acidose respiratoire (augmentation du CPO2(a)) implique une réabsorption accrue du bicarbonate, et la compensation rénale de l’alcalose respiratoire (réduction du cPO2 (a)) implique une réduction de l’absorption des bicarbonates.
Le concept d’équilibre acido-basique lors de la compensationest véhiculé visuellement dans la Fig. 2. Le tableau II résume les résultats des gaz du sang qui caractérisent les quatre perturbations acido-basiques avant et après compensation.
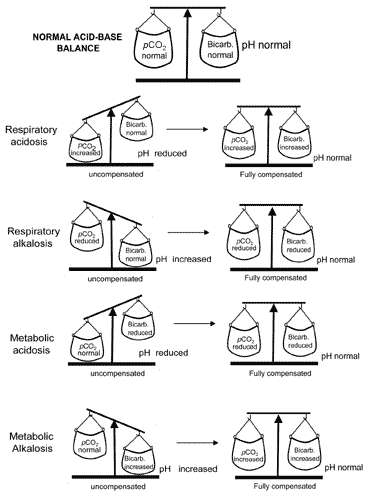
Fig. 2. « L’équilibre acido-basique » : compensationrestores normal pH
|
Primary disturbance |
||||
|
Respiratory |
Repiratory |
Metabolic |
Metabolic |
|
|
Some |
Emphysema |
Hyper- |
Renal failure |
Bicarbonate Potassium |
|
Compen- |
RENAL |
RENAL |
RESPIRA- |
RESPIRA- |
|
Initial blood |
pH |
pH |
pH |
pH |
|
Blood gas |
pH pCO2 |
pH pCO2 |
pH pCO2 |
Compen- |
|
Blood gas |
pH normal |
pH normal |
pH normal |
Limited |
Version imprimable du tableau, pdf.
TABLEAU II.Les gaz sanguins entraînent des perturbations de l’équilibre acido-basique
La compensation respiratoire pour une perturbation métabolique primaire se produit beaucoup plus rapidement que la compensation métabolique (rénale) pour une perturbation respiratoire primaire. Dans le second cas, la compensationse produit sur des jours plutôt que sur des heures.
Si la compensation entraîne un retour du pH à la normale, le patient est dit entièrement compensé. Mais dans de nombreux cas, la compensation revient à la normale sans atteindre réellement la normalité; dans de tels cas, le patient serait partiellement indemnisé.
Pour les raisons décrites ci-dessus, l’alcalose métabolique est très rarement pleinement compensée.
Troubles mixtes acido-basiques
On peut supposer à partir de la discussion ci-dessus que tous les patients présentant des troubles acido-basiques ne souffrent que d’une des quatre catégories d’équilibre acido-basique. Cela peut bien être le cas, mais dans des circonstances particulières, les patients peuvent présenter plus d’une perturbation.
Par exemple, considérons le patient atteint d’une maladie chronique telle que l’emphysème qui a une acidose respiratoire partiellement compensée de longue date. Si ce patient était également adiabétique et n’avait pas pris sa dose normale d’insuline et qu’il était en état d’acidocétose diabétique, les résultats des gaz sanguins refléteraient l’effet combiné de l’acidose respiratoire et de l’acidose métabolique.
De telles perturbations mixtes acido-basiques ne sont pas fréquentes et peuvent être difficiles à démêler sur la base des seuls résultats du gaz sanguin artériel.
Résumé
Le maintien d’un pH sanguin normal implique plusieurs systèmes organiqueset dépend de l’intégrité circulatoire. Il n’est donc pas surprenant que la perturbation de l’équilibre acido-basique puisse compliquer le cours de maladies très diverses ainsi que de traumatismes dans de nombreuses parties du corps. Le corps a un pouvoir considérable pour préserver le pH du sang, etles perturbations impliquent généralement une maladie chronique grave ou une maladie critique aiguë.
Les résultats de l’analyse des gaz du sang artériel peuventidentifier une perturbation acido-basique et fournir des informations précieuses sur sa cause.
Certains ont suggéré de lire plus loin
- Thomson WST, Adams JF, Cowan RA. Équilibre acido-basique clinique. Il s’agit de la première édition de la revue médicale Oxford Medical Publications, publiée en 1997. Équilibre acido-basique. Respir Care Clin N. America 1995; 1,1:7-21
- Woodrow P. Analyse des gaz sanguins artériels. Nursing Standard 2004; 18,21:45-52
- Sirker AA, Rhodes A, Gounds RM, Bennet ED. Physiologie acido-basique : l’approche « traditionnelle » et l’approche « moderne ». Anesthésie 2002; 57:348-56