Nom générique: Sulfate de Terbutaline
Forme posologique: injection, solution
Revue médicale par Drugs.com . Dernière mise à jour le 1er septembre 2020.
- Aperçu
- Effets secondaires
- Posologie
- Professionnel
- Interactions
- Plus
Une solution aqueuse stérile pour injection sous-cutanée
Rx uniquement
AVERTISSEMENT: LA TOCOLYSE PROLONGÉE
Le sulfate de Terbutaline n’a pas été approuvé et ne doit pas être utilisé pour une tocolyse prolongée (au-delà de 48 à 72 heures) . En particulier, le sulfate de terbutaline ne doit pas être utilisé pour l’entretien tocolyse en ambulatoire ou à domicile. Des effets indésirables graves, y compris le décès, ont été rapportés après administration de sulfate de terbutaline à des femmes enceintes. Chez la mère, ces effets indésirables comprennent une augmentation de la fréquence cardiaque, une hyperglycémie transitoire, une hypokaliémie, des arythmies cardiaques, un œdème pulmonaire et une ischémie myocardique. Une augmentation de la fréquence cardiaque fœtale et une hypoglycémie néonatale peuvent survenir à la suite d’une administration maternelle (voir CONTRE-INDICATIONS: Tocolyse prolongée).
- Terbutaline Description
- Terbutaline – Pharmacologie clinique
- Des études précliniques
- Pharmacocinétique
- Indications et utilisation pour la Terbutaline
- Contre-indications
- Avertissements
- Détérioration de l’asthme
- Utilisation d’Agents anti-inflammatoires
- Effets cardiovasculaires
- Convulsions
- Précautions
- Généralités
- Interactions médicamenteuses
- Carcinogenèse, Mutagénèse, Altération de la fertilité
- Effets tératogènes de la grossesse
- Utilisation Pendant le travail et l’accouchement
- Mères allaitantes
- Utilisation pédiatrique
- Utilisation gériatrique
- Effets indésirables
- Surdosage
- Posologie et administration de la Terbutaline
- Comment la Terbutaline est-elle fournie
- PANNEAU D’AFFICHAGE PRINCIPAL
- PANNEAU D’AFFICHAGE PRINCIPAL
- SERIALIZATION IMAGE
- En savoir plus sur la terbutaline
- Ressources pour les consommateurs
- Ressources professionnelles
- Guides de traitement connexes
Terbutaline Description
Le sulfate de Terbutaline, USP, l’ingrédient actif de l’injection de sulfate de Terbutaline, USP, est un bronchodilatateur agoniste bêta-adrénergique disponible sous forme de solution aqueuse stérile, non pyrogène, en flacons, pour administration sous-cutanée. Chaque millilitre de solution contient 1 mg de sulfate de Terbutaline, de l’USP (0,82 mg de la base libre), du chlorure de sodium pour l’isotonicité, de l’édétate disodique dihydraté à 0,055% comme agent stabilisant et de l’acide chlorhydrique pour l’ajustement à un pH cible de 4. Le sulfate de terbutaline est un sulfate d’alcool (±)-a–3,5-dihydroxybenzyI (2:1) (sel). La formule moléculaire est (C12H19N03) 2 • H2SO4 et la formule structurelle est:
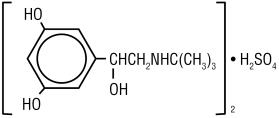
Le sulfate de terbutaline, USP est une poudre cristalline blanche à gris-blanc. Il est inodore ou dégage une légère odeur d’acide acétique. Il est soluble dans l’eau et dans l’acide chlorhydrique 0,1 N, légèrement soluble dans le méthanol et insoluble dans le chloroforme. Son poids moléculaire est de 548,65.
Terbutaline – Pharmacologie clinique
L’injection de sulfate de terbutaline est un agoniste des récepteurs bêta-adrénergiques. Des études pharmacologiques in vitro et in vivo ont démontré que la Terbutaline exerce un effet préférentiel sur les récepteurs bêta‑2-adrénergiques. Bien qu’il soit reconnu que les récepteurs bêta-2-adrénergiques sont les récepteurs prédominants dans le muscle lisse bronchique, les données indiquent qu’il existe une population de récepteurs bêta-2 dans le cœur humain, existant dans une concentration comprise entre 10% et 50%. La fonction précise de ces récepteurs n’a pas été établie (voir AVERTISSEMENTS). Les études cliniques contrôlées chez les patients ayant reçu de la Terbutaline par voie sous-cutanée n’ont pas révélé d’effet préférentiel bêta2-adrénergique.
Les effets pharmacologiques des agonistes bêta-adrénergiques, y compris la Terbutaline, sont au moins en partie attribuables à la stimulation par les récepteurs bêta-adrénergiques de l’adényl cyclase intracellulaire, l’enzyme qui catalyse la conversion de l’adénosine triphosphate (ATP) en 3’, 5’-adénosine monophosphate cyclique (AMPc). L’augmentation des taux d’AMPc est associée à la relaxation du muscle lisse bronchique et à l’inhibition de la libération de médiateurs d’hypersensibilité immédiate des cellules, en particulier des mastocytes.
Des études cliniques contrôlées ont montré que l’injection de sulfate de Terbutaline soulage le bronchospasme dans les maladies pulmonaires obstructives aiguës et chroniques en augmentant de manière significative les débits pulmonaires (par exemple, une augmentation de 15% ou plus du VEMS 1). Après administration sous-cutanée de 0,25 mg d’injection de sulfate de Terbutaline, un changement mesurable du débit expiratoire se produit généralement dans les 5 minutes et une augmentation cliniquement significative du VEMS 1 se produit dans les 15 minutes. L’effet maximal se produit généralement dans les 30 à 60 minutes et l’activité bronchodilatatrice cliniquement significative peut se poursuivre pendant 1,5 à 4 heures. La durée de l’amélioration cliniquement significative est comparable à celle observée avec des doses d’équimilligramme d’épinéphrine.
Des études précliniques
chez des animaux de laboratoire (minipigs, rongeurs et chiens) ont démontré la survenue d’arythmies cardiaques et de mort subite (avec des preuves histologiques de nécrose myocardique) lorsque des bêta-agonistes et des méthylxanthines sont administrés simultanément. La signification clinique de ces résultats est inconnue.
Pharmacocinétique
L’administration sous-cutanée de 0,5 mg de sulfate de Terbutaline à 17 sujets mâles adultes sains a entraîné une concentration plasmatique maximale moyenne (ET) de Terbutaline de 9,6 (3,6) ng/mL, qui a été observée à un temps médian (intervalle) de 0,5 (0,08 à 1,0) heures après l’administration. Les valeurs moyennes de l’ASC (SD) (0 à 48) et de la clairance corporelle totale étaient respectivement de 29,4 (14,2) hr* ng/mL et de 311 (112) mL/min. La demi-vie terminale a été déterminée chez 9 des 17 sujets et avait une moyenne (ET) de 5,7 (2,0) heures.
Après administration sous-cutanée de 0,25 mg de sulfate de Terbutaline à deux sujets masculins, des concentrations sériques maximales de Terbutaline de 5,2 et 5,3 ng/mL ont été observées environ 20 minutes après l’administration.
La demi-vie d’élimination du médicament chez 10 des 14 patients était d’environ 2,9 heures après l’administration sous-cutanée, mais des demi-vies d’élimination plus longues (entre 6 et 14 heures) ont été observées chez les 4 autres patients. Environ 90% du médicament a été excrété dans l’urine 96 heures après l’administration sous-cutanée, avec environ 60% de ce médicament inchangé. Il semble que le conjugué sulfate soit un métabolite majeur de la terbutaline et que l’excrétion urinaire soit la principale voie d’élimination.
Indications et utilisation pour la Terbutaline
L’injection de sulfate de terbutaline, USP est indiquée pour la prévention et l’inversion du bronchospasme chez les patients âgés de 12 ans et plus souffrant d’asthme et de bronchospasme réversible associé à une bronchite et à un emphysème.
Contre-indications
1. Tocolyse prolongée
Le sulfate de terbutaline n’a pas été approuvé et ne doit pas être utilisé pour une tocolyse prolongée (au-delà de 48 à 72 heures). En particulier, le sulfate de terbutaline ne doit pas être utilisé pour la tocolyse d’entretien en ambulatoire ou à domicile (voir AVERTISSEMENT ENCADRÉ: Tocolyse prolongée).
2. Hypersensibilité
L’injection de sulfate de terbutaline est contre-indiquée chez les patients connus pour être hypersensibles aux amines sympathomimétiques ou à tout composant de ce médicament.
Avertissements
Détérioration de l’asthme
L’asthme peut se détériorer de façon aiguë sur une période de quelques heures ou de façon chronique sur plusieurs jours ou plus. Si le patient a besoin de plus de doses de sulfate de terbutaline que d’habitude, cela peut être un marqueur de déstabilisation de l’asthme et nécessite une réévaluation du patient et du schéma thérapeutique, en tenant compte de la nécessité éventuelle d’un traitement anti‑inflammatoire, par exemple des corticostéroïdes.
Utilisation d’Agents anti-inflammatoires
L’utilisation de bronchodilatateurs agonistes bêta-adrénergiques seuls peut ne pas suffire à contrôler l’asthme chez de nombreux patients. Il faut envisager rapidement l’ajout d’agents anti‑inflammatoires, par exemple des corticostéroïdes.
Effets cardiovasculaires
Le sulfate de terbutaline, comme tous les autres agonistes bêta-adrénergiques, peut produire un effet cardiovasculaire cliniquement significatif chez certains patients, mesuré par le pouls, la pression artérielle et / ou les symptômes. Bien que de tels effets soient rares après l’administration de sulfate de terbutaline aux doses recommandées, s’ils surviennent, le médicament peut devoir être arrêté. De plus, il a été rapporté que les bêta‑agonistes produisent des modifications de l’électrocardiogramme (ECG), telles que l’aplatissement de l’onde T, l’allongement de l’intervalle QTc et la dépression du segment ST. La signification clinique de ces résultats est inconnue. Par conséquent, le sulfate de terbutaline, comme toutes les amines sympathomimétiques, doit être utilisé avec prudence chez les patients présentant des troubles cardiovasculaires, en particulier une insuffisance coronarienne, des arythmies cardiaques et une hypertension.
Convulsions
De rares cas de convulsions ont été rapportés chez des patients recevant de la Terbutaline; les convulsions ne se sont pas reproduites chez ces patients après l’arrêt du médicament.
Précautions
Généralités
La terbutaline, comme toutes les amines sympathomimétiques, doit être utilisée avec prudence chez les patients présentant des troubles cardiovasculaires, notamment une cardiopathie ischémique, une hypertension et des arythmies cardiaques; chez les patients atteints d’hyperthyroïdie ou de diabète sucré; et chez les patients qui réagissent de manière inhabituelle aux amines sympathomimétiques ou qui présentent des troubles convulsifs. Des changements significatifs de la pression artérielle systolique et diastolique ont été observés et pourraient survenir chez certains patients après l’utilisation de tout bronchodilatateur bêta-adrénergique.
Des réactions immédiates d’hypersensibilité et des exacerbations de bronchospasme ont été rapportées après administration de Terbutaline.
Les agonistes bêta-adrénergiques peuvent provoquer une hypokaliémie significative chez certains patients, peut-être par shunt intracellulaire, ce qui a le potentiel de produire des effets cardiovasculaires indésirables. La diminution est généralement transitoire, ne nécessitant pas de supplémentation.
De fortes doses de Terbutaline intraveineuse ont été rapportées pour aggraver le diabète sucré préexistant et l’acidocétose.
Interactions médicamenteuses
L’utilisation concomitante d’injection de sulfate de terbutaline avec d’autres agents sympathomimétiques n’est pas recommandée, car l’effet combiné sur le système cardiovasculaire peut être nocif pour le patient.
Inhibiteurs de la monoamine Oxydase ou antidépresseurs tricycliques: La Terbutaline doit être administrée avec une extrême prudence aux patients traités par des inhibiteurs de la monoamine oxydase ou des antidépresseurs tricycliques, ou dans les 2 semaines suivant l’arrêt de ces agents, car l’action de la Terbutaline sur le système vasculaire peut être potentialisée.
Bêta-bloquants: Les agents de blocage des récepteurs bêta-adrénergiques bloquent non seulement l’effet pulmonaire des bêta-agonistes, tels que l’injection de sulfate de terbutaline, mais peuvent produire un bronchospasme sévère chez les patients asthmatiques. Par conséquent, les patients asthmatiques ne doivent normalement pas être traités avec des bêta‑bloquants. Cependant, dans certaines circonstances, par exemple en prophylaxie après un infarctus du myocarde, il peut n’y avoir aucune alternative acceptable à l’utilisation d’agents de blocage bêta-adrénergiques chez les patients asthmatiques. Dans ce cadre, des bêta-bloquants cardiosélectifs pourraient être envisagés, bien qu’ils doivent être administrés avec prudence.
Diurétiques: Les modifications de l’ECG et / ou l’hypokaliémie pouvant résulter de l’administration de diurétiques épargneurs de potassium (tels que les diurétiques en boucle ou thiazidiques) peuvent être aggravées de manière aiguë par les bêta-agonistes, en particulier lorsque la dose recommandée du bêta-agoniste est dépassée. Bien que la signification clinique de ces effets ne soit pas connue, la prudence est recommandée lors de l’administration concomitante de bêta-agonistes et de diurétiques épargneurs de potassium.
Carcinogenèse, Mutagénèse, Altération de la fertilité
Dans une étude de 2 ans sur des rats Sprague-Dawley, le sulfate de Terbutaline a provoqué une augmentation significative et liée à la dose de l’incidence des léiomyomes bénins du mésovarium à des doses alimentaires de 50 mg/kg et plus (environ 810 fois la dose quotidienne maximale recommandée par voie sous‑cutanée (sc) pour les adultes en mg/m2). Dans une étude de 21 mois sur des souris CD-1, le sulfate de terbutaline n’a montré aucun signe de tumorigénicité à des doses alimentaires allant jusqu’à 200 mg / kg (environ 1 600 fois la dose quotidienne maximale recommandée de sc pour les adultes en mg / m2). Le potentiel de mutagénicité du sulfate de terbutaline n’a pas été déterminé.
Les études de reproduction chez le rat utilisant du sulfate de terbutaline n’ont montré aucune altération de la fertilité à des doses orales allant jusqu’à 50 mg/kg (environ 810 fois la dose quotidienne maximale recommandée de sc pour les adultes en mg/m2).
Effets tératogènes de la grossesse
Catégorie de grossesse C
Il n’existe pas d’études adéquates et bien contrôlées sur le sulfate de Terbutaline chez la femme enceinte. Des études animales publiées montrent que la progéniture de rat présente des altérations du comportement et du développement cérébral, y compris une diminution de la prolifération cellulaire et de la différenciation lorsque les mères ont été traitées par voie sous-cutanée avec de la Terbutaline au stade avancé de la grossesse et de la période de lactation. L’exposition à la terbutaline chez les mères de rats était d’environ 24 à 48 fois la dose commune chez l’homme chez l’adulte de 2 à 4 mg/jour, sur une base de mg/m2.
Le sulfate de terbutaline n’a pas été approuvé et ne doit pas être utilisé pour une tocolyse prolongée (au-delà de 48 à 72 heures). En particulier, le sulfate de terbutaline ne doit pas être utilisé pour l’entretien tocolyse en ambulatoire ou à domicile. Des effets indésirables graves, y compris le décès, ont été rapportés après administration de sulfate de terbutaline à des femmes enceintes. Chez la mère, ces effets indésirables comprennent une augmentation de la fréquence cardiaque, une hyperglycémie transitoire, une hypokaliémie, des arythmies cardiaques, un œdème pulmonaire et une ischémie myocardique. Une augmentation de la fréquence cardiaque fœtale et une hypoglycémie néonatale peuvent survenir à la suite de l’administration maternelle (voir AVERTISSEMENT ENCADRÉ: Tocolyse prolongée et CONTRE-INDICATIONS: Tocolyse prolongée).
Dans les études sur le développement embryofétal chez l’animal, aucun effet tératogène n’a été observé chez la progéniture lorsque des rats et des lapins gravides ont reçu du sulfate de terbutaline à des doses orales allant jusqu’à 50 mg/kg/jour, soit environ 810 et 1 600 fois, respectivement, la dose quotidienne maximale recommandée par voie sous-cutanée pour les adultes, en mg/m2.
Le sulfate de terbutaline ne doit être utilisé pendant la grossesse que si les avantages potentiels justifient le risque potentiel pour le fœtus.
Utilisation Pendant le travail et l’accouchement
En raison du potentiel d’interférence bêta-agoniste avec la contractilité utérine, l’utilisation de l’injection de sulfate de Terbutaline pour soulager le bronchospasme pendant le travail doit être limitée aux patients chez lesquels les bénéfices l’emportent clairement sur le risque.
La terbutaline traverse le placenta. Après administration d’une dose unique de Terbutaline par voie intraveineuse à 22 femmes en fin de grossesse qui ont été accouchées par césarienne élective pour des raisons cliniques, les taux sanguins ombilicaux de Terbutaline se situaient entre 11% et 48% des taux sanguins maternels.
Mères allaitantes
On ne sait pas si ce médicament est excrété dans le lait maternel. Par conséquent, l’injection de sulfate de terbutaline ne doit être utilisée pendant l’allaitement que si le bénéfice potentiel justifie le risque possible pour le nouveau-né.
Utilisation pédiatrique
L’injection de sulfate de terbutaline n’est pas recommandée chez les patients de moins de 12 ans en raison de données cliniques insuffisantes pour établir l’innocuité et l’efficacité.
Utilisation gériatrique
Les études cliniques sur l’injection de sulfate de terbutaline n’ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s’ils répondent différemment des sujets plus jeunes. D’autres expériences cliniques rapportées n’ont pas mis en évidence de différences de réponses entre les patients âgés et les patients plus jeunes. En général, la sélection de la dose chez un patient âgé doit être prudente, en commençant généralement à l’extrémité inférieure de la plage posologique, reflétant la plus grande fréquence de diminution de la fonction hépatique, rénale ou cardiaque et de maladie concomitante ou d’un autre traitement médicamenteux.
Effets indésirables
Les effets indésirables observés avec l’injection de sulfate de Terbutaline sont similaires à ceux couramment observés avec d’autres agents sympathomimétiques. Toutes ces réactions sont de nature transitoire et ne nécessitent généralement pas de traitement.
Le tableau suivant compare les effets indésirables observés chez les patients traités par injection de sulfate de Terbutaline (0,25 mg et 0,5 mg), avec ceux observés chez les patients traités par injection d’épinéphrine (0,25 mg et 0,5 mg), au cours de huit études croisées en double aveugle portant sur un total de 214 patients.
| Incidence (%) of Adverse Reactions | |||||
| Terbutaline (%) | Epinephrine (%) | ||||
|
0.25 mg |
0.5 mg N = 205 |
0.25 mg N = 153 |
0.5 mg N = 61 |
||
| Reaction Central Nervous System |
|||||
| Tremor | 7.8 | 38.0 | 16.3 | 18.0 | |
| Nervousness | 16.9 | 30.7 | 8.5 | 31.1 | |
| Dizziness | 1.3 | 10.2 | 7.8 | 3.3 | |
| Headache | 7.8 | 8.8 | 3.3 | 9.8 | |
| Drowsiness | 11.7 | 9.8 | 14.4 | 8.2 | |
| Cardiovascular | |||||
| Palpitations | 7.8 | 22.9 | 7.8 | 29.5 | |
| Tachycardia | 1.3 | 1.5 | 2.6 | 0.0 | |
| Respiratory | |||||
| Dyspnea | 0.0 | 2.0 | 2.0 | 0.0 | |
| Chest discomfort | 1.3 | 1.5 | 2.6 | 0.0 | |
| Gastrointestinal | |||||
| Nausea/vomiting | 1.3 | 3.9 | 1.3 | 11.5 | |
| Systemic | |||||
| Weakness | 1.3 | 0.5 | 2.6 | 1.6 | |
| Flushed feeling | 0.0 | 2.4 | 1.3 | 0.0 | |
| Sweating | 0.0 | 2.4 | 0.0 | 0.0 | |
| Pain at injection site | 2.6 | 0.5 | 2,6 | 1,6 | |
Remarque: Certains patients ont reçu plus de plus d’une dose de sulfate de terbutaline et d’épinéphrine. De plus, des cas d’anxiété, de crampes musculaires et de sécheresse de la bouche ont été rapportés (< 0,5%). De rares cas d’élévation des enzymes hépatiques et de vascularite d’hypersensibilité avec administration de Terbutaline ont été rapportés.
Pour signaler LES EFFETS INDÉSIRABLES SUSPECTÉS, contactez Hikma Pharmaceuticals USA Inc.. au 1-877-233-2001, ou la FDA au 1-800-FDA-1088 ou www.fda.gov/medwatch .
Surdosage
La dose létale médiane de sulfate de Terbutaline chez les rats matures était d’environ 165 mg/kg (environ 2 700 fois la dose quotidienne maximale recommandée de sulfate de terbutaline chez les adultes en mg/m2). La dose létale médiane de sulfate de terbutaline chez les jeunes rats était d’environ 2 000 mg/kg (environ 32 000 fois la dose quotidienne maximale recommandée de sulfate de terbutaline chez les adultes en mg/m2).
Les symptômes attendus d’un surdosage sont ceux d’une stimulation bêta-adrénergique excessive et / ou de l’apparition ou de l’exagération de l’un des symptômes énumérés sous EFFETS INDÉSIRABLES, par exemple, convulsions, angine de poitrine, hypertension ou hypotension, tachycardie avec des taux allant jusqu’à 200 battements par minute, arythmies, nervosité, maux de tête, tremblements, bouche sèche, palpitations, nausées, vertiges, fatigue, malaise et insomnie. Une hypokaliémie peut également survenir. Il n’existe pas d’antidote spécifique. Le traitement consiste en l’arrêt de l’injection de sulfate de terbutaline avec un traitement symptomatique approprié. L’utilisation judicieuse d’un bloqueur des récepteurs bêta cardiosélectifs peut être envisagée, en gardant à l’esprit qu’un tel médicament peut produire un bronchospasme. Les preuves sont insuffisantes pour déterminer si la dialyse est bénéfique en cas de surdosage de l’injection de sulfate de terbutaline.
Posologie et administration de la Terbutaline
Les flacons doivent être utilisés uniquement pour une administration sous-cutanée et non pour une perfusion intraveineuse.
La stérilité et le dosage précis ne peuvent pas être assurés si les flacons ne sont pas utilisés conformément à la POSOLOGIE ET à L’ADMINISTRATION.
Jeter la portion inutilisée après une seule utilisation chez le patient.
La dose sous-cutanée habituelle d’injection de sulfate de Terbutaline est de 0,25 mg injectée dans la région deltoïde latérale. Si aucune amélioration clinique significative ne se produit dans les 15 à 30 minutes, une deuxième dose de 0,25 mg peut être administrée. Si le patient ne répond pas dans les 15 à 30 minutes supplémentaires, d’autres mesures thérapeutiques doivent être envisagées. La dose totale dans les 4 heures ne doit pas dépasser 0,5 mg.
Remarque: Les produits médicamenteux parentéraux doivent être inspectés visuellement pour détecter les particules et la décoloration avant l’administration, lorsque la solution et le contenant le permettent.
Comment la Terbutaline est-elle fournie
Le sulfate de Terbutaline injectable, USP, 1 mg / mL, est fourni à un volume de 1 mL contenu dans un flacon en verre ambré de 2 mL. Chaque flacon contient 1 mg de sulfate de terbutaline par 1 mL de solution; 0,25 mL de solution fournira la dose clinique habituelle de 0,25 mg.
NDC 0143-9375-10 Carton de 10 flacons.
Conserver entre 20 et 25 °C (68 et 77 °F).
Protéger de la lumière en stockant les flacons dans leur emballage d’origine jusqu’à ce qu’ils soient distribués.
Ne pas utiliser si la solution est décolorée.
Jeter la portion inutilisée après une seule utilisation chez le patient.
Fabriqué par:
HIKMA FARMACÊUTICA (PORTUGAL), S.A..
Estrada do Rio da Mó, nº 8, 8A e 8B – Fervença,
2705-906 Terrugem SNT,
PORTUGAL
Distribué par:
Hikma Pharmaceuticals USA Inc.
Eatontown, NJ 07724 États-Unis
Novaplus est une marque déposée de Vizient, Inc.
Révisé: Octobre 2020
PIN552-NOV/ 2
PANNEAU D’AFFICHAGE PRINCIPAL
NDC 0143-9375-01 Rx UNIQUEMENT
Terbutaline
SULFATE
INJECTION, USP
1 mg/ mL
POUR
UTILISATION SOUS-CUTANÉE UNIQUEMENT

PANNEAU D’AFFICHAGE PRINCIPAL
NDC 0143-9375-10 Rx UNIQUEMENT
Terbutaline
SULFATE
INJECTION, USP
1 mg/ mL
POUR
UTILISATION SOUS-CUTANÉE UNIQUEMENT
Flacons Unidoses De 10 X 1 mL
SOLUTION AQUEUSE
STÉRILE, NON PYROGÉNIQUE POUR INJECTION SOUS-CUTANÉE.
NE PAS UTILISER SI LA SOLUTION EST DÉCOLORÉE.
REMARQUE: LA DOSE UNIQUE HABITUELLE REPRÉSENTE LE QUART
DU CONTENU DU FLACON. SEE PRESCRIBING
INFORMATION.
SERIALIZATION IMAGE
| Terbutaline SULFATE Terbutaline sulfate injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Hikma Pharmaceuticals USA Inc. (001230762)
Inscrit – HIKMA FARMACEUTICA (PORTUGAL), S.A. (452742943)
En savoir plus sur la terbutaline
- Effets secondaires
- Pendant la grossesse ou l’allaitement
- Informations posologiques
- Images du médicament
- Interactions médicamenteuses
- Comparez les alternatives
- Prix &Coupons
- En anglais
- 11 Avis
- Classe de médicament: bronchodilatateurs adrénergiques
- Alertes de la FDA (1)
Ressources pour les consommateurs
- Informations sur les Patients
- Terbutaline (Lecture Avancée)
- Terbutaline Sous-cutanée (Lecture Avancée)
Ressources professionnelles
- Informations sur la Prescription
- Terbutaline (Conseils Professionnels aux Patients)
- Comprimés de Terbutaline (FDA)
Guides de traitement connexes
- Travail prématuré
- Asthme allergique
- Asthme d’entretien
- Asthme aigu
Avertissement médical