Comme la plupart des nouveaux ions hydroxydes sont éliminés, le pH n’augmente pas beaucoup.
Élimination des ions hydroxydes par réaction avec des ions hydrogène
Rappelez-vous qu’il y a des ions hydrogène présents lors de l’ionisation de l’acide éthanoïque.
![]()
![]()
Les ions hydroxydes peuvent se combiner avec ceux-ci pour produire de l’eau. Dès que cela se produit, les conseils d’équilibre pour les remplacer. Cela continue jusqu’à ce que la plupart des ions hydroxydes soient éliminés.
![]()
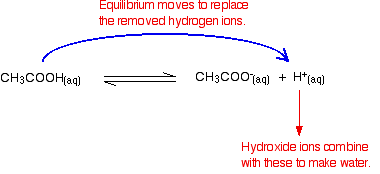
Encore une fois, parce que vous avez des équilibres impliqués, tous les ions hydroxydes ne sont pas éliminés – juste la plupart d’entre eux. L’eau formée se ré-ionise dans une très faible mesure pour donner quelques ions hydrogène et des ions hydroxyde.
Solutions tampons alcalines
Nous prendrons un mélange de solutions d’ammoniac et de chlorure d’ammonium comme typique.
L’ammoniac est une base faible, et la position de cet équilibre sera bien à gauche:
![]()
![]()
Ajouter du chlorure d’ammonium à cela ajoute beaucoup d’ions ammonium supplémentaires. Selon le principe de Le Chatelier, cela fera basculer la position de l’équilibre encore plus à gauche.
La solution contiendra donc ces éléments importants:
-
beaucoup d’ammoniac n’ayant pas réagi;
-
beaucoup d’ions ammonium provenant du chlorure d’ammonium;
-
suffisamment d’ions hydroxyde pour rendre la solution alcaline.
D’autres choses (comme l’eau et les ions chlorure) qui sont présentes ne sont pas importantes pour l’argument.
Ajout d’un acide à cette solution tampon
Il existe deux processus qui peuvent éliminer les ions hydrogène que vous ajoutez.
Élimination par réaction avec l’ammoniac
La substance de base la plus probable avec laquelle un ion hydrogène va entrer en collision est une molécule d’ammoniac. Ils réagiront pour former des ions ammonium.
![]()
![]()
La plupart des ions hydrogène, mais pas tous, seront éliminés. L’ion ammonium est faiblement acide et une partie des ions hydrogène sera donc libérée à nouveau.
Élimination des ions hydrogène par réaction avec des ions hydroxyde
Rappelez-vous qu’il y a des ions hydroxyde présents lors de la réaction entre l’ammoniac et l’eau.
![]()
![]()
Les ions hydrogène peuvent se combiner avec ces ions hydroxydes pour former de l’eau. Dès que cela se produit, l’équilibre se termine pour remplacer les ions hydroxyde. Cela continue jusqu’à ce que la plupart des ions hydrogène soient éliminés.
![]()
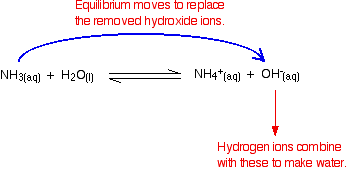
Encore une fois, parce que vous avez des équilibres impliqués, tous les ions hydrogène ne sont pas éliminés – juste la plupart d’entre eux.
Ajouter un alcali à cette solution tampon
Les ions hydroxydes de l’alcali sont éliminés par une simple réaction avec les ions ammonium.
![]()
![]()
Comme l’ammoniac formé est une base faible, il peut réagir avec l’eau – et donc la réaction est légèrement réversible. Cela signifie que, encore une fois, la plupart (mais pas tous) des ions hydroxyde sont éliminés de la solution.
Calculs impliquant des solutions tampons
Ceci n’est qu’une brève introduction. Il y a plus d’exemples, y compris plusieurs variantes, sur 10 pages dans mon livre de calculs de chimie.
Solutions tampons acides
Ceci est plus facile à voir avec un exemple spécifique. Rappelez-vous qu’un tampon acide peut être fabriqué à partir d’un acide faible et de l’un de ses sels.
Supposons que vous ayez une solution tampon contenant 0,10 mole de dm-3 d’acide éthanoïque et 0.20 moles dm-3 d’éthanoate de sodium. Comment calculez-vous son pH?
Dans toute solution contenant un acide faible, il existe un équilibre entre l’acide non ionisé et ses ions. Donc, pour l’acide éthanoïque, vous avez l’équilibre:
![]()
![]()
La présence des ions éthanoate de l’éthanoate de sodium aura déplacé l’équilibre vers la gauche, mais l’équilibre existe toujours.
Cela signifie que vous pouvez écrire la constante d’équilibre, Ka, pour cela:
![]()
![]()
Lorsque vous avez effectué des calculs en utilisant cette équation précédemment avec un acide faible, vous aurez supposé que les concentrations des ions hydrogène et des ions éthanoate étaient les mêmes. Chaque molécule d’acide éthanoïque qui se divise en donne un de chaque type d’ion.
Ce n’est plus vrai pour une solution tampon:
![]()
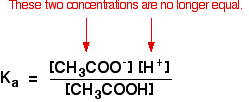
Si l’équilibre a été poussé encore plus à gauche, le nombre d’ions éthanoate provenant de l’acide éthanoïque sera complètement négligeable par rapport à ceux de l’éthanoate de sodium.
On suppose donc que la concentration en ions éthanoate est la même que la concentration en éthanoate de sodium – dans ce cas, 0,20 mole de dm-3.
Dans un calcul d’acide faible, nous supposons normalement que si peu d’acide s’est ionisé que la concentration de l’acide à l’équilibre est la même que la concentration de l’acide que nous avons utilisée. C’est encore plus vrai maintenant que l’équilibre a été déplacé encore plus à gauche.
Donc les hypothèses que nous faisons pour une solution tampon sont:
![]()
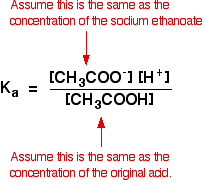
Maintenant, si nous connaissons la valeur de Ka, nous pouvons calculer la concentration en ions hydrogène et donc le pH.
Ka pour l’acide éthanoïque est de 1,74 x 10-5 mol dm – 3.
Rappelez-vous que nous voulons calculer le pH d’une solution tampon contenant 0,10 mol dm-3 d’acide éthanoïque et 0,20 mol dm-3 d’éthanoate de sodium.
![]()
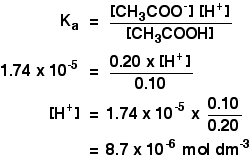
Ensuite, tout ce que vous avez à faire est de trouver le pH en utilisant l’expression
pH=-log10
Vous aurez toujours la valeur de la concentration en ions hydrogène sur votre calculatrice, appuyez donc sur le bouton log et ignorez le signe négatif (pour permettre le signe moins dans l’expression du pH).
Vous devriez obtenir une réponse de 5,1 à deux chiffres significatifs. Vous ne pouvez pas être plus précis que cela, car vos concentrations n’ont été données qu’à deux chiffres.