Quelle quantité d’énergie est libérée lors de l’hydrolyse de l’ATP?
Mode lecteur
L’ATP est souvent appelée monnaie d’énergie de la cellule. Des centaines de réactions dans la cellule, des transformations métaboliques aux événements de signalisation, sont couplées à l’hydrolyse (signifiant littéralement « relâchement de l’eau”) de l’ATP par l’eau. La réaction ATP+ H2O <>ADP+Pi transforme l’adénosine triphosphate (ATP) en adénosine diphosphate (ADP) et en phosphate inorganique (Pi). Le changement d’énergie libre associé à cette réaction entraîne une grande partie des réactions cellulaires, le potentiel membranaire et la puissance réductrice étant les deux autres sources d’énergie dominantes. Mais combien vaut exactement cette monnaie énergétique et que révèle-t-elle sur les transactions chimiques pouvant être achetées? Bien sûr, il n’y a pas de réponse unique à cette question car la quantité d’énergie libérée par cette réaction d’hydrolyse dépend des conditions intracellulaires, mais il est possible de se faire une idée de la « valeur” approximative de cette monnaie en recourant à quelques estimations simples.

Figure 1: La relation entre l’énergie libre de Gibbs de l’hydrolyse de l’ATP dans des conditions standard et la constante d’équilibre, et la relation entre l’énergie libre de l’hydrolyse dans des conditions physiologiques et les concentrations de réactifs physiologiques.
Le changement d’énergie libre de Gibbs (ΔG) dû à l’hydrolyse de l’ATP dépend des concentrations des différents participants à la réaction comme représenté sur la figure 1. Lorsque les concentrations sont plus éloignées de leurs valeurs d’équilibre, la valeur absolue de ΔG est supérieure. Dans des conditions » standard » (c.-à-d. concentrations de 1M pour tous les réactifs sauf l’eau qui est prise à sa concentration caractéristique de 55M) l’énergie libre de Gibbs de l’hydrolyse de l’ATP varie de -28 à -34 kJ/mol (c’est-à-dire ≈12 kBT, BNID 101989) en fonction de la concentration du cation Mg2+. La dépendance aux ions Mg se produit parce que les ions magnésium chargés positivement aident à stabiliser la molécule d’ATP. Cependant, dans la cellule, les conditions ne sont même jamais proches des valeurs d’état standard. Par exemple, une concentration de 1M d’ATP signifierait que la masse du soluté serait similaire à celle du solvant de l’eau lui-même. Sur la figure 1, nous montrons la dérivation souvent déroutante de l’énergie libre physiologique (ΔG) compte tenu du rapport des concentrations à partir de la valeur standard (ΔGo). La division par des termes tels que ceux nécessaires pour prendre en charge les unités en tant que logarithme doit toujours contenir un terme sans unité. Il est parfois surprenant de penser que si la cellule était à l’équilibre, la valeur de ΔG aurait été nulle, et qu’il n’y aurait pas d’énergie à gagner par hydrolyse de l’ATP. Heureusement, ce n’est jamais le cas chez les organismes vivants. .
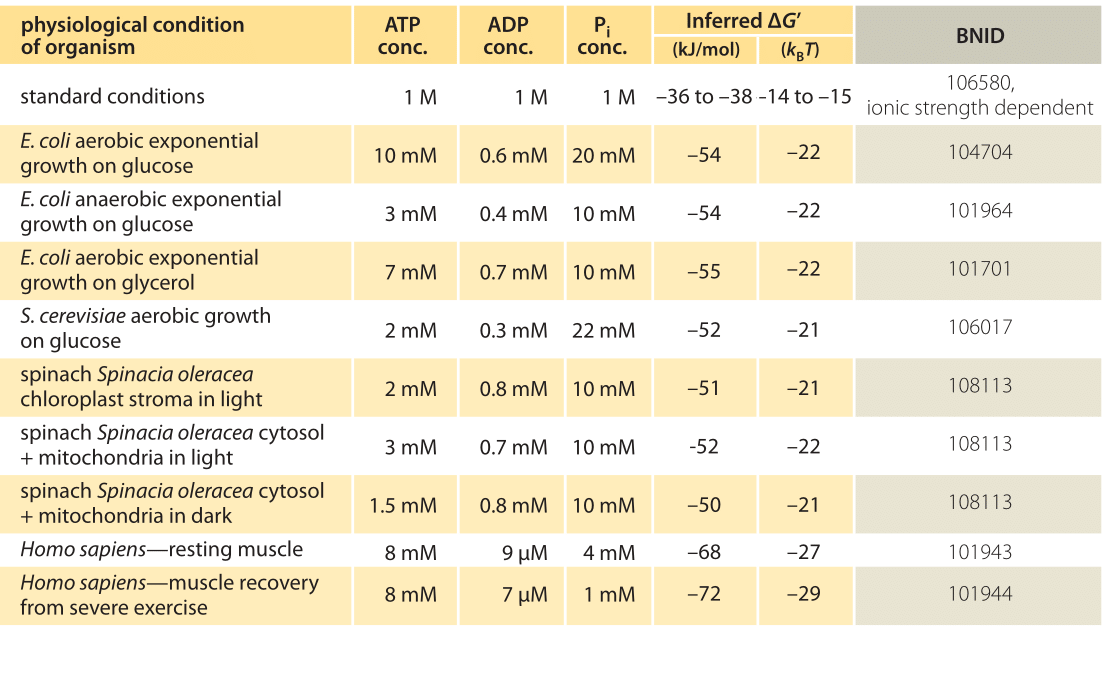
Tableau 1: Énergie libre pour l’hydrolyse de l’ATP dans divers organismes et dans différentes conditions physiologiques. Calcul ΔG’ inféré basé sur une valeur de ΔG’0 de -37,6 kJ/mol. Cela rend les valeurs du tableau cohérentes entre elles, mais crée de petits écarts par rapport aux valeurs ΔG’ rapportées dans les sources primaires. De tels écarts peuvent résulter de variations de la force ionique, du pH et des biais des méthodes de mesure. Les valeurs sont arrondies à un ou deux chiffres significatifs. Chez les épinards, où la concentration en Pi n’a pas été rapportée, une valeur caractéristique de 10 mM a été utilisée (BNID 103984, 103983, 111358, 105540).
En pratique, les conditions physiologiques dépendent de l’organisme étudié, du tissu ou du compartiment de la cellule considérée et des besoins énergétiques actuels pour les réactions métaboliques et autres. Par exemple, dans le foie de rat perfusé, le rapport ATP/ ADP était d’environ 10: 1 dans le cytosol, mais de 1: 10 dans les mitochondries sous des taux élevés de glycolyse et sous de faibles taux de glycolyse, les deux rapports étaient très proches de 1 (BNID 111357). Par conséquent, une plage de valeurs pour ΔG est attendue. La clé pour comprendre cette plage est de comprendre dans quelle mesure Q diffère de K, c’est-à-dire en quoi les concentrations diffèrent des conditions standard. Les concentrations intracellulaires typiques de tous les composants pertinents (ATP, ADP et Pi) sont de l’ordre du mM, bien inférieures aux conditions standard. Le rapport / avec des concentrations dans la gamme mM est bien inférieur à un, et la réaction sera énergétiquement plus favorable qu’aux conditions standard comme indiqué dans le tableau 1. La valeur la plus élevée ≈-70 kJ / mol (≈30kBT) a été calculée à partir des valeurs dans le muscle humain des athlètes en convalescence après un effort (BNID 101944). Dans les cellules d’E. coli se développant sur du glucose, une valeur de -47 kJ/mol a été rapportée (≈20kBT, BNID 101964). Pour mettre ces chiffres en perspective, un moteur moléculaire qui exerce une force d’environ 5 pN (BNID 101832) sur une taille de pas de 10 nm (BNID 101857) fonctionne de l’ordre de 50 PN nm, nécessitant un peu plus de 10 kBT d’énergie, bien dans la plage de ce qu’un seul ATP peut fournir.
Les calculs de ΔG nécessitent une mesure précise des concentrations intracellulaires pertinentes. De telles concentrations sont mesurées in vivo chez l’homme en utilisant la résonance magnétique nucléaire. La forme naturelle du phosphore (31P) a des propriétés magnétiques, il n’est donc pas nécessaire d’ajouter de substance externe. Le tissu d’intérêt tel que le muscle est placé dans un fort champ magnétique et les changements de fréquence des impulsions radio sont utilisés pour déduire la concentration d’ATP et de Pi directement à partir des pics dans les spectres RMN. Dans E. coli, les concentrations d’ATP peuvent être mesurées plus directement avec un test de bioluminescence ATP. Un échantillon de bactéries en croissance retirées de la culture peut être dosé à l’aide de la luciférase, une protéine issue de bactéries qui vivent en symbiose avec les calmars, mais qui a maintenant rejoint la boîte à outils des biologistes en tant que rapporteur moléculaire. L’enzyme luciférase utilise l’ATP dans une réaction qui produit de la lumière qui peut être mesurée à l’aide d’un luminomètre, et la concentration d’ATP peut être déduite de la force du signal. Nous avons donc le contenu cellulaire comme entrée, la luciférase comme « dispositif » qui transforme la quantité d’ATP en émission de lumière qui sert de sortie mesurée. En utilisant de tels outils, on constate que dans la « vraie vie”, l’ATP vaut environ deux fois plus que dans des conditions « standard” car les concentrations sont plus favorables à la réaction directe.
Nous terminons en notant qu’il s’agit d’une question permanente quant à la raison pour laquelle le nucléotide adénine a été choisi pour servir de monnaie d’énergie principale avec le GTP et les autres nucléotides jouant des rôles beaucoup plus mineurs. Est-ce un cas de choix aléatoire qui est devenu plus tard un « accident gelé” ou y avait-il un avantage sélectif pour l’ATP par rapport au GTP, au CTP, à l’UTP et au TTP?




