Introduction
L’isolement électrique des veines pulmonaires (PV) est la pierre angulaire des stratégies d’ablation par cathéter pour la fibrillation auriculaire paroxystique et persistante (FA). Les modalités énergétiques actuellement disponibles telles que la radiofréquence, la cryothérapie et l’isolation PV par laser (PVI) sont limitées par des taux de reconnexion PV à long terme qui, au mieux, vont de 22% à 38%, 1, 2 avec d’autres études rapportant des taux allant jusqu’à 62,5%.3 Le chauffage des tissus (radiofréquence) ou la congélation (cryothérapie), les deux approches les plus couramment utilisées, ablent les tissus de manière aveugle sans distinguer les plans tissulaires. Par conséquent, ces sources d’énergie sont associées à des dommages collatéraux tels que des lésions du nerf phrénique et de l’œsophage, y compris la redoutée fistule auriculaire-œsophagienne. De plus, l’ablation par cathéter peut être associée à d’autres complications telles que la sténose PV, les vapeurs et le risque d’AVC emboliques.4,5 Ces limites de sécurité sont malheureusement aggravées par l’absence de transmuralité constante des lésions, un mécanisme connu de récurrence de la FA.6 Il y a donc eu un besoin pressant d’une stratégie ablative non seulement très efficace mais aussi extrêmement sûre.
L’ablation par champ pulsé (PFA) est une modalité d’énergie non thermique qui est utilisée à la fois pour l’électrotransfert de gènes et l’ablation de tumeurs d’organes solides depuis de nombreuses années.7,8 Plus récemment, les chercheurs ont démontré un profil de sécurité unique et une efficacité ablative liée à sa capacité à cibler sélectivement les cardiomyocytes tout en épargnant les tissus collatéraux. Cela a propulsé la PFA sous les projecteurs en tant que nouvelle source d’énergie pour l’ablation cardiaque.
Principes fondamentaux de la PFA
La PFA est largement basée sur le concept d’ablation par courant continu qui a été brièvement utilisé dans les années 1980 avant la disponibilité de l’énergie radiofréquence.4 Plus précisément, le PFA implique l’application rapide (en dessous de la seconde) d’impulsions électriques intermittentes de haute intensité pour créer un champ électrique à travers la bicouche lipidique de la membrane cellulaire afin de créer des pores à l’échelle nanométrique (électroporation) dans la membrane cellulaire (figure 1). Le terme électroporation réversible fait référence à la formation non permanente de pores lorsqu’un champ électrique de faible intensité ne dépassant pas le seuil du tissu cible est appliqué. D’autre part, l’électroporation irréversible fait référence à la création de pores permanents lorsque le champ électrique dépasse le seuil du tissu cible. Ces pores permanents entraînent une fuite du contenu cellulaire, aboutissant à la mort cellulaire (figure 2). La caractéristique la plus précieuse de la PFA cardiaque est peut-être sa sélectivité myocardique, ce qui fait que les cardiomyocytes ont les valeurs de seuil de champ électrique les plus basses (400 V / cm) de tous les types de tissus.4,5
Figure 1
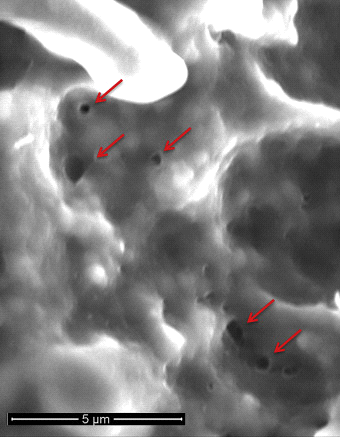
Figure 1

Figure 2
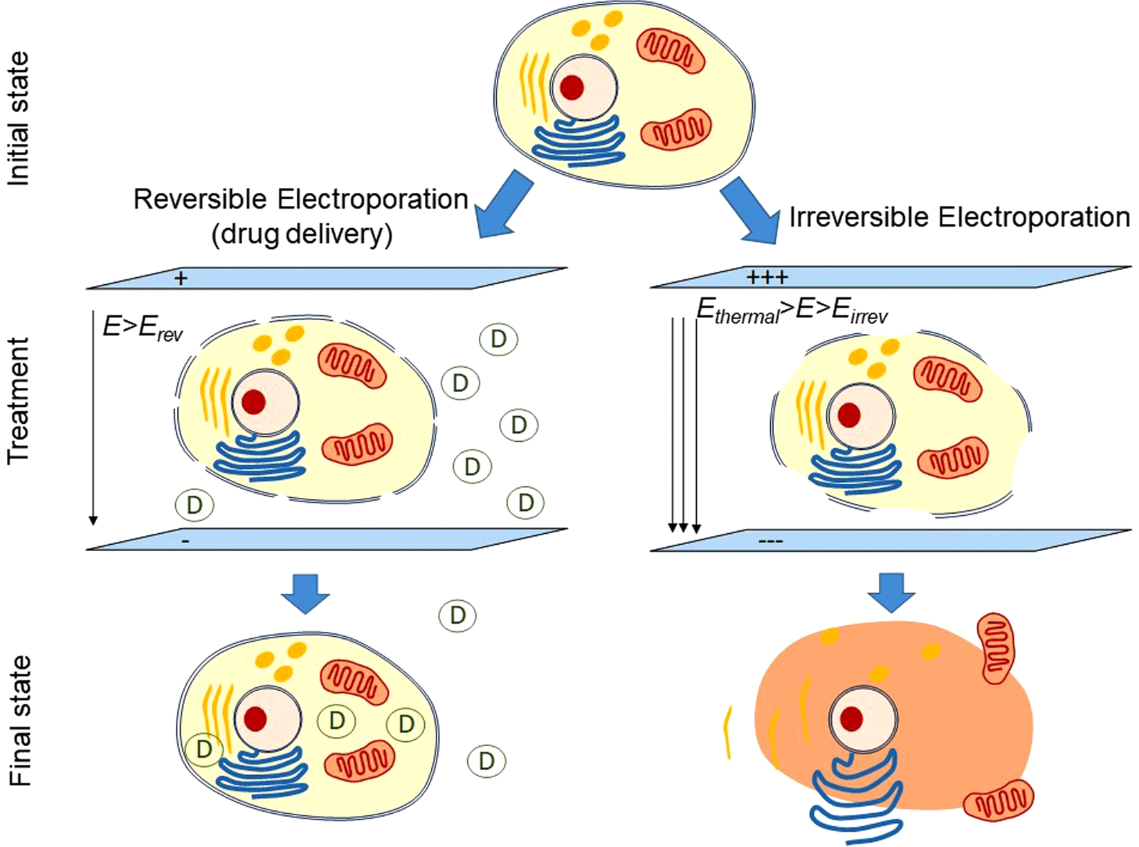
Figure 2

Technologie PFA
PFA est un terme englobant qui fait référence à un spectre de caractéristiques de conception d’impulsions et de cathéters. Ces caractéristiques sont étroitement liées au profil d’efficacité et d’innocuité du PFA. Une caractéristique de la PFA qui a une implication significative dans le flux de travail clinique est la conception de la forme d’onde. Les formes d’onde monophasiques provoquent généralement une activation musculaire importante, obligeant l’utilisation d’une anesthésie générale et d’une paralysie neuromusculaire. Inversement, les formes d’onde PFA biphasiques ont démontré un engagement musculaire squelettique limité, ce qui lui permet d’être utilisé cliniquement sans avoir besoin de paralysies.9
Données précliniques
Les données de faisabilité expérimentale préclinique sur la PFA en tant que traitement ablatif du tissu myocardique se sont accumulées au cours de la dernière décennie.Les lésions de PFA 4,10-14 dans le tissu cardiaque sont caractéristiquement homogènes et épargnent la matrice extracellulaire à l’intérieur de l’échafaudage tissulaire.4 Cela contraste avec les lésions aveugles et perturbatrices créées avec des sources d’énergie thermique. En ce qui concerne la PFA et le tissu auriculaire, les chercheurs ont démontré une gaine myocardique complètement ablée avec des applications monophasiques de 200 Joules dans l’ostie PV porcine sans cicatrisation ni prolifération significative de l’intima et de la lame élastique.11 Fait important, malgré la création de lésions à l’intérieur du PV lui-même, les diamètres du PV n’ont pas été affectés, 10, 11 attestant du mécanisme ablatif non sténotique unique du PFAs. Dans le tissu ventriculaire, il a été démontré que la PFA crée de grandes lésions avec une épargne du système vasculaire et des nerfs à l’intérieur et à proximité de la lésion.15 De plus, il a été démontré que la PFA épargnait les couches muqueuses et sous-muqueuses de l’œsophage malgré l’application délibérée de la PFA sur l’œsophage.Il a également été démontré que le PFA 16,17 ne blesse pas le nerf phrénique malgré de multiples applications le long de son parcours.18 Ces résultats importants suggèrent que la PFA a un profil de sécurité unique qui la rend extrêmement attrayante pour l’ablation des tissus auriculaires. Les évaluations précliniques susmentionnées ont toutes été réalisées avec une forme d’onde PFA monophasique. Des données précliniques plus récentes avec des formes d’onde PFA biphasiques plus récentes ont été encourageantes pour créer des lésions auriculaires transmurales homogènes et contiguës et pour atteindre des paramètres pertinents tels qu’une isolation PV durable.19 Il est important de noter que chaque forme d’onde PFA doit être considérée comme une entité unique et nécessite une évaluation préclinique détaillée de l’innocuité et de l’efficacité.
Données cliniques
Reddy et al. ont été les premiers à décrire l’expérience clinique aiguë initiale avec PFA endocardique et épicardique. Ils ont mené une étude prospective ouverte et non randomisée de la PFA chez des patients atteints de FA.5 Dans cette étude, un cathéter PFA multipline sur fil personnalisé (FARAWAVE) a été utilisé pour administrer des lésions endocardiques au niveau de l’antre PV chez 15 patients. Ce cathéter PFA endocardique a 5 cannelures, contenant chacune 4 électrodes, et peut prendre une configuration de fleur ou de panier. Cette conception tient compte de la couverture ostiale et antrale circonférentielle de picovolte (figure 3). De plus, un cathéter linéaire de PFA a été utilisé pour obtenir une isolation combinée de la PVI et de l’auriculaire gauche postérieure (ensemble de lésions box) chez 7 patients supplémentaires lors d’une chirurgie cardiaque concomitante. Les formes d’onde de tension pulsée monophasique ont été délivrées de manière bipolaire dans cette étude; par conséquent, toutes les procédures ont été effectuées sous anesthésie générale. La PVI endocardique a connu un succès aigu chez les 15 patients (100%) avec 3,26 ± 0,5 lésions / PV et des délais de livraison d’énergie de < 60 secondes par patient. Les lésions de la boîte ont réussi à isoler la paroi postérieure chez 6 patients sur 7 (86%). Le profil d’innocuité aiguë était excellent, sans complications procédurales.
Figure 3
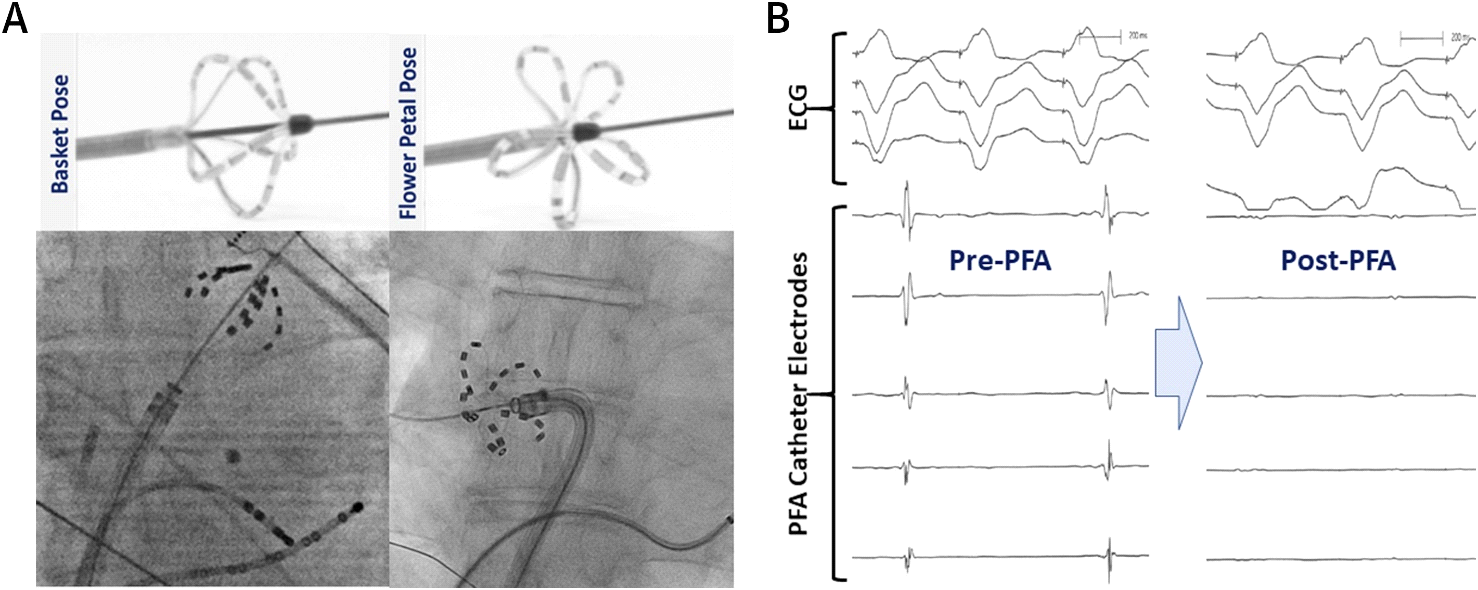
Figure 3
 – cathéter PFA en fil dans la pose du panier (à gauche) et la pose de la fleur (à droite) dans la rangée supérieure. La rangée inférieure montre des images fluoroscopiques du cathéter situé à l’ostium du PV supérieur gauche (gauche) et à l’ostium du PV inférieur droit (droite). (B) Les potentiels PV enregistrés par le cathéter PFA immédiatement avant et après une application de PFA confirment l’isolement du PV. Réimprimé avec la permission de Reddy et coll.20
– cathéter PFA en fil dans la pose du panier (à gauche) et la pose de la fleur (à droite) dans la rangée supérieure. La rangée inférieure montre des images fluoroscopiques du cathéter situé à l’ostium du PV supérieur gauche (gauche) et à l’ostium du PV inférieur droit (droite). (B) Les potentiels PV enregistrés par le cathéter PFA immédiatement avant et après une application de PFA confirment l’isolement du PV. Réimprimé avec la permission de Reddy et coll.20 Par la suite, le même groupe a récemment publié les données combinées de deux essais cliniques non randomisés de PFA à base de cathéter chez des patients atteints de FA paroxystique.20 Ensemble, ces essais ont inclus 81 patients présentant une FA paroxystique symptomatique résistante aux antiarythmiques, avec des fractions d’éjection ventriculaire gauche > de 40% et une dimension antéropostérieure auriculaire gauche < de 5,5 cm. Les impulsions PFA ont été synchronisées juste après le début du QRS. Les formes d’onde PFA bipolaires exclusives ont été délivrées de manière monophasique (900-1000 V par application; cas initiaux) ou biphasique (1800-2000 V par application; la plupart des cas) à l’aide du cathéter PFA endocardique (FARAWAVE). La PVI aiguë a été atteinte chez 100% des patients. En raison de la nature milliseconde des impulsions, le temps nécessaire pour fournir de l’énergie n’était pas supérieur à 3 min / patient avec des temps d’intervention peau à peau de 92,2 ± 27,4 min. La durabilité du PVI sur trois mois est progressivement passée de 18% avec la forme d’onde monophasique initiale à 100% avec les formes d’onde bipolaires plus optimisées dans la dernière cohorte de cette étude. L’absence estimée d’arythmie à 12 mois dans cette étude était de 87 ± 5,6%.
Du point de vue de l’innocuité, une seule tamponnade péricardique liée à l’intervention a été rapportée, mais aucun autre événement indésirable n’a été signalé au cours de la période médiane de suivi de 120 jours. L’endoscopie a été réalisée chez 29 patients en moyenne 3,4 jours après l’ablation et n’a révélé aucun signe de lésions œsophagiennes. De plus, 8 patients ont subi une imagerie par résonance magnétique cardiovasculaire à contraste amélioré après l’intervention où aucune amélioration de l’œsophage n’a été notée malgré l’amélioration de la paroi auriculaire gauche immédiatement adjacente. Cela soutient en outre l’absence de lésion œsophagienne avec la PFA. Cette source d’énergie génère des micro bulles de gaz à résolution rapide immédiatement après la délivrance d’une impulsion.21 La possibilité théorique que ces bulles de gaz obstruent le flux sanguin capillaire provoquant une ischémie des organes et des micro-emboles cérébrales n’a pas été observée dans cette expérience clinique.
Loh et coll. a également étudié la faisabilité et l’innocuité de l’électroporation de la PVI chez une plus petite série de 10 patients atteints de FA paroxystique ou persistante à l’aide d’un cathéter d’ablation circulaire à 14 polaires personnalisé. La PVI aiguë a été atteinte en toute sécurité chez 100% des patients (40 PV) avec un minimum de 2 applications non arcantes de 6 ms, 200 Joules par PV en utilisant une forme d’onde monophasique monopolaire.22 Les résultats de cette série sur la sécurité et la durabilité des IPV n’ont pas encore été communiqués.
En résumé, le PFA est capable d’isoler rapidement le PV avec un excellent profil de sécurité à court terme et une durabilité à long terme. Bien que cela soit très prometteur, des études plus importantes avec un suivi plus long sont nécessaires.
Conclusion
La PFA est une stratégie ablative non thermique étonnamment prometteuse et novatrice qui a la capacité de surmonter certaines limites des technologies d’ablation AF contemporaines. Les délais de procédure courts, l’absence de dommages collatéraux et l’amélioration de la durabilité à long terme du PVI distinguent cette source d’énergie des autres. Le cathéter d’ablation et la conception du pouls ont des implications à la fois en termes de sécurité et d’efficacité. Cela doit être gardé à l’esprit alors que les nouvelles technologies PFA font leur chemin dans le domaine clinique.
- Hussein A, Das M, Riva S, et al. L’utilisation de l’Ablation Guidée par l’Indice d’ablation Entraîne des Taux Élevés d’Isolement Veineux Pulmonaire Durable et d’Absence d’Arythmie chez les Patients Atteints de Fibrillation Auriculaire Persistante. Circ Arythm Electrophysiol 2018; 11: e006576.
- De Pooter J, Strisciuglio T, El Haddad M, et al. La Reconnexion Veineuse Pulmonaire Ne se Produit Plus chez la Majorité des Patients Après une Seule Procédure D’Isolement Veineux Pulmonaire. JACC Clin Électrophysiol 2019; 5:295-305.
- Das M, Wynn GJ, Saeed Y, et al. Ré-Isolement des veines Pulmonaires en tant que Stratégie de routine, Quels que soient les Symptômes: L’Essai contrôlé Randomisé par PRESSION. JACC Clin Electrophysiol 2017; 3:602-11.
- Wittkampf FHM, van Es R, Neven K. Electroporation et sa pertinence pour l’ablation par cathéter cardiaque. JACC Clin Électrophysiol 2018; 4: 977-86.
- Reddy VY, Koruth J, Jais P, et al. Ablation de la Fibrillation Auriculaire Avec Champs Électriques Pulsés: Une Modalité Ultra-Rapide et Sélective des Tissus pour l’Ablation Cardiaque. JACC Clin Électrophysiol 2018; 4:987-95.
- Darrat Y, Morales G, Di BL, Natale A, Elayi CS. Comment Obtenir Une Isolation Antrale Veineuse Pulmonaire Durable? J Fibrillation Atr 2014; 6: 1039.
- Paiella S, Butturini G, Frigerio I, et al. Safety and feasibility of Irreversible Electroporation (IRE) in patients with locally advanced pancreatic cancer: results of a prospective study. Dig Surg 2015; 32:90-7.
- Heller R, Heller LC. Essais cliniques d’électrotransfert génique. Adv Genet 2015; 89:235-62.
- Jais P, Takigawa M, Sacher F, et al. Comparaison de l’Ablation en Champ Pulsé Biphasique et Monophasique dans un Modèle Animal. J Cardiovasc Électrophysiol 2019; 1-28 (abstr).
- Witt CM, Sugrue A, Padmanabhan D, et al. Ablation Veineuse Intrapulmonaire Sans Sténose: Une Nouvelle Approche D’Électroporation À Courant Continu À Base De Ballonnet. Je suis le cœur Assoc 2018; 7: e009575.
- van Driel VJ, Neven KG, van Wessel H, et al. Sténose veineuse pulmonaire après ablation par cathéter: électroporation versus radiofréquence. Circ Arythm Electrophysiol 2014; 7: 734-8.
- Takigawa M, Vlachos K, Viswanathan R, et al. Acute Results of Superior Vena Cava and Pulmonary Vein Isolation Using Pulsed Electric Field Ablation in a Swine Model. Rythme cardiaque 2018; 15: S178-179 (abstr).
- Stewart MT, Haines DE, Verma A, et al. Ablation en champ pulsé intracardiaque : Preuve de faisabilité dans un modèle porcin chronique. Rythme cardiaque 2019; 16:754-64.
- Neven K, van Driel V, van Wessel H, van Es R, Doevendans PA, Wittkampf F. Taille de la lésion myocardique après ablation du cathéter d’électroporation épicardique après ponction subxiphoïde. Circ Arythm Electrophysiol 2014; 7: 728-33.
- Kuroki K, Koruth JS, Pare M, et al. Rapport Initial des Résultats pathologiques de l’Ablation en Champ Pulsé Endocardique chez les Porcs. Coeur Rhyhtm 2019; 16: S583.
- Neven K, van Es R, van Driel V, et al. Effets Aigus et à Long Terme de l’Ablation par Électroporation à Pleine Puissance Directement sur l’Œsophage Porcin. Circ Arythm Electrophysiol 2017; 10: e004672.
- McElderry H, Walcott G, Viswanathan R, Long G, Sauter E, Mickelsen S. Safety of pulsed electric field ablation in direct application to the porcine oesophagus. J Cardiovasc Electrophysiol 2018; 29:657-78 (abstr).
- van Driel VJ, Neven K, van Wessel H, Vink A, Doevendans PA, Wittkampf FH. Faible vulnérabilité du nerf phrénique droit à l’ablation par électroporation. Rythme cardiaque 2015; 12:1838-44.
- Kuroki K, Koruth J, Iwasawa J, et al. Isolement Veineux Pulmonaire avec Ablation en Champ Pulsé Biphasique: Comparaison Préclinique avec l’Ablation par Radiofréquence Irriguée. J Cardiovasc Électrophysiol 2019; 1-28 (abstr).
- Reddy VY, Neuzil P, Koruth JS, et al. Ablation en Champ Pulsé pour l’Isolement de la Veine pulmonaire dans la Fibrillation auriculaire. Je suis Coll Cardiol 2019; 74:315-26.
- van Es R, Groen MHA, Stehouwer M, Doevendans PA, Wittkampf FHM, Neven K. Analyse in vitro de l’origine et des caractéristiques des microemboles gazeux lors de l’ablation par électroporation par cathéter. J Cardiovasc Électrophysiol 2019; 30:2071-9.
- Loh P, van Es R, Groen MHA, et al. Isolement Des Veines Pulmonaires Par Électroporation Irréversible : Première Expérience Humaine. Rythme cardiaque 2019; 16:S579.
- Jourabchi N, Beroukhim K, Tafti BA, Kee ST, Lee EE. Électroporation irréversible (NanoKnife) dans le traitement du cancer. Intervention gastro-intestinale 2014; 3:8-18.
- López-Alonso B, Hernáez A, Sarnago H, et al. Changements histopathologiques et Ultrastructuraux après Électroporation dans le Foie de Porc à l’aide d’Électrodes à Plaques Parallèles et d’un Générateur Haute Performance. Sci Rep 2019; 9: 2647.
Sujets cliniques: Arythmies et EP Clinique, Chirurgie Cardiaque, Dyslipidémie, Angiographie Cardiovasculaire Invasive et Intervention, Imagerie Non Invasive, Maladie Péricardique, EP Science Fondamentale, SCD / Arythmies Ventriculaires, Fibrillation Auriculaire / Arythmies Supraventriculaires, Chirurgie Cardiaque et Arythmies, Métabolisme Lipidique, Interventions et Imagerie, Imagerie par Résonance Magnétique
Mots clés: Atrial Fibrillation, Cardiac Tamponade, Feasibility Studies, Follow-Up Studies, Stroke Volume, Catheter Ablation, Anti-Arrhythmia Agents, Endoscopy, Electroporation, Magnetic Resonance Imaging, Cohort Studies, Phrenic Nerve, Myocytes, Cardiac, Pulmonary Veins, Cicatrix, Microscopy, Electron, Scanning, Feasibility Studies, Prospective Studies, Tissue Scaffolds, Catheter Ablation, Constriction, Pathologic, Heart Atria, Heart Rate, Esophageal Fistula, Cryotherapy, Cardiac Surgical Procedures, Endocardium, Electroporation, Cell Membrane, Electrodes, Extracellular Matrix, Cell Death, Muscle, Squelette, Foie, Anesthésie, Général, Prolifération cellulaire, Accident Vasculaire Cérébral, Lipides Membranaires, Néoplasmes
<Retour à la liste