Plasticité musculaire
Le muscle squelettique est le plus grand tissu du corps. Il est très plastique et peut subir des oscillations dramatiques non pathologiques de masse et de force en réponse à une myriade d’influences environnementales. Après un exercice de résistance ou une exposition aux stéroïdes anabolisants, les muscles subissent une hypertrophie et augmentent leur masse, leur section transversale et leur force (Aagaard, 2004; Schiaffino et coll., 2013). Ces mêmes paramètres peuvent décliner précipitamment lorsque les muscles initient une atrophie en réponse à l’une des nombreuses insultes qui comprennent: la famine, la dénervation, l’immobilisation, la septicémie, la cachexie cancéreuse, l’insuffisance cardiaque, le diabète, l’insuffisance rénale, le trouble pulmonaire obstructif chronique et le syndrome d’immunodéficience acquise (Schiaffino et al., 2013).
Les conséquences de l’atrophie ont des implications évidentes pour la santé. La faiblesse musculaire est un facteur majeur de mortalité et de morbidité et est associée au risque accru de toutes les causes de décès (Metter et al., 2002). En fait, la réduction de l’atrophie musculaire dans la cachexie cancéreuse peut prolonger considérablement la vie (Zhou et al., 2010). De plus, de nombreuses personnes âgées souffrent de sarcopénie, un trouble de dépérissement musculaire prolongé qui commence généralement après l’âge de 50 ans et entraîne une perte d’environ 1% de la masse musculaire par an (Woo, 2017). Cela signifie qu’à l’âge de 80 ans, les personnes sarcopéniques ont perdu environ 40% de leur masse musculaire, un facteur clé dans les chutes, la fragilité et les admissions en maison de retraite. Par conséquent, la compréhension des mécanismes et des réponses thérapeutiques potentielles à l’atrophie présente un large intérêt fondamental et clinique (Ali et Garcia, 2014; Cohen et al., 2015; Ziaaldini et coll., 2017).
Hypothèse du domaine myonucléaire
Le muscle squelettique est assez unique en ce sens que les cellules matures sont syncytiales et peuvent contenir des centaines de noyaux. C’est une adaptation nécessaire étant donné que les fibres musculaires individuelles peuvent être énormes, atteignant des longueurs allant jusqu’à ~ 600 mm (23 po) (par exemple, muscle sartorius; Yang et al., 1998) et des volumes pouvant être plus de 100 000 fois supérieurs à ceux d’une cellule mononucléée typique (Bruusgaard et al., 2003). Les contributions de noyaux multiples sont nécessaires pour produire de grandes quantités d’ARNm nécessaires pour diriger la synthèse protéique prodigieuse nécessaire à la génération et au maintien de l’appareil contractile (Nevalainen et al., 2013).
La nature plastique du muscle et son organisation syncytiale ont donné lieu à une controverse qui ne semble avoir été résolue que récemment — l' »hypothèse du domaine myonucléaire” (Qaisar et Larsson, 2014; Gundersen, 2016; Schwartz et al., 2016). Cette théorie trouve ses origines dans le concept de « Wirkungssphäre” ou « sphère d’influence” proposé par Strassburger (1893), dans lequel il soutenait qu’un noyau ne peut supporter qu’un volume discret de cytoplasme, définissant ainsi les limites supérieures de la taille des cellules. Ce principe a été développé plus avant par Gregory (2001) qui a soutenu que la teneur en acide désoxyribonucléique cellulaire et le volume sont étroitement couplés. La nature syncytiale du muscle squelettique aide ces cellules à surmonter cette limitation. L’hypothèse du domaine myonucléaire dicte que pour maintenir le bon rapport nucléaire/ cytoplasmique, de nouveaux noyaux sont ajoutés au cours de l’hypertrophie et perdus avec l’atrophie.
Il existe des données substantielles démontrant que le nombre nucléaire augmente avec l’hypertrophie musculaire (Moss, 1968; Cabric et James, 1983; Egner et al., 2016), bien qu’une certaine controverse subsiste (Murach et al., 2018). Ce processus a fait l’objet d’études approfondies et certains des mécanismes moléculaires sous-jacents qui régulent l’acquisition de nouveaux noyaux au cours de l’hypertrophie ont été définis récemment (Guerci et al., 2012; Bentzinger et coll., 2014; Ross et coll., 2018). Ces noyaux surnuméraires sont acquis lorsque des cellules souches restreintes à la lignée, généralement des cellules satellites, fusionnent avec des fibres musculaires et apportent leurs noyaux (Brack et Rando, 2012; Bachman et al., 2018). Les cellules satellites résident sous la membrane basale et viennent buter sur le sarcolemme (Katz, 1961; Mauro, 1961). Ils restent au repos jusqu’à ce qu’ils soient stimulés par des stéroïdes anabolisants comme la testostérone ou par une lésion focale après un exercice de résistance, à quel point ils réentrent dans le cycle cellulaire et prolifèrent (Joubert et Tobin, 1995; Abreu et al., 2017). Certaines des cellules filles fusionnent avec la fibre musculaire et facilitent à la fois la réparation et la croissance, tandis que d’autres arrêtent et reconstituent le pool satellite (Dumont et al., 2015; Goh et Millay, 2017). Les cellules excédentaires restantes subissent une apoptose (Schwartz, 2008).
L’aspect controversé de l’hypothèse du domaine myonucléaire est l’affirmation selon laquelle les myonucléi sont perdus lors de l’atrophie. Il existe de nombreuses interventions qui induisent une atrophie chez les modèles animaux, notamment: l’immobilisation, la dénervation et la septicémie (Fitts et al., 1986; Minnaard et coll., 2005; O’Leary et coll., 2012). Dans chaque cas, il y a une perte nette de la section transversale musculaire (le test primaire) et l’apparition de cellules apoptotiques dans le tissu (McCall et al., 1998; Smith et coll., 2000; Strasser et coll., 2000; Alway et coll., 2003; McClung et coll., 2007; Andrianjafiniony et coll., 2010; Guo et coll., 2012; Palumbo et coll., 2012; Barnes et coll., 2015; Cheema et coll., 2015; Li et coll., 2016; Kletzien et coll., 2018). Dans ces études, l’apoptose est mesurée selon diverses méthodes, notamment l’activation de la caspase, la libération d’endogs mitochondriaux ou la fragmentation de l’ADN. Ces études fournissent des données convaincantes selon lesquelles l’apoptose augmente considérablement au cours de la phase précoce de l’atrophie. Par exemple, dans une étude approfondie récente (Guo et al., 2012), Guo et coll. les souris ont été soumises à 14 jours de suspension des membres postérieurs, un traitement qui a entraîné une réduction d’environ 69% du poids humide du muscle et une réduction d’environ 43,8% de la section transversale par rapport au muscle controlatéral non manipulé. Les auteurs ont également quantifié un certain nombre de marqueurs d’apoptose, notamment la coloration au TUNEL, le clivage/activation de la caspase-3 et le clivage de la poly (adénosine diphosphate ribose) polymérase (PARP), une protéine impliquée dans la réparation de l’ADN. Chacune de ces mesures d’apoptose a augmenté de manière significative après la suspension des membres postérieurs. Alors que l’objectif principal de cet article était d’évaluer l’impact positif de la stimulation électrique sur la limitation de l’atrophie à la suite d’une insulte, ils et de nombreux autres chercheurs interprètent ce type de données comme fournissant un solide soutien à l’hypothèse du domaine myonucléaire.
D’un point de vue biologique cellulaire, la perte présumée de noyaux dans un tissu syncytial comme le muscle squelettique présente un problème pratique majeur. Comment un noyau individuel peut-il devenir si compromis que son génome se condense et se fragmente rapidement tandis que ses voisins persistent et aident à maintenir la viabilité de la fibre musculaire? Étant donné que l’apoptose est généralement médiée par l’activation de la classe des protéases à cystéine connues sous le nom de caspases, il n’est pas clair quel mécanisme pourrait servir à restreindre l’activité d’une protéase diffusable dans un cytoplasme commun.
Cette question a été abordée indirectement dans un autre type de cellules syncytiales, le syncytiotrophoblaste humain, un tissu qui entoure le placenta et contient environ 5 × 1010 noyaux (Mayhew et al., 1999). Lorsque l’apoptose est induite dans le syncytiotrophoblaste, elle se propage sous forme d’onde à une vitesse d’environ 5 microns par minute jusqu’à ce que tout le tissu soit impliqué (Longtine et al., 2012). Par conséquent, il n’y a pas de régions « privilégiées” dans le cytoplasme syncytial et tous les noyaux sont finalement détruits.
L’un des principaux défis de l’analyse de l’apoptose dans le muscle squelettique est qu’il s’agit d’un tissu très hétérogène, où environ la moitié de ses noyaux résident en dehors des fibres musculaires (Schmalbruch et Hellhammer, 1977). Ces cellules mononucléées comprennent des cellules satellites, des cellules endothéliales, des fibroblastes, des péricytes et des macrophages (Tedesco et al., 2010). Par conséquent, il est très difficile de déterminer de quel côté du sarcolemme se trouve un noyau, et donc s’il s’agit d’un véritable myonucléus.
Imagerie en Time-Lapse in Vivo des Fibres Musculaires de Souris marquées
Malgré le grand nombre d’articles démontrant une apoptose lors d’une atrophie musculaire, plusieurs auteurs ont remis en question ces résultats (Wada et al., 2002; Zhong et coll., 2005; Aravamudan et coll., 2006; Gundersen et Bruusgaard, 2008; Duddy et al., 2011; Qaisar et Larsson, 2014). Par exemple, en utilisant des fibres musculaires isolées in vitro, Duddy et al. a noté que même si le volume des fibres musculaires diminuait au fil du temps, reflétant un processus atrophique, le nombre de myonucléi semblait être stable (Duddy et al., 2011).
Dans une série d’expériences élégantes, le laboratoire Gundersen a injecté des fibres musculaires individuelles extenseurs digitorum longus (EDL) ou muscles soléus avec des colorants qui ont marqué indépendamment les noyaux et le cytoplasme chez des souris anesthésiées (Bruusgaard et Gundersen, 2008; Bruusgaard et al., 2010). Cela leur a permis d’identifier chaque noyau dans les fibres musculaires individuelles in vivo au fil du temps, puis d’évaluer son devenir. Par exemple, les muscles EDL ont été induits en hypertrophie par l’ablation de leurs principaux synergistes (Bruusgaard et al., 2010). Entre les jours 6 et 11, le nombre de myonucléi a augmenté d’environ 54% et entre les jours 9 et 14, il y a eu une augmentation de 35% de la section transversale (figure 1). Ces données sont compatibles avec l’hypothèse selon laquelle les muscles acquièrent des noyaux surnuméraires avant la croissance majeure de la fibre lors de l’hypertrophie.

Figure 1. Les myonucléi sont acquis lors de l’hypertrophie mais ne sont pas perdus lors de l’atrophie chez la souris. Micrographies de la même fibre musculaire EDL au fil du temps après l’induction de l’hypertrophie (rangée du haut) et l’induction subséquente de l’atrophie (rangée du bas). Des oligonucléotides marqués par fluorescence ont été utilisés pour visualiser les noyaux in vivo. Les lignes pointillées représentent le sarcolemme. Barre d’échelle = 50 µm. (Adapté de Bruusgaard et al., 2010. Utilisé avec l’autorisation des Actes de l’Académie nationale des Sciences.)
Ils ont ensuite examiné le devenir de ces myonucléi identifiables de manière unique dans les mêmes fibres musculaires lorsqu’ils ont été amenés à subir une atrophie. La dénervation a entraîné une réduction d’environ 50 % du volume des fibres musculaires, mais aucune perte de myonucléi (Figure 1; Bruusgaard et al., 2010). L’absence d’observation de la perte nucléaire n’était pas due au stimulus atrophique utilisé puisqu’ils ont obtenu les mêmes résultats lorsque les muscles ont été amenés à s’atrophier en réponse à un blocage nerveux induit par la tétrodotoxine, à une suspension des membres postérieurs, à une cachexie cancéreuse ou à une désentraînement (Bruusgaard et Gundersen, 2008; Bruusgaard et al., 2010; Winje et coll., 2018a). En effet, au cours de leurs études, ils ont examiné plus de 200 000 myonucléi individuels dans les muscles atrophiques et n’ont observé que 4 noyaux TUNEL positifs (apoptotiques), ce qui représente une perte de seulement ~ 0,002% des noyaux (Bruusgaard et al., 2012). Ces données soutiennent fortement l’hypothèse selon laquelle l’atrophie du muscle squelettique ne s’accompagne pas d’une mort myonucléaire.
Le muscle des insectes en tant que modèle
Aussi puissantes que soient ces études, il existe certaines limites inhérentes à l’utilisation de modèles de mammifères. Premièrement, ils s’appuient invariablement sur des interventions expérimentales telles que la dénervation pour induire une atrophie musculaire. Deuxièmement, le muscle controlatéral est généralement utilisé comme contrôle interne même s’il est également exposé à certains des mêmes signaux environnementaux, tels que les hormones de stress (Bonaldo et Sandri, 2013). Enfin, les muscles squelettiques peuvent également subir une mort cellulaire programmée (PCD) au cours du développement, et ces modèles abordent rarement le rôle de l’apoptose dans ces cellules.
Un modèle alternatif qui ne souffre d’aucune de ces limitations et qui permet l’étude des noyaux musculaires à la fois lors de l’atrophie et de la PCD naturelle, est le muscle intersegmental (ISM) du Manduca sexta du faucon du tabac. Les ISMs sont composés de feuilles de fibres musculaires géantes, où chaque cellule mesure environ 5 mm de long et jusqu’à 1 mm de diamètre (Figure 2A). Les ISMS s’attachent aux limites segmentaires de l’abdomen et génèrent à la fois le comportement rampant des larves et le comportement d’éclosion (émergence) du papillon adulte lorsqu’il s’échappe de la cuticule nymphale à la fin de la métamorphose.
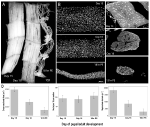
Figure 2. Rétention des myonucléés pendant l’atrophie et la mort des muscles intersegmentaux (ISMs) de la mite Manduca sexta. (A) ISMs à partir de trois stades de développement: homéostatique (jours 15 du développement nymphal-adulte; à gauche); atrophique (jour 18; milieu); et mourant (18 h après l’éclosion; à droite). La barre d’échelle est égale à ~1 mm (adaptée de Schwartz et al., 2016). (B) Les MSI de ces mêmes stades de développement ont été nettoyés et colorés avec le colorant nucléaire DAPI et visualisés par microscopie confocale (adapté de Schwartz et al., 2016). (C) Des sections de fibres ISM (10 µm) ont été colorées avec le colorant nucléaire DAPI. Notez la perte dramatique de protéines musculaires (zone gris clair) lors de l’atrophie et de la mort, mais la rétention des noyaux à tous les stades (adapté de Schwartz et al., 2016). (D) Quantification du volume de fibres ISM (à gauche), du nombre nucléaire (au milieu) et de la taille du domaine myonucléaire (à droite) pendant l’homéostasie, l’atrophie et la mort. (Moyenne ± erreur standard.) (Adapté de Schwartz et al., 2016).
Au 15e jour des 18 jours normaux de développement nymphal-adulte, les ISMs initient un programme d’atrophie déclenché par des hormones qui entraîne une perte de masse de 40% au moment de l’éclosion 3 jours plus tard (Figure 2A; Schwartz et Truman, 1983). Cette perte spectaculaire de masse musculaire est équivalente à celle observée chez les personnes de 80 ans atteintes de sarcopénie, mais se déroule sur 3 jours plutôt que 30 ans. Alors que les ISMs perdent de la masse, ils conservent des propriétés physiologiques normales telles que le potentiel de repos et la force / la section transversale (Schwartz et Ruff, 2002). Les ISMS sont utilisés pour générer le comportement d’éclosion à la fin du jour 18, puis initier le PCD, qui sont tous deux déclenchés par une hormone peptidique (Schwartz et Truman, 1982, 1983). .
Contrairement aux muscles des mammifères, les ISMs ne contiennent pas de capillaires, de cellules satellites, de cellules endothéliales ou de péricytes, ce qui signifie que pratiquement tous les noyaux du tissu résident dans les fibres musculaires elles-mêmes (Beaulaton et Lockshin, 1977). Nous avons utilisé deux méthodes indépendantes pour surveiller le devenir nucléaire pendant l’atrophie et la mort dans ce modèle (Schwartz et al., 2016). La première était une approche anatomique standard. Lorsque les MSI subissent une atrophie et la mort, il y a des réductions spectaculaires à la fois du volume et de la section transversale des fibres, mais de manière grossière, le nombre nucléaire était inchangé (figure 2B). En utilisant des tissus sectionnés pour des études quantitatives, nous avons constaté qu’il y avait une réduction d’environ 49% de la section transversale des fibres pendant l’atrophie et une diminution supplémentaire de 30% pendant les premiers stades de la mort (Figures 2C, D; Schwartz et al., 2016). Cependant, le nombre de noyaux n’a pas changé pendant cette même période, ce qui signifie qu’il y avait fonctionnellement une réduction de 84% du domaine myonucléaire.
La deuxième méthode que nous avons employée a été de mesurer la teneur en ADN de fibres musculaires individuelles d’animaux au jour 13, lorsque les muscles sont homéostatiques, jusqu’à 18 h après l’éclosion, lorsque les muscles sont fortement dégénérés (Schwartz et al., 2016). Nous avons quantifié la teneur en ADN de 420 cellules individuelles et constaté qu’il n’y avait pas de perte significative pendant le développement. Ces analyses biochimiques concordent bien avec les données anatomiques et suggèrent que la concentration relative des noyaux et de l’ADN génomique augmentait fonctionnellement à mesure que les muscles s’atrophiaient et mouraient. Par conséquent, les données provenant à la fois de souris et de papillons de nuit suggèrent que les noyaux musculaires ne subissent pas d’apoptose pendant l’atrophie (ou PCD) et conduisent à la conclusion que l’hypothèse du domaine myonucléaire doit être rejetée.
Conclusions
Ces observations ont un certain nombre d’implications à la fois pour la compréhension de la biologie fondamentale du muscle et pour le développement d’interventions thérapeutiques potentielles. Bien qu’il existe des données substantielles signalant la présence de noyaux apoptotiques dans le tissu à la suite d’insultes atrophiques, des données récentes suggèrent qu’il ne s’agit pas de vrais myonucléés, mais plutôt de cellules mononucléées condamnées qui résident à l’extérieur de la fibre musculaire. La principale raison de cette divergence est que les outils traditionnels utilisés pour détecter l’apoptose n’ont pas la résolution requise pour déterminer adéquatement de quel côté du sarcolemme se trouve une cellule mourante. Les méthodes qui marquent spécifiquement les myonucléés, soit via des injections in vivo de colorants fluorescents (Bruusgaard et Gundersen, 2008), soit via des manipulations génétiques pour exprimer des protéines marqueurs (Duddy et al., 2011), révèlent peu ou pas de noyaux apoptotiques dans les fibres marquées. La récente démonstration que les anticorps dirigés contre le matériau Péricentriolaire protéique 1 (PCM1) ne marquent que les myonucléés authentiques offre un outil prometteur qui peut être appliqué aux matériaux histologiques traditionnels qui sont régulièrement analysés sur le terrain (Winje et al., 2018b).
L’incapacité des muscles squelettiques à utiliser l’apoptose comme mécanisme d’élimination des myonucléi n’est pas surprenante. Il semble que le muscle squelettique mature soit en grande partie empêché de déclencher l’apoptose en ce sens qu’il régule à la hausse l’expression de protéines de survie puissantes comme l’inhibiteur lié à l’X de la protéine d’apoptose (XIAP) (Smith et al., 2009) et un répresseur d’apoptose avec domaine de recrutement de la caspase (ARC) (Xiao et al., 2011), tout en exprimant simultanément de faibles niveaux de médiateurs de l’apoptose comme le facteur d’activation de la protéase apoptotique 1 (Apaf-1) (Burgess et al., 1999). Cela a du sens téléologiquement puisque les muscles sont soumis à des perturbations extrêmes, y compris une perturbation du sarcolemme après un exercice intense, il serait donc catastrophique qu’ils déclenchent la mort cellulaire plutôt que la réparation tissulaire et éventuellement l’hypertrophie. Comme d’autres cellules différenciées en phase terminale, les muscles ont tendance à utiliser des mécanismes non apoptotiques, notamment le PCD autophagique (également connu sous le nom de dégénérescence de type II) (Clarke, 1990; Schwartz et al., 1993; Kole et coll., 2013; Ginet et coll., 2014) lorsqu’ils meurent pendant le développement.
Même s’il existait un mécanisme permettant aux muscles de cibler sélectivement des noyaux individuels, il n’est pas clair que cela serait bénéfique. En fait, la rétention des noyaux « excédentaires » lors de l’atrophie confère un avantage distinct à l’individu puisque les muscles squelettiques subissent fréquemment des cycles d’atrophie et d’hypertrophie en réponse à des conditions environnementales telles que la disponibilité de nourriture. La capacité de récupérer rapidement en utilisant des myonucléi préexistants peut jouer un rôle important dans l’adaptation (Jackson et al., 2012) et aident à expliquer le phénomène de la « mémoire musculaire” (Staron et al., 1991; Gundersen, 2016). Il est bien documenté dans le domaine de la physiologie de l’exercice qu’il est beaucoup plus facile de retrouver un certain niveau de forme musculaire par l’exercice que de l’atteindre en premier lieu, même s’il y a eu une longue période d’entraînement. En d’autres termes, l’expression « utilisez-le ou perdez-le” pourrait être plus précisément articulée comme « utilisez-le ou perdez-le, jusqu’à ce que vous y travailliez à nouveau. »Cela a été démontré directement par une autre expérience du laboratoire Gundersen qui a démontré qu’une fois qu’un muscle a acquis de nouveaux noyaux, il les retient longtemps après l’élimination du stimulus hypertrophique. Ils ont induit une hypertrophie musculaire chez les souris femelles en les traitant pendant 2 semaines avec de la testostérone, puis ont examiné les muscles 3 semaines après le retrait des stéroïdes (Egner et al., 2013). Le volume musculaire était revenu à la ligne de base, mais les noyaux nouvellement acquis persistaient même 3 mois plus tard. Lorsque les muscles ont été soumis à une surcharge pour rétablir l’hypertrophie, ceux traités aux stéroïdes ont rapidement subi une augmentation de 36% du volume de fibres tandis que les muscles témoins n’ont augmenté que de 6%. Ces données suggèrent que les noyaux « excédentaires” pourraient être mobilisés rapidement pour faciliter le recyclage.
Ces observations ont des répercussions potentielles sur les politiques de santé publique. Il a été démontré que la croissance musculaire, la fonction physiologique et la capacité de régénération diminuent toutes avec l’âge, en grande partie en raison de la prolifération réduite des cellules satellites (Blau et al., 2015). Par conséquent, l’exercice pendant l’adolescence, lorsque la croissance musculaire est améliorée par les hormones, la nutrition et un pool satellite robuste, pourrait servir fonctionnellement à permettre aux individus de « mettre en banque” des myonucléi qui pourraient être utilisés plus tard dans la vie pour ralentir les effets du vieillissement et éventuellement prévenir la sarcopénie.
En outre, ces données ont des implications dans le domaine des sports de compétition. L’utilisation de stéroïdes anabolisants est un stimulant puissant pour l’hypertrophie musculaire et l’ajout de nouveaux myonucléi (Egner et al., 2013). Étant donné que ces noyaux persistent longtemps après la fin de l’utilisation de stéroïdes, les athlètes tirent probablement les avantages de l’utilisation de drogues illégales sans risque de détection.
En résumé, bien que l’ajout de nouveaux noyaux avec croissance musculaire soit largement accepté, la perte apoptotique des noyaux avec atrophie ne peut être étayée, suggérant qu’une interprétation stricte de l’hypothèse du domaine myonucléaire ne peut être étayée. Au lieu de cela, il semble qu’une fois acquis, les myonucléi persistent même lorsqu’un muscle devient atrophique ou déclenche la mort cellulaire.
Contributions de l’auteur
L’auteur confirme être le seul contributeur de cet ouvrage et l’a approuvé pour publication.
Financement
Le travail pour cette publication a été soutenu par des fonds de la dotation de la chaire Eugene M. et Ronnie Isenberg. Aucun soutien corporatif n’a été fourni à l’auteur et aucun produit commercial n’est mentionné ou approuvé.
Déclaration de conflit d’intérêts
L’auteur déclare que la recherche a été menée en l’absence de relations commerciales ou financières pouvant être interprétées comme un conflit d’intérêts potentiel.
Remerciements
L’auteur tient à remercier Mme Christine Brown pour son aide dans la préparation de ce manuscrit et la dotation de la chaire Eugene M. et Ronnie Isenberg pour son soutien.
Aagaard, P. (2004). Rendre les muscles « plus forts »: exercice, nutrition, médicaments. J. Appareil locomoteur. Neuronale. Interagir. 4, 165–174.
Résumé PubMed / Google Scholar
Abreu, P., Mendes, S. V., Ceccatto, V. M., et Hirabara, S. M. (2017). Activation des cellules satellites induite par l’adaptation musculaire aérobie en réponse à l’exercice d’endurance chez l’homme et les rongeurs. Vie Sci. 170, 33–40. doi: 10.1016/j. lfs.2016.11.016
Résumé PubMed | Texte intégral CrossRef /Google Scholar
Ali, S., et Garcia, J. M. (2014). Sarcopénie, cachexie et vieillissement: diagnostic, mécanismes et options thérapeutiques – un mini-examen. Gérontologie 60, 294-305. doi: 10.1159/000356760
Résumé publié/ Texte intégral croisé / Google Scholar
Alway, S. E., Martyn, J. K., Ouyang, J., Chaudhrai, A., et Murlasits, Z. S. (2003). Id2 expression during apoptosis and satellite cell activation in unloaded and loaded quail skeletal muscles. Am. J. Physiol. Regul. Integr. Comp. Physiol. 284, R540–R549. doi: 10.1152/ajpregu.00550.2002
PubMed Abstract | CrossRef Full Text | Google Scholar
Andrianjafiniony, T., Dupre-Aucouturier, S., Letexier, D., Couchoux, H., and Desplanches, D. (2010). Oxidative stress, apoptosis, and proteolysis in skeletal muscle repair after unloading. Am. J. Phys. Cell Physiol. 299, C307–C315. doi: 10.1152/ajpcell.00069.2010
Résumé publié par PubMed / Texte intégral croisé / Google Scholar
Aravamudan, B., Mantilla, C. B., Zhan, W. Z. et Sieck, G. C. (2006). Effets de dénervation sur la taille du domaine myonucléaire des fibres du diaphragme de rat. J. Appl. Physiol. 100, 1617–1622. doi: 10.1152/ japplphysiol.01277.2005
CrossRef Texte intégral / Google Scholar
Bachman, J. F., Klose, A., Liu, W., Paris, N. D., Blanc, R. S., Schmalz, M., et al. (2018). La croissance du muscle squelettique prépubère nécessite une contribution myonucléaire dérivée des cellules satellites exprimant Pax 7. Développement 145: 167197.
Google Scholar
Barnes, B. T., Confie, A. L., Rich, M. M., et Dupont-Versteegden, E.E. (2015). Des voies apoptotiques musculaires distinctes sont activées dans les muscles avec différents types de fibres dans un modèle de myopathie de maladie grave chez le rat. J. Muscle Rés. Motil cellulaire. 36, 243–253. doi: 10.1007/s10974-015-9410-8
Résumé publié par PubMed | Texte intégral croisé / Google Scholar
Beaulaton, J., et Lockshin, R.A. (1977). Étude ultrastructurale de la dégénérescence normale des muscles intersegmentaux des Anthereae polyphemus et Manduca sexta (insecta, lépidoptères) avec une référence particulière à l’autophagie cellulaire. J. Morphol. 154, 39–57. doi: 10.1002/ jmor.1051540104
Résumé publié | Texte intégral croisé / Google Scholar
Bentzinger, C. F., von Maltzahn, J., Dumont, N. A., Stark, D.A., Wang, Y. X., Nhan, K., et al. (2014). Le Wnt 7a stimule la motilité et la prise de greffe des cellules souches myogéniques, ce qui améliore la force musculaire. J. Biol Cellulaire. 205, 97–111. doi: 10.1083/jcb.201310035
Résumé PubMed / Texte intégral croisé / Google Scholar
Blau, H. M., Cosgrove, B. D., et Ho, A.T. (2015). Le rôle central des cellules souches musculaires dans l’échec régénératif avec le vieillissement. NAT. Med. 21, 854–862. doi: 10.1038/nm.3918
Résumé PubMed / Texte intégral CrossRef /Google Scholar
Bonaldo, P., et Sandri, M. (2013). Mécanismes cellulaires et moléculaires de l’atrophie musculaire. Dis. Modèle. Méca. 6, 25–39. doi: 10.1242/ dmm.010389
CrossRef Texte intégral /Google Scholar
Brack, A.S., et Rando, T.A. (2012). Cellules souches spécifiques aux tissus: leçons tirées de la cellule satellite du muscle squelettique. Cellule souche Cellulaire 10, 504-514. doi: 10.1016 / j. tige.2012.04.001
Résumé PubMed | CrossRef Texte intégral / Google Scholar
Bruusgaard, J. C., Egner, I. M., Larsen, T. K., Dupre-Aucouturier, S., Desplanches, D., et Gundersen, K. (2012). Aucun changement dans le nombre myonucléaire pendant le déchargement et le rechargement des muscles. J. Appl. Physiol. 113, 290–296. doi: 10.1152/ japplphysiol.00436.2012
Résumé PubMed | Texte intégral CrossRef /Google Scholar
Bruusgaard, J. C., et Gundersen, K. (2008). La microscopie en accéléré in vivo ne révèle aucune perte de myonucléi murins pendant les semaines d’atrophie musculaire. J. Clin. Investir. 118, 1450–1457. doi: 10.1172/JCI34022
Résumé publié | Texte intégral croisé / Google Scholar
Bruusgaard, J. C., Johansen, I. B., Egner, I. M., Rana, Z. A. et Gundersen, K. (2010). Les myonucléi acquis par l’exercice de surcharge précèdent l’hypertrophie et ne sont pas perdus lors de l’entraînement. Proc. Natl. Acad. Sci. États-Unis 107, 15111-15116. doi: 10.1073/pnas.0913935107
CrossRef Texte intégral /Google Scholar
Bruusgaard, J. C., Liestol, K., Ekmark, M., Kollstad, K. et Gundersen, K. (2003). Nombre et distribution spatiale des noyaux dans les fibres musculaires de souris normales étudiées in vivo. J. Physiol. 551, 467–478. doi: 10.1113/jphysiol.2003.045328
Résumé PubMed | CrossRef Texte intégral / Google Scholar
Burgess, D. H., Svensson, M., Dandrea, T., Gronlund, K., Hammarquist, F., Orrenius, S., et al. (1999). Les cytosols du muscle squelettique humain sont réfractaires à l’activation dépendante du cytochrome c des caspases de type II et manquent d’APAF-1. La Mort Cellulaire Diffère. 6, 256–261. doi: 10.1038/sj.cdd.4400489
Résumé PubMed / Texte intégral CrossRef /Google Scholar
Cabric, M., et James, N.T. (1983). Analyses morphométriques sur les muscles des chiens entraînés à l’exercice et non entraînés. Être. J. Anat. 166, 359–368. doi: 10.1002/ aja.1001660309
Résumé PubMed | Texte intégral croisé / Google Scholar
Cheema, N., Herbst, A., McKenzie, D. et Aiken, J.M. (2015). L’apoptose et la nécrose médient la perte de fibres musculaires squelettiques dans les anomalies enzymatiques mitochondriales induites par l’âge. Cellule de vieillissement 14, 1085-1093. doi: 10.1111/acel.12399
Résumé PubMed / Texte intégral croisé / Google Scholar
Clarke, P. G. (1990). Mort cellulaire développementale: diversité morphologique et mécanismes multiples. Anat. Embryol. 181, 195–213.
Google Scholar
Cohen, S., Nathan, J.A. et Goldberg, A.L. (2015). Atrophie musculaire dans la maladie: mécanismes moléculaires et thérapies prometteuses. NAT. Le révérend Drug Discov. 14, 58–74. doi: 10.1038/nrd4467
Résumé PubMed / Texte intégral CrossRef /Google Scholar
Duddy, W. J., Cohen, T., Duguez, S. et Partridge, T.A. (2011). La fibre musculaire isolée comme modèle d’atrophie de désuétude: caractérisation à l’aide de PhAct, une méthode de quantification de la f-actine. Exp. Cellule 317, 1979-1993. doi: 10.1016/j.yexcr.2011.05.013
Résumé PubMed | Texte intégral croisé / Google Scholar
Dumont, N. A., Wang, Y. X. et Rudnicki, M.A. (2015). Mécanismes intrinsèques et extrinsèques régulant la fonction des cellules satellites. Développement 142, 1572-1581. doi: 10.1242 / dev.114223
Résumé PubMed / Texte intégral CrossRef / Google Scholar
Egner, I. M., Bruusgaard, J. C., Eftestol, E., et Gundersen, K. (2013). Un mécanisme de mémoire cellulaire facilite l’hypertrophie de surcharge dans le muscle longtemps après une exposition épisodique aux stéroïdes anabolisants. J. Physiol. 591, 6221–6230. doi: 10.1113/jphysiol.2013.264457
Résumé PubMed / Texte intégral CrossRef /Google Scholar
Egner, I. M., Bruusgaard, J. C., et Gundersen, K. (2016). L’épuisement des cellules satellites empêche l’hypertrophie des fibres dans le muscle squelettique. Développement 143, 2898-2906. doi: 10.1242 / dev.134411
Résumé PubMed | Texte intégral croisé / Google Scholar
Fitts, R. H., Metzger, J. M., Riley, D.A. et Unsworth, B.R. (1986). Modèles de désuétude: comparaison de la suspension et de l’immobilisation des membres postérieurs. J. Appl. Physiol. 60, 1946–1953.
Google Scholar
Ginet, V., Pittet, M. P., Rummel, C., Osterheld, M. C., Meuli, R., Clarke, P. G., et al. (2014). Les neurones mourants dans le thalamus des nouveau-nés à terme asphyxiés et des rats sont autophagiques. Ann. Neurol. 76, 695–711. doi: 10.1002/ ana.24257
Résumé PubMed / Texte intégral CrossRef /Google Scholar
Goh, Q., et Millay, D. P. (2017). Exigence de fusion de cellules souches médiée par myomaker pour l’hypertrophie des muscles squelettiques. elife 6. doi: 10.7554 / eLife.20007
Résumé PubMed | Texte intégral CrossRef /Google Scholar
Gregory, T. R. (2001). Coïncidence, coévolution ou causalité ? Contenu de l’ADN, taille des cellules et énigme de la valeur C. Biol. Rév. Camb. Philo. Soc. 76, 65–101. doi: 10.1017/s1464793100005595
Résumé publié | Texte intégral croisé / Google Scholar
Guerci, A., Lahoute, C., Hebrard, S., Collard, L., Graindorge, D., Favier, M., et al. (2012). Les signaux paracrine dépendants de la Srf produits par les myofibres contrôlent l’hypertrophie du muscle squelettique médiée par les cellules satellites. Métab cellulaire. 15, 25–37. doi: 10.1016/j.cmet.2011.12.001
Résumé PubMed / Texte intégral CrossRef /Google Scholar
Gundersen, K. (2016). La mémoire musculaire et un nouveau modèle cellulaire pour l’atrophie musculaire et l’hypertrophie. J. Exp. Biol. 219, 235–242. doi: 10.1242/ jeb.124495
Résumé PubMed / Texte intégral CrossRef /Google Scholar
Gundersen, K., et Bruusgaard, J. C. (2008). Domaines nucléaires lors de l’atrophie musculaire: noyaux perdus ou paradigme perdu ? J. Physiol. 586, 2675–2681. doi: 10.1113/jphysiol.2008.154369
Résumé publié par PubMed | Texte intégral croisé / Google Scholar
Guo, B.S., Cheung, K. K., Yeung, S. S., Zhang, B. T. et Yeung, E. W. (2012). La stimulation électrique influence la prolifération des cellules satellites et l’apoptose dans l’atrophie musculaire induite par le déchargement chez la souris. PLoS One 7: e30348. doi: 10.1371 / journal.pone.0053523
Résumé publié | Texte intégral croisé / Google Scholar
Jackson, J. R., Mula, J., Kirby, T. J., Fry, C. S., Lee, J. D., Ubele, M. F., et al. (2012). L’épuisement des cellules satellites n’inhibe pas la repousse du muscle squelettique adulte après une atrophie induite par le déchargement. Être. J. Phys. Physiol cellulaire. 303, C854–C861. doi: 10.1152 / ajpcell.00207.2012
Résumé publié par PubMed | Texte intégral croisé /Google Scholar
Joubert, Y., et Tobin, C. (1995). Le traitement à la testostérone entraîne l’activation des cellules satellites reposantes et leur recrutement dans le cycle cellulaire du muscle ani du rat. Dev. Biol. 169, 286–294. doi: 10.1006/dbio.1995.1144
Résumé PubMed | Texte intégral croisé / Google Scholar
Katz, B. (1961). Les terminaisons de la fibre nerveuse afférente dans le fuseau musculaire de la grenouille. Philo. Trans. R. Soc. Lond. B Biol. Sci. 243, 221–240.
Résumé PubMed / Google Scholar
Kletzien, H., Hare, A. J., Leverson, G. et Connor, N. P. (2018). Effet lié à l’âge de la mort cellulaire sur la morphologie et le nombre de fibres dans le muscle de la langue. Nerf musculaire 57, E29–E37. doi: 10.1002/mus.25671
Résumé publié / Texte intégral croisé / Google Scholar
Kole, A. J., Annis, R. P. et Deshmukh, M. (2013). Neurones matures: équipés pour la survie. Mort cellulaire Dis. 4:e689. doi: 10.1038/cddis.2013.220
Résumé PubMed / Texte intégral croisé / Google Scholar
Li, T. S., Shi, H., Wang, L. et Yan, C. (2016). Effect of bone marrow mésenchymal stem cells on satellite cell proliferation and apoptosis in immobilization-induced muscle atrophy in rats. Med. Sci. Monit. 22, 4651–4660. doi: 10.12659/ MSM.898137
Résumé PubMed | Texte intégral CrossRef /Google Scholar
Lockshin, R. A., et Williams, C. M. (1965). Mort cellulaire programmée – I. Cytologie de la dégénérescence dans les muscles intersegmentaux de la soie Pernyi. J. Physiol d’insecte. 11, 123–133. doi: 10.1016/0022-1910(65)90099-5
Résumé publié par PubMed | Texte intégral croisé | Google Scholar
Longtine, M.S., Barton, A., Chen, B. et Nelson, D. M. (2012). L’imagerie de cellules vivantes montre que l’apoptose s’initie localement et se propage sous forme d’onde à travers les syncytiotrophoblastes dans les cultures primaires de trophoblastes villeux placentaires humains. Placenta 33, 971-976. doi: 10.1016 / j. placenta.2012.09.013
Résumé PubMed | Texte intégral croisé / Google Scholar
Mauro, A. (1961). Cellule satellite des fibres musculaires squelettiques. J. Biophys. Biochem. Cytol. 9, 493–495.
Google Scholar
Mayhew, T. M., Leach, L., McGee, R., Ismail, W. W., Myklebust, R. et Lammiman, M. J. (1999). Prolifération, différenciation et apoptose chez le trophoblaste villeux à 13-41 semaines de gestation (y compris les observations sur les lamelles annulées et les complexes de pores nucléaires). Placenta 20, 407-422. doi: 10.1053/ plac.1999.0399.
Résumé publié par PubMed | Texte intégral croisé / Google Scholar
McCall, G. E., Allen, D. L., Linderman, J. K., Grindeland, R. E., Roy, R. R., Mukku, V. R., et al. (1998). Maintien de la taille du domaine myonucléaire dans le soleus du rat après une surcharge et un traitement à l’hormone de croissance / IGF-I. J. Appl. Physiol. 84, 1407–1412.
Google Scholar
McClung, J. M., Kavazis, A. N., DeRuisseau, K. C., Falk, D. J., Deering, M. A., Lee, Y., et al. (2007). Régulation de la caspase-3 du domaine myonucléaire du diaphragme lors d’une atrophie induite par la ventilation mécanique. Être. J. Respir. Crit. Soins Med. 175, 150–159. doi: 10.1164 / rccm.200601-142OC
Résumé PubMed / Texte intégral croisé / Google Scholar
Metter, E. J., Talbot, L.A., Schrager, M., et Conwit, R. (2002). La force musculaire squelettique comme prédicteur de la mortalité toutes causes confondues chez les hommes en bonne santé. J. Gerontol. Un Biol. Sci. Med. Sci. 57, B359–B365. doi: 10.1093/gérone/ 57.10.B359
Résumé PubMed / CrossRef Texte intégral / Google Scholar
Minnaard, R., Drost, M. R., Wagenmakers, A. J., van Kranenburg, G. P., Kuipers, H. et Hesselink, M. K. (2005). Atrophie musculaire squelettique et performance contractile chez les rats septiques. Nerf musculaire 31, 339-348. doi: 10.1002/mus.20268
Résumé PubMed / Texte intégral CrossRef /Google Scholar
Moss, F. P. (1968). La relation entre les dimensions des fibres et le nombre de noyaux pendant la croissance normale du muscle squelettique chez la volaille domestique. Être. J. Anat. 122, 555–563. doi: 10.1002/ aja.1001220308
Résumé PubMed | Texte intégral croisé / Google Scholar
Murach, K. A., Englund, D.A., Dupont-Versteegden, E.E., McCarthy, J. J. et Peterson, C.A. (2018). La flexibilité du domaine myonucléaire remet en question les hypothèses rigides sur la contribution des cellules satellites à l’hypertrophie des fibres musculaires squelettiques. Devant. Physiol. 9:635. doi: 10.3389/fphys.2018.00635
CrossRef Texte intégral /Google Scholar
Nevalainen, M., Kaakinen, M. et Metsikko, K. (2013). Distribution des transcriptions d’ARNm et activité de traduction dans les myofibres squelettiques. Tissu cellulaire Res. 353, 539-548. doi: 10.1007/s00441-013-1659- x
Résumé publié par PubMed | Texte intégral croisé / Google Scholar
O’Leary, M. F., Vainshtein, A., Carter, H. N., Zhang, Y. et Hood, D.A. (2012). Dysfonction mitochondriale induite par la dénervation et autophagie dans le muscle squelettique d’animaux déficients en apoptose. Être. J. Phys. Physiol cellulaire. 303, C447–C454. doi: 10.1152/ajpcell.00451.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Palumbo, C., Rovesta, C., and Ferretti, M. (2012). Striated muscle fiber apoptosis after experimental tendon lesion in a rat model. J. Anat. 221, 358–363. doi: 10.1111/j.1469-7580.2012.01554.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Qaisar, R., and Larsson, L. (2014). What determines myonuclear domain size? Indian J. Physiol. Pharmacol. 58, 1–12.
PubMed Abstract | Google Scholar
Ross, J. A., Levy, Y., Svensson, K., Philp, A., Schenk, S. et Ochala, J. (2018). SIRT1 régule le nombre nucléaire et la taille du domaine dans les fibres musculaires squelettiques. J. Cell. Physiol. 233, 7157–7163. doi: 10.1002/jcp.26542
Résumé publié | Texte intégral croisé / Google Scholar
Schiaffino, S., Dyar, K. A., Ciciliot, S., Blaauw, B. et Sandri, M. (2013). Mécanismes régulant la croissance et l’atrophie des muscles squelettiques. FEBS J. 280, 4294-4314. doi: 10.1111/febs.12253
Résumé PubMed | Texte intégral CrossRef /Google Scholar
Schmalbruch, H., et Hellhammer, U. (1977). Le nombre de noyaux dans les muscles adultes du rat avec une référence particulière aux cellules satellites. Anat. Rec. 189, 169–175. doi: 10.1002/ar.1091890204
Résumé PubMed | Texte intégral croisé / Google Scholar
Schwartz, L. M. (2008). Atrophie et mort cellulaire programmée du muscle squelettique. La Mort Cellulaire Diffère. 15, 1163–1169. doi: 10.1038/cdd.2008.68
Résumé PubMed | Texte intégral croisé / Google Scholar
Schwartz, L. M., Brown, C., McLaughlin, K., Smith, W. et Bigelow, C. (2016). Le domaine myonucléaire n’est pas maintenu dans le muscle squelettique pendant l’atrophie ou la mort cellulaire programmée. Être. J. Phys. Physiol cellulaire. 311, C607–C615. doi: 10.1152 / ajpcell.00176.2016
Résumé publié par PubMed | Texte intégral croisé / Google Scholar
Schwartz, L. M., et Ruff, R. L. (2002). Changements dans les propriétés contractiles du muscle squelettique pendant l’atrophie et la mort programmées par le développement. Être. J. Phys. Physiol cellulaire. 282, C1270–C1277. doi: 10.1152 / ajpcell.01275.2000
CrossRef Texte intégral /Google Scholar
Schwartz, L. M., Smith, S. W., Jones, M. E., et Osborne, B.A. (1993). Toutes les morts cellulaires programmées se produisent-elles par apoptose? Proc. Natl. Acad. Sci. États-Unis 90, 980-984.
Google Scholar
Schwartz, L. M., et Truman, J. W. (1983). Contrôle hormonal des taux de développement métamorphique chez le ver à cornes du tabac Manduca sexta. Dev. Biol. 99, 103–114. doi: 10.1016/0012-1606(83)90257-9
Résumé publié par PubMed | Texte intégral croisé | Google Scholar
Schwartz, L. M. et Truman, J. W. (1982). Régulation peptidique et stéroïdienne de la dégénérescence musculaire chez un insecte. Science 215, 1420-1421. doi: 10.1126/ science.6278594
Résumé PubMed | Texte intégral croisé / Google Scholar
Smith, H. K., Maxwell, L., Martyn, J.A. et Bass, J. J. (2000). Nuclear DNA fragmentation and morphological alterations in adult rabbit skeletal muscle after short-term immobilization. Tissu cellulaire Res. 302, 235-241. doi: 10.1007/s004410000280
Résumé publié / Texte intégral croisé / Google Scholar
Smith, M. I., Huang, Y. Y. et Deshmukh, M. (2009). La différenciation des muscles squelettiques évoque le XIAP endogène pour restreindre la voie apoptotique. PLoS Un 4: e5097. doi: 10.1371 / journal.pone.0005097
CrossRef Full Text / Google Scholar
Staron, R. S., Leonardi, M. J., Karapondo, D. L., Malicky, E. S., Falkel, J. E., Hagerman, F. C., et al. (1991). Strength and skeletal muscle adaptations in heavy-resistance-trained women after detraining and retraining. J. Appl. Physiol. 70, 631-640.
Google Scholar
Strassburger, E. (1893). Sur la sphère d’action des noyaux et la taille des cellules. Histol Contribution. 5, 97-124.
Google Scholar
Strasser, H., Tiefenthaler, M., Steinlechner, M., Eder, I., Bartsch, G., et Konwalinka, G. (2000). Apoptose dépendante de l’âge et perte de cellules rhabdosphincter. J. Urol. 164, 1781–1785. doi: 10.1016/S0022-5347 (05) 67106-6
Résumé PubMed | Texte intégral croisé / Google Scholar
Tedesco, F. S., Dellavalle, A., Diaz-Manera, J., Messina, G. et Cossu, G. (2010). Réparation du muscle squelettique: potentiel régénérateur des cellules souches du muscle squelettique. J. Clin. Investir. 120, 11–19. doi: 10.1172/JCI40373
Résumé publié/ Texte intégral croisé/Google Scholar
Wada, K. I., Takahashi, H., Katsuta, S. et Soya, H. (2002). Aucune diminution du nombre myonucléaire après dénervation à long terme chez les souris matures. Être. J. Phys. Physiol cellulaire. 283, C484–C488. doi: 10.1152 / ajpcell.00025.2002
CrossRef Texte intégral /Google Scholar
Winje, I. M., Sheng, X., Hansson, K. A., Solbrå, A., Tennøe, S., Saatcioglu, F., et al. (2018a). La cachexie n’induit pas de perte de myonucléi ou de fibres musculaires lors d’un cancer de la prostate xénogreffé chez la souris. Acta Physiol. e13204. doi: 10.1111/apha.13204
CrossRef Texte intégral /Google Scholar
Winje, I. M., Bengtsen, M., Eftestol, E., Juvkam, I., Bruusgaard, J. C., et Gundersen, K. (2018b). Marquage spécifique des myonucléés par un anticorps contre le matériel péricentriolaire 1 sur des coupes de tissu musculaire squelettique. Acta Physiol. 223: e13034. doi: 10.1111/apha.13034
CrossRef Texte intégral /Google Scholar
Woo, J. (2017). Sarcopénie. Clin. Gériatr. Med. 33, 305–314. doi: 10.1016 / j.cger.2010.02.012
CrossRef Texte intégral /Google Scholar
Xiao, R., Ferry, A. L., et Dupont-Versteegden, E. E. (2011). La résistance à la mort cellulaire des myotubes différenciés est associée à des mécanismes anti-apoptotiques améliorés par rapport aux myoblastes. Apoptose 16, 221-234. doi: 10.1007/s10495-010-0566-9
Résumé publié par PubMed | Texte intégral croisé / Google Scholar
Yang, D., Morris, S. F. et Sigurdson, L. (1998). Le muscle sartorius: considérations anatomiques pour les chirurgiens reconstructeurs. Radiol. Anat. 20, 307–310. doi: 10.1007
Résumé publié| Texte intégral croisé /Google Scholar
Zhong, H., Roy, R. R., Siengthai, B. et Edgerton, V. R. (2005). Effects of inactivity on fiber size and myonuclear number in rat soleus muscle. J. Appl. Physiol. 99, 1494–1499. doi: 10.1152/ japplphysiol.00394.2005
CrossRef Texte intégral / Google Scholar
Zhou, X., Wang, J. L., Lu, J., Song, Y., Kwak, K. S., Jiao, Q., et al. (2010). L’inversion de la cachexie cancéreuse et de l’atrophie musculaire par l’antagonisme de l’Act RIIB conduit à une survie prolongée. Cellule 142, 531-543. doi: 10.1016/j. cell.2010.07.011
Résumé PubMed | Texte intégral croisé / Google Scholar
Ziaaldini, M. M., Marzetti, E., Picca, A. et Murlasits, Z. (2017). Les voies biochimiques de la sarcopénie et leur modulation par l’exercice physique: une revue narrative. Devant. Med. 4:167. doi: 10.3389 /fmed.2017.00167
CrossRef Texte intégral /Google Scholar