- Introduction
- Matériaux et méthodes
- Souches
- Extraction d’ADN
- Amplifications PCR stx1 et stx2
- Séquençage de l’ADN
- Préparations de cellules Vero sur microplaques
- Préparations bactériennes sans cellules
- Dosage cytotoxique et détermination de la DL50
- Test de blocage et de neutralisation des toxines
- L’acquisition d’OMVs et l’extraction d’ADN à partir de vésicules membranaires externes d’OMVs
- Résultats
- Amplifications par PCR des gènes stx1 et stx2
- Séquençage de l’ADN
- Dosage cytotoxique et détermination de la DL50
- Neutralisation des toxines
- les amplifications PCR du gène stx1 à partir de l’OMVs
- Discussion
- Contributions de l’auteur
- Financement
- Déclaration sur les conflits d’intérêts
- Remerciements
- Abréviations
Introduction
Pendant plusieurs années, l’importance d’Aeromonas spp., en tant qu’agent responsable de la diarrhée humaine était controversé; plusieurs études ont démontré que le mécanisme pathogène d’Aeromonas est multifactoriel car de nombreux facteurs de virulence sont impliqués, y compris la production de cytotoxines (Castro-Escarpulli et al., 2002, 2003). Ces toxines peuvent provoquer une diarrhée ou une colite hémorragique et peuvent jouer un rôle majeur dans le syndrome hémolytique-urémique (SHU) et le développement du TTP (Bogdanović et al., 1991; Fang et coll., 1999; Monforte-Cirac et coll., 2010).
Les cytotoxines impliquées dans ces maladies comprennent la toxine Shiga et la Stx étroitement apparentée. Les variantes Stx sont exprimées chez les espèces bactériennes Shigella, Enterobacter, Citrobacter, Acinetobacter, Campylobacter et Hamiltonella (Mauro et Koudelka, 2011). Alperi et Figueras (2010) ont décrit la présence de Stx1 et Stx2 dans des isolats cliniques d’Aeromonas spp., associée à la gastro-entérite, à la colite hémorragique et au SHU. Les gènes codant ces toxines sont localisés dans différents bactériophages lambdoïdes qui lysogénisent cette souche. De plus, le genre Aeromonas a un système à sécrétion nulle nommé OMVs. Les OMV pourraient être un moyen par lequel certaines protéines, l’ARN, les composants de l’espace périplasmique et d’autres composants associés à la virulence peuvent être transférés horizontalement à d’autres genres; par conséquent, on pense que les OMV jouent un rôle important dans la pathogénicité (Guerrero-Mandujano et al., 2015a, b).
Pour cette raison, le but de cette étude était d’évaluer les dommages causés par la production de Stx par des souches isolées d’enfants de Mexico dans des cultures de cellules Vero.
Matériaux et méthodes
Souches
Cette étude comprenait 66 isolats cliniques de l’INP, 54 provenant d’infections intestinales et 12 d’infections extra-intestinales. Les souches ont été isolées à partir de spécimens obtenus pour des tests de routine à l’hôpital mentionné; par conséquent, aucun consentement éclairé n’était requis des parents ou des tuteurs légaux des enfants. Toutes les souches ont été identifiées génétiquement par l’ADNr 16S-RFLP (Hernández-Cortez et al., 2011). La souche typée pour Escherichia coli O157: H7 CECT 4076 a été utilisée comme témoin positif et la souche E. coli K12 (5512 ENCB) de la collection du Laboratoire de bactériologie médicale (Escuela Nacional de Ciencias Biologicas, IPN) a été utilisée comme témoin négatif pour la production de toxines. Les souches ont été maintenues pendant de courtes périodes à température ambiante sur des inclusions à base de gélose sanguine; pour un stockage plus long, elles ont été soit congelées à -70 ° C dans un bouillon glycérol-Todd-Hewitt à 20% (p/v) (Oxoïde, Mexique), soit lyophilisées dans 7.sérum de glucose de cheval à 5%.
Extraction d’ADN
Toutes les cultures ont été cultivées sur gélose de soja tryptique à 30°C pendant 18 h. L’ADN génomique de chaque souche a été obtenu par matrice InstaGene (BioRad®, Mexique) selon les instructions fournies par le fabricant. La pureté et la quantité d’ADN ont été déterminées à l’aide du spectrophotomètre Ampli Quant AQ-07. L’ADN a été conservé à -20°C jusqu’à son utilisation.
Amplifications PCR stx1 et stx2
La présence de stx1 et stx2 à partir d’ADN d’OMVs et d’ADN génomique a été détectée par des réactions PCR uniques utilisant des amorces STX1F / STX1R et STXF / STXR avec un produit de 144 et 217 pb, respectivement, ces amorces ont été conçues en fonction de la séquence de la sous-unité A. Les amorces, la réaction et les conditions d’amplification ont été traitées comme décrit précédemment par Hernández-Cortez et coll. (2013), avec les témoins positifs (E. coli O157:H7) et négatifs (E. coli K12).
Séquençage de l’ADN
Les produits de réaction en chaîne par polymérase ont été purifiés à l’aide d’un kit d’extraction rapide en gel PureLink (Invitrogen®, Mexique) selon les instructions du fabricant. Les produits ont été directement séquencés sur un analyseur génétique ABI-PRISM 310 (Applied Biosystems, Foster City, CA, USA) en utilisant les amorces avant et arrière utilisées pour la PCR, selon les instructions du fabricant. Le séquençage a été effectué à l’Instituto de Biología, UNAM (Mexique). L’analyse des séquences a été réalisée avec l’outil de recherche d’alignement Local de Base (BLAST) fourni par le National Center for Biotechnology Information (NCBI).
Préparations de cellules Vero sur microplaques
Cette procédure a été réalisée dans des microplaques à 96 puits avec une monocouche de cellules Vero (ATCC CCL81) à 80% de confluence, en ajoutant un milieu essentiel minimal (MEM; Invitro®, Mexique) complété par du sérum fœtal bovin v/v à 10% (FBS; Invitro®, Mexique).
La suspension cellulaire a été homogénéisée et ajustée à 105-106 cellules/mL à l’aide d’une chambre de Neubauer. Après ajustement, la suspension a été déposée dans un puits de 200 µL. Les microplaques ont été incubées à 37°C sous 5% de CO2 pendant 24 h (CO2 Incubator, VWR Scientific, USA) (Giono-Cerezo et al., 1994).
Préparations bactériennes sans cellules
Cinq colonies de chaque plaque de gélose sanguine ont été inoculées dans 3 mL de milieu Craig (0,4% d’extrait de levure, 3% d’acides casaminoacides, 0,05% de K2HPO4). Ceux-ci ont été incubés pendant 24 h à 37°C et la densité optique de la culture bactérienne utilisée était de 0,25 à 600 nm. Des préparations sans cellules ont été réalisées par centrifugation des cultures à 14 000 g pendant 10 min à 4°C, suivie d’une filtration du surnageant à travers un filtre à membrane (taille des pores 0,45 pm, Sartorius Minisart NML). Des surnageants sans cellules ont été stockés à -20 °C. Au total, 66 préparations bactériennes sans cellules ont été obtenues de cette manière ; le témoin positif (E. coli O157:H7) et le témoin négatif (E. coli K12) ont également été obtenus de la même manière (Giono-Cerezo et al., 1994).
Dosage cytotoxique et détermination de la DL50
Le filtrat sans cellules (20 µL) a été inoculé dans des puits contenant des cellules et le milieu de croissance respectif sans antibiotiques. Les cellules inoculées ont été incubées pendant 96 h à 37°C avec 5% de CO2 et observées toutes les 24 h au microscope inversé. L’effet cytotoxique devait apparaître sous la forme d’un arrondi et d’un rétrécissement des cellules avec une granulation épaisse et, enfin, une destruction progressive et irréversible de la monocouche. Tous les tests ont été effectués en double; des contrôles de viabilité avec MEM et Craig medium ont également été effectués (Giono-Cerezo et al., 1994).
La DL50 a été déterminée chez des souches d’Aeromonas détectées comme positives pour causer des dommages cytotoxiques dans les cellules Vero. Une microplaque standard à 96 puits avec des cellules Vero a été préparée comme indiqué en 2.6, mais le milieu a été changé en 100 µL de MEM avec 1% de BFS. Cette préparation a été exposée à 100 µL de préparation bactérienne sans cellules et des dilutions en série ont été effectuées sur toute la rangée de plaques. Après 24 h d’incubation à 37°C avec 5% de CO2, la DL50 a été déterminée, au microscope inversé. La DL50 a été attribuée au puits dans lequel 50 % des cellules Vero ont été endommagées et 50 % non endommagées (Marques et al., 1986).
Test de blocage et de neutralisation des toxines
Le test de neutralisation des toxines a été effectué chez les souches qui ont induit des dommages cytotoxiques dans les cellules Vero car ces dommages sont indicatifs de Stx. Pour ce test, une microplaque a été préparée avec des cellules Vero cultivées jusqu’à une confluence de 90 à 100% avec la DL50 de chaque préparation bactérienne sans cellules. Pour effectuer le test de neutralisation afin de montrer les dommages cellulaires produits par l’action de Stx, deux anticorps monoclonaux (Universidad Nacional Autónoma de México) obtenus à partir d’E. coli O157:H7 ont été utilisés.
Pour chaque Ab une quantification de la protéine de Bradford a été effectuée selon les instructions du fabricant (Biorad), avec un résultat de 78,2 et 74,8 µg/µL, respectivement, d’anti-Stx1 et d’anti-Stx2 A. L’Ab concentré a été travaillé et une double dilution de l’Ab. Puis, 10 µL de l’Ab (anti-STX1 ou anti-STX2) ont été incubés avec 190 µL du surnageant sans cellules à une concentration de DL50 pendant 1 h à 37°C. Ensuite, 200 µL de ce dernier ont été inoculés dans des cellules Vero à 90% de confluence et incubés pendant 24 h à 37°C avec 5% de CO2 (Marques et al., 1986).
L’acquisition d’OMVs et l’extraction d’ADN à partir de vésicules membranaires externes d’OMVs
ont été obtenues à partir d’Aeromonas hydrophila F-0050. Le protocole a été réalisé comme décrit précédemment par Guerrero-Mandujano et al. (2015a).
L’ADN de l’OMVs a été obtenu par matrice InstaGene (BioRad®, Mexique) selon les instructions fournies par le fabricant. Ensuite, l’ADN de l’OMVs a été purifié par la technique d’extraction d’ADN phénol-chloroforme (Guerrero-Mandujano et al., 2015b).
Résultats
Amplifications par PCR des gènes stx1 et stx2
Le criblage par réaction en chaîne par polymérase de 66 souches cliniques d’Aeromonas a montré que 22/66 (33,3 %) souches contenaient le gène stx1, 42/66 (63,6 %) souches contenaient les deux gènes, aucune souche ne contenait uniquement le gène stx2 et 2/66 (3 %) souches étaient négatives pour les deux gènes.
Séquençage de l’ADN
L’analyse de BLASTn a montré une similitude de 79 à 99% et une valeur attendue de 3e-16/2e-97 entre les gènes stx-1/stx-2 d’E. coli O157:H7 et l’amplicon d’Aeromonas spp., souche.
Dosage cytotoxique et détermination de la DL50
Le test de cytotoxicité effectué dans des cultures de cellules Vero a montré que 17/66 (25,7%) de préparations bactériennes exemptes de cellules causaient des dommages cytotoxiques, suggérant la production d’un Stx actif (Figure 1), révélé par les dommages caractéristiques causés par Stx.
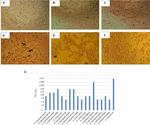
FIGURE 1. Test de cytotoxicité et détermination de la DL50 effectués dans des cultures de cellules Vero. (A) Culture de cellules Vero avec un Milieu Essentiel Minimal (Test de viabilité). (B) Culture de cellules Vero avec le milieu Craig (test de viabilité). C) Contrôle négatif avec E. coli K12. (D) Contrôle positif avec E. coli O157: H7, des dommages cytotoxiques sont montrés (flèches) par destruction de la monocouche cellulaire et effet « vieille dentelle”. (E) Dommages cytotoxiques de la souche A. hydrophila F-0050. (F) Dommages cytotoxiques de la souche A. caviae 421423. G) Représentation graphique du titre DL50 de toutes les souches.
Les résultats pour la détermination du titre DL50 étaient les suivants: 6/17 (35,2%) des préparations bactériennes sans cellules présentaient un titre de 1: 16; 5/17 (29,4%) des préparations bactériennes sans cellules présentaient un titre de 1: 8; 3/17 (17,6%) des préparations bactériennes sans cellules avaient un titre de 1: 64; 2/17 (11,7%) des préparations bactériennes sans cellules avec un titre de 1: 32; et 1/17 (5,8%) de préparations bactériennes sans cellules avec un titre de 1: 256 (Figure 1G).
Neutralisation des toxines
L’application de l’anti-STX1 Ab en 11/17 (64.les dommages aux cellules dans le surnageant ont été complètement inhibés à une concentration de 39,1 µg / µL Ab; dans les préparations bactériennes sans cellules 4/17 (23,5%), des dommages cellulaires réduits ont été observés à la même concentration; et dans les préparations bactériennes sans cellules 2/17 (11,7%), les dommages cellulaires ont été complètement inhibés à une concentration de 78,2 µg / µL. L’utilisation de l’anti-STX2 Ab a montré que dans les préparations bactériennes exemptes de cellules 9/17 (52,9%), les dommages cellulaires étaient totalement inhibés à 37,4 µg / µL et que les préparations bactériennes exemptes de cellules 6/17 (35,2%) présentaient des dommages cellulaires réduits à la même concentration; et dans 2/17 (11.7%) préparations bactériennes sans cellules, les dommages cellulaires ont été complètement inhibés avec une concentration d’Ab de 74,8 µg / µL (Figures 2 et 3).

FIGURE 2. Inhibition de l’effet cytotoxique induit dans la culture de cellules Vero par des préparations bactériennes sans cellules d’Aeromonas spp. souches portant le gène stx1 ou stx2.
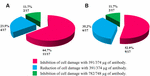
FIGURE 3. Pourcentage de souches ayant montré une inhibition ou une réduction des dommages cellulaires. A) Neutralisation avec l’anti-Stx1 Ab. B) Neutralisation avec l’anti-Stx2 Ab.
les amplifications PCR du gène stx1 à partir de l’OMVs
La réaction en chaîne par polymérase de l’ADN d’OMVs d’A. hydrophila F-0050 a révélé que l’OMVs contenait la génération stx1; par conséquent, l’OMVs pourrait être un véhicule potentiel pour le transfert de gènes de virulence horizontale (Figure 4).
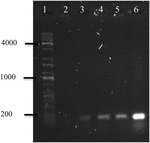
FIGURE 4. Électrophérogramme d’amplification du gène stx1 à partir de l’ADN d’OMVs. (1) Échelle universelle Kapa, (2) Témoin négatif, (3) OMV de A. hydrophila F-0050, (4) A. hydrophila F-0050, (5) OMV de E. coli O157:H7, et (6) E. coli O157:H7.
Discussion
Le genre Aeromonas, en tant que producteur de Stx, pourrait être un agent pathogène émergent qui cause la diarrhée principalement chez les patients pédiatriques (Hernández-Cortez et al., 2011; Figueras et Baez-Hidalgo, 2014). Néanmoins, ce genre est devenu plus pertinent dans le domaine médical, car il s’agit d’un agent pathogène causant le SHU (San Joaquín et Pickett, 1988; Bogdanović et al., 1991; Robson et coll., 1992; Fang et coll., 1999; Monforte-Cirac et coll., 2010).
Dans cette étude, nous avons constaté, par amplification PCR des gènes stx1 et stx2, que 22/66 (33.3%) des souches d’aeromonad contenaient le gène stx1, 42/66 (63,6%) contenaient les deux gènes, et il n’y avait aucune souche contenant stx2 seule. Cela peut nous amener à suggérer que ce gène est largement distribué dans les souches d’Aeromonas isolées de patients pédiatriques et que ces patients peuvent être à risque de développer un SHU.
Il n’y a qu’un seul rapport précédent dans lequel les gènes stx ont été étudiés dans des souches d’Aeromonas isolées de différents hôpitaux en Espagne; les résultats obtenus étaient que 19/80 (23,7%) souches avaient le gène stx1 et seulement 1/80 (1.25 %) était positive pour les deux gènes (Alperi et Figueras, 2010). Ces résultats montrent qu’il y a une plus grande distribution du gène dans les souches mexicaines; cependant, il faut tenir compte du fait qu’en Espagne, le genre Aeromonas est un agent pathogène gastro-intestinal connu isolé de manière routinière chez les patients présentant un profil gastro-intestinal, par conséquent, un traitement adéquat est administré pour affronter ce genre.
Au Mexique, ce genre n’est pas inclus dans la liste des agents pathogènes responsables de la diarrhée et il n’est pas isolé de manière routinière; en conséquence, il est difficile de donner un traitement et une bonne qualité de vie aux patients; de plus, il n’existe aucune statistique sur sa prévalence. De plus, le genre devient plus pertinent en raison des conditions socio-économiques de la population mexicaine, notamment la pénurie d’eau, ce qui facilite sa transmission et augmente la possibilité que le SHU devienne un problème de santé publique.
Un séquençage des amplicons a été effectué et une recherche par Blast a été effectuée, qui a montré une similitude de 79 à 99% et une valeur d’espérance de 3e-16/ 2e-97 entre les gènes stx1/stx2 par rapport à E. coli O157:H7.
La DL50 a été déterminée pour évaluer les dommages cytotoxiques dans la culture de cellules Vero; avec ce paramètre et sur la base de Marques et al. (1986), les souches peuvent être regroupées en production faible (2 × 101 à 6 × 102), modérée (103-104) et élevée (105-108) (Figure 1G). Marques et al. (1986) ont réalisé une étude dans laquelle ils ont effectué un dosage similaire à celui de la présente étude, mais avec des souches différentes de STEC, ils ont obtenu que 262/400 (63%) de souches étaient regroupées en producteurs de Stx faibles et que 48% produisaient des dommages cytotoxiques; néanmoins, chez 40% de ces souches, les dommages cytotoxiques ont été inhibés par des anticorps anti-Stx.
Dans la présente étude, 25,7% des préparations exemptes de bactéries ont causé des dommages cytotoxiques caractéristiques de Stx dans les cellules Vero, suggérant la production de Stx actif, toutes les souches d’Aeromonas ont été regroupées comme de faibles producteurs de Stx; cependant, dans 50 à 70% des surnageants exempts de cellules, les dommages cellulaires ont été inhibés et dans 20 à 30% des surnageants exempts de cellules, les dommages cellulaires ont été réduits (Figure 3). Les surnageants sans cellules dans lesquels les dommages cellulaires ont été réduits cela aurait pu être dû à deux variantes de la toxine présente dans le surnageant, par conséquent, comme ils sont immunologiquement différents, le Stx n’a pas pu être totalement inhibé et les dommages cellulaires sont restés (Marques et al., 1986).
Deux études antérieures (Haque et al., 1996; Alperi et Figueras, 2010) ont obtenu respectivement 10,2 % et 10,53 % de souches d’Aeromonas productrices de Stx1. La raison d’un pourcentage plus élevé de souches d’Aeromonas produisant du Stx actif pourrait être due à la grande disponibilité du bactériophage Stx à l’intérieur de la culture, car certaines souches STEC porteuses du bactériophage Stx ont été isolées des eaux usées urbaines des usines de traitement, des eaux usées des abattoirs et des selles de bétail (García-Aljaro et al., 2004, 2009). De même, des études de transduction ont été menées in vivo avec des phages Stx d’E. coli, qui peuvent infecter des bactéries du microbiote intestinal, donnant la caractéristique toxigène à des souches qui n’étaient pas infectées auparavant (Acheson et al., 1998; Schmidt et coll., 1999; Gamage et coll., 2003). La même chose pourrait se produire avec le genre Aeromonas lorsqu’il induit un profil gastro-intestinal, suivi du fait que le genre Aeromonas a la capacité de capturer et d’intégrer des facteurs de virulence dans son génome, et l’un d’eux est le gène codant pour Stx.
Le reste des souches a causé des dommages cytotoniques dans la cellule, suggérant peut-être la production de toxines différentes autres que Stx, car Aeromonas est un genre capable de produire deux entérotoxines cytotoniques, thermostables (AST) et thermolabiles (ALT) (Figueras et Baez-Hidalgo, 2014), qui peuvent causer des dommages cytotoniques dans les cellules Vero; une autre possibilité est que les souches d’Aeromonas aient plus d’un bactériophage inséré dans leur génome, car il a été démontré que les souches STEC à double lysogénie sont capables de réguler les bactériophages pour inhiber la capacité d’induction du cycle lytique, ce qui entraîne une diminution de la production de Stx mais sans perdre le gène (García-Aljaro et al., 2004; Imamovic et Muniesa, 2011). Par conséquent, il est nécessaire d’établir le nombre de bactériophages que contiennent les souches d’Aeromonas, y compris dans la présente étude, pour pouvoir corréler la présence de bactériophages Stx et la quantité produite de Stx.
Par contre, la présence de bactériophages Stx dans les Aéromonas inductibles représente un mécanisme de transfert horizontal du gène stx, mais ce n’est pas le seul. Dans des études plus récentes, il a été déterminé que les Aeromonas sont capables de produire des OMV (Guerrero-Mandujano et al., 2015a) et ces OMV sont capables de transporter de l’ADN intégré (Guerrero-Mandujano et al., 2015b). Dans la présente étude, nous avons amplifié le gène stx1 à partir de l’ADN extrait des OMV d’une souche d’A. hydrophila d’origine clinique, qui a induit des dommages cytotoxiques dans les cellules Vero, et ces dommages ont été inhibés par des anticorps anti-Stx. Cela indique que le bactériophage Stx est le mécanisme de transport du gène stx; de plus, l’OMVs et le Système de transport récemment appelé Type 0 sont capables de propager le gène stx entre espèces ou intraspécifiques. Néanmoins, il est nécessaire de confirmer si le gène contenu dans l’OMVs est complet. Les résultats obtenus dans cette étude soutiennent l’hypothèse que le gène stx est un autre facteur de virulence présumé d’Aeromonas qui pourrait être transféré par OMVs. Il pourrait représenter un autre mécanisme de transport horizontal du gène stx vers d’autres souches d’Aeromonas et/ou d’autres genres bactériens.
Pour cette raison, ce genre devrait être inclus comme agent causal possible de la gastro-entérite lors de la tentative d’identification des agents causaux et devrait être signalé dans le cadre des procédures de surveillance sanitaire standard.
Contributions de l’auteur
IP-M et AG-M ont effectué les expériences et MR-R a effectué les analyses bioinformatiques et rédigé le manuscrit; CH-C a conçu l’amorce; VB-G et JM-L ont commenté et révisé le manuscrit de manière critique; GC-E a conçu l’étude, participé à sa conception et à sa coordination, évalué les données et rédigé le manuscrit. Tous les auteurs ont lu et approuvé le manuscrit final. Nous tenons à remercier Sofia Marteli Mulia d’avoir gentiment corrigé le style du manuscrit.
Financement
Le GC-E et le VB-G ont reçu le soutien des Estímulos al Desempeño en Investigación et de la Comisión y Fomento de Actividades Académicas (Instituto Politécnico Nacional) et du Sistema Nacional de Investigadores (SNI, CONACyT). Cette étude a été financée par le Secrétariat à la Recherche et au Troisième Cycle de l’Institut Polytechnique National (SIP 20160609). Le SIP-IPN n’a pas participé à l’élaboration de la conception de l’étude, à la collecte, à l’analyse et à l’interprétation des données, à la rédaction du rapport ni à la décision de soumettre le document pour publication. IP-M et AG-M ont obtenu une bourse de CONACyT et BEIFI.
Déclaration sur les conflits d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de relations commerciales ou financières pouvant être interprétées comme un conflit d’intérêts potentiel.
Remerciements
Nous remercions le Dr Patricia Arzate Barbosa d’avoir fourni des isolats de souches et le Dr Armando Navarro d’avoir fourni les anticorps monoclonaux.
Abréviations
Ab, Anticorps; SHU, Syndrome hémolytique et urémique; INP, Instituto Nacional de Pediatria Mexico; DL50, Dose létale médiane; OMVs, Outer membrane vesicles; PCR, Polymerase chain reaction; STEC, Shiga toxin-producing E. coli; Stx, Shiga-like toxin; TTP, Thrombotic thrombocytopenic purpura.
Acheson, D. W., Reidl, J., Zhang, X., Keusch, G. T., Mekalanos, J. J., and Waldor, M. K. (1998). In vivo transduction with shiga toxin 1-encoding phage. Infect. Immun. 66, 4496–4498.
Google Scholar
Alperi, A., and Figueras, M. J. (2010). Les isolats humains d’Aeromonas possèdent des gènes de toxine shiga (stx1 et stx2) très similaires aux variantes du gène virulent bridge d’Escherichia coli. Clin. Microbiol. Infecter. 16, 1563-1567. doi: 10.1111/j.1469-0691.2010.03203.x
CrossRef Texte intégral/Google Scholar
Bogdanovic, R., Čobeljić, M., Markovic, M., Nikolic, V., Ognjanović, M., Sarjanović, L., et al. (1991). Syndrome hémolytique-urémique associé à l’entérocolite d’Aeromonas hydrophila. Pédiatre. Néphrol. 5, 293-295. doi: 10.1007
CrossRef Texte intégral|Google Scholar
Castro-Escarpulli, G., Aguilera-Arreola, M. G., Giono-Cerezo, S., Hernández-Rodríguez, C. H., Rodriguez-Chacon, M., Soler, F. L., et coll. (2002). Le genre Aeromonas > Un agent pathogène important au Mexique? Enf. Infec. Mike. 22, 206–216.
Google Scholar
Castro-Escarpulli, G., Figueras, M. J., Aguilera-Arreola, M. G., Soler, L., Fernández-Rendón, E., Aparicio, G. O., et al. (2003). Caractérisation d’Aeromonas spp. isolé à partir de poissons congelés destinés à la consommation humaine au Mexique. Int. J. Microbiol alimentaire. 84, 41–49. doi: 10.1016/S0168-1605(02) 00393-8
CrossRef Texte intégral/Google Scholar
Fang, J. S., Chen, J. B., Chen, W. J. et Hsu, K. T. (1999). Syndrome hémolytique-uréémique chez un homme adulte atteint d’entérocolite à Aeromonas hydrophila. Néphrol. Cadran. Transplantation. 14, 439–440. doi: 10.1093/ndt/14.2.439
CrossRef Texte intégral/Google Scholar
Figueras, M. J., et Baez-Hidalgo, R. (2014). « Aeromonas », dans Encyclopedia of Food Microbiology, éd. C. A. Batt et M. L. Tortorello (Cambridge, MA: Academic Press), 24-30.
Gamage, S. D., Strasser, J. E., Chalk, C. L. et Weiss, AA (2003). Escherichia coli non pathogène peut contribuer à la production de toxine shiga. Infecter. Immun. 71, 3107–3115. doi: 10.1128/IAI.71.6.3107-3115.2003
CrossRef Texte intégral/Google Scholar
García-Aljaro, C., Muniesa, M., Jofre, J., et Blanch, A. R. (2004). Prevalence of the stx2 gene in coliform populations from aquatic environments. Appl. Environ. Microbiol. 70, 3535–3540. doi: 10.1128/AEM.70.6.3535-3540.2004
CrossRef Texte intégral/Google Scholar
García-Aljaro, C., Muniesa, M., Jofre, J., et Blanch, A. R. (2009). Genotypic and phenotypic diversity among induced, stx2-carrying bacteriophages from environmental Escherichia coli strains. Appl. Environ. Microbiol. 75, 329–336. doi: 10.1128/AEM.01367-08
CrossRef Texte intégral/Google Scholar
Giono-Cerezo, S., Rodríguez-ÁnGeles, M. G., Rodríguez-Cadena, M. J., et Valdespino-Gómez, J. L. (1994). Identification des entérotoxines et des cytotoxines d’Escherichia coli par culture de cellules vero et hybridation en phase solide (tache de colonie). Rév. Latinoam. Microbiol. 36, 231–241.
Google Scholar
Guerrero-Mandujano, A., López-Villegas, E. O., Longa-Briseño, A. et Castro-Escarpulli, G. (2015a). Production de vésicules membranaires externes dans une souche clinique d’Aeromonas hydrophila. Microbiol EC. 1, 113–117.
Google Scholar
Guerrero-Mandujano, A., Palma-Martínez, I., et Castro-Escarpulli, G. (2015b). Transport de l’ADN par les vésicules membranaires externes d’Aeromonas hydrophila. Microbiol EC. 2, 354–357.
Google Scholar
Haque, Q. M., Sugiyama, A., Iwade, Y., Midorikawa, Y. et Yamauchi, T. (1996). Isolats diarrhéiques et environnementaux d’Aeromonas spp. produire une toxine semblable à la toxine 1 de type shiga. Curr. Microbiol. 32, 239–245. doi: 10.1007/s002849900043
CrossRef Texte intégral|Google Scholar
Hernández-Cortez, C., Aguilera-Arreola, M. G., Chávez-Méndez, Y., Arzate-Barbosa, P., Lara-Hernandez, A., et Castro – Escarpulli, G. (2011). Identification génétique des souches d’Aeromonas spp. isolé à l’institut national de pédiatrie. Rév. Enfer. Infecc. Pédiatrique. 24, 157–165.
Google Scholar
Hernández-Cortez, C., Méndez-Tenorio, A., Aguilera-Arreola, M. G., et Castro-Escarpulli, G. (2013). Conception et normalisation de quatre réactions en chaîne de polymérase multiplex pour détecter les bactéries responsables de maladies gastro-intestinales. AFR. J. Microbiol. Rés. 7, 2673-2681. doi: 10.5897/AJMR2013.5452
CrossRef Texte intégral/Google Scholar
Imamovic, L., et Muniesa, M. (2011). Quantification et évaluation de l’infectiosité des bactériophages codant pour la toxine shiga dans le bœuf et la salade. Appl. Environ. Microbiol. 77, 3536–3540. doi: 10.1128/AEM.02703-10
CrossRef Texte intégral/Google Scholar
Marques, L. R. M., Moore, M. A., Wells, J. G., Wachsmuth, I. K., et O’Brien, A.D. (1986). Production de toxine de type shiga par Escherichia coli. J. Infecter. Dis. 154, 338–341. doi: 10.1093/infdis/154.2.338
CrossRef Full Text/Google Scholar
Mauro, S.A., et Koudelka, G. B. (2011). Toxine Shiga : expression, distribution et rôle dans l’environnement. Toxines 3, 608-625. doi:10.3390/toxins3060608
CrossRef Texte intégral/Google Scholar
Monforte-Cirac, M. L., Palacian-Ruiz, M. P., Aisa-Iriarte, M. L., et Espuelas-Monge, M. (2010). Syndrome hémolytique et urémique par Aeromonas: à propos d’un cas clinique. Rév. Clin. Esprit. 210, 206–207. doi: 10.1016 / j.cer.2009.08.002
CrossRef Texte intégral/Google Scholar
Robson, W. L. M., Leung, A. K. C., et Trevenen, C. L. (1992). Syndrome hémolytique-urémique associé à l’entérocolite d’Aeromonas hydrophila. Pédiatrique. Néphrol. 6, 221–222. doi:10.1007
CrossRef Texte intégral/Google Scholar
San Joaquin, V. H., et Pickett, D.A. (1988). Gastro-entérite associée à Aeromonas chez les enfants. Pédiatre. Infecter. Dis. J. 7, 53-57. doi: 10.1097/00006454-198801000-00013
CrossRef Texte intégral/Google Scholar
Schmidt, H., Bielaszewska, M. et Karch, H. (1999). Transduction d’isolats d’Escherichia coli entériques avec un dérivé du bactériophage f3538 codant pour la toxine shiga 2 isolé d’Escherichia coli O157:H7. Appl. Environ. Microbiol. 65, 3855–3861.
Google Scholar