Si vous avez déjà étudié un tableau périodique des éléments (voir ci-dessous), vous savez probablement déjà que ce tableau en révèle beaucoup sur les propriétés chimiques des atomes qui composent notre monde.
Mais vous ne réalisez peut—être pas que chaque carré du tableau périodique représente en fait une famille d’isotopes – des atomes qui partagent le même nom et les mêmes propriétés chimiques, mais ont des masses différentes.
Pour comprendre ce que sont les isotopes et comment nous pouvons les utiliser, nous devons examiner de plus près l’intérieur d’un atome.

Blocs constitutifs de la matière
Un atome est composé d’un noyau incroyablement dense (appelé noyau) de protons et de neutrons, entouré d’un nuage diffus d’électrons.
Vous pouvez considérer les protons et les neutrons comme le même type de particule avec une différence clé: les protons sont chargés positivement, tandis que les neutrons ne portent aucune charge. Cela signifie que les protons peuvent ”ressentir » des champs électriques ou magnétiques, alors que les neutrons ne le peuvent pas.
Les électrons, qui sont beaucoup plus légers que les protons ou les neutrons, portent la même amplitude de charge qu’un proton mais avec le signe opposé, ce qui signifie que chaque atome qui a un nombre égal de protons et d’électrons est électriquement neutre.
Ce sont les électrons qui déterminent le comportement chimique d’un élément particulier.

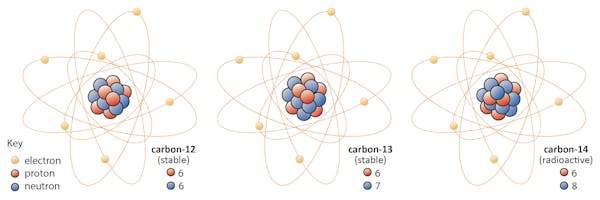
Les isotopes d’un élément partagent le même nombre de protons mais ont un nombre différent de neutrons. Prenons le carbone comme exemple.
Il existe trois isotopes du carbone dans la nature: le carbone 12– le carbone 13 et le carbone 14. Les trois ont six protons, mais leurs nombres de neutrons – 6, 7 et 8, respectivement – diffèrent tous. Cela signifie que les trois isotopes ont des masses atomiques différentes (le carbone 14 étant le plus lourd), mais partagent le même numéro atomique (Z = 6).
Chimiquement, les trois sont indiscernables, car le nombre d’électrons dans chacun de ces trois isotopes est le même.
Donc différents isotopes d’un même élément sont identiques, chimiquement parlant. Mais certains isotopes ont la capacité de contourner cette règle en se transformant entièrement en un autre élément.
En marche vers la stabilité
Cette capacité de transformation de certains isotopes est liée au fait que tous les isotopes ne sont pas stables, et c’est ce qui a conduit Frederick Soddy à sa découverte des isotopes, qui a reçu le prix Nobel en 1913.
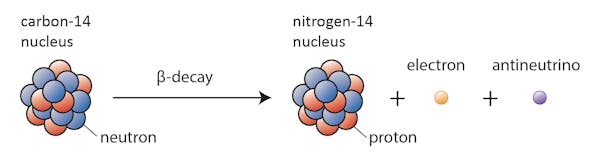
Certains isotopes – tels que le carbone 12 – continueront heureusement d’exister sous forme de carbone à moins que quelque chose d’extraordinaire ne se produise. D’autres – le carbone 14, disons – vont à un moment donné se désintégrer en un isotope stable à proximité.
Dans ce cas, l’un des neutrons du carbone 14 se transforme en proton, formant de l’azote 14. Au cours de ce processus, connu sous le nom de désintégration bêta, le noyau émet un rayonnement sous la forme d’un électron et d’un antineutrino.
De nombreux facteurs peuvent provoquer la désintégration d’un noyau. L’un des plus importants est le rapport protons / neutrons d’un noyau particulier. Si un noyau a trop de neutrons (la définition de « trop” dépend de la poids du noyau), il y a une chance qu’il se désintègre vers la stabilité.
La même chose est vraie si un noyau a trop de protons. C’est l’une des raisons pour lesquelles certains isotopes d’un élément donné sont radioactifs, tandis que d’autres ne le sont pas.
À partir du ventre des étoiles
Maintenant, vous vous demandez peut-être comment tous ces isotopes ont été créés en premier lieu. Il s’avère que cette question est complexe, mais prête une certaine vérité à l’adage selon lequel nous sommes tous faits de poussière d’étoiles.
Certains des isotopes les plus légers se sont formés très tôt dans l’histoire de l’univers, lors du Big Bang. D’autres résultent de processus qui se produisent dans les étoiles ou de collisions fortuites entre des noyaux hautement énergétiques – connus sous le nom de rayons cosmiques – dans notre atmosphère.
La plupart des isotopes naturellement existants sont le produit final (stable ou à longue durée de vie) résultant d’une longue série de réactions nucléaires et de désintégrations.
Dans la plupart de ces cas, les noyaux légers ont dû se briser avec suffisamment d’énergie pour permettre à la force forte – une liaison en forme de colle qui se forme lorsque les protons et les neutrons se rapprochent suffisamment pour se toucher – de surmonter la force électromagnétique – qui pousse les protons à s’écarter. Si la force forte l’emporte, les noyaux en collision se lient ou fusionnent pour former un noyau plus lourd.
Notre soleil en est un bon exemple. L’une de ses principales sources d’énergie est une série de réactions de fusion et de processus de désintégration bêta qui transforment l’hydrogène en hélium.

Transformer les connaissances en outils
Depuis le début des années 1900, lorsque l’existence des isotopes a été réalisée pour la première fois, les physiciens et chimistes nucléaires cherchent des moyens d’étudier comment les isotopes peuvent se former, comment ils se désintègrent et comment nous pourrions les utiliser.
Il s’avère que la nature des isotopes – leur uniformité chimique, leur caractère distinctif nucléaire – les rend utiles pour un large éventail d’applications dans des domaines aussi divers que la médecine, l’archéologie, l’agriculture, la production d’électricité et l’exploitation minière.
Si vous avez déjà subi un TEP scan, vous avez bénéficié d’un sous-produit de la désintégration radioactive de certains isotopes (souvent appelés isotopes médicaux). Nous produisons ces isotopes médicaux en utilisant nos connaissances sur le déroulement des réactions nucléaires, à l’aide de réacteurs nucléaires ou d’accélérateurs appelés cyclotrons.
Mais nous avons également trouvé des moyens d’utiliser des isotopes radioactifs naturels. Datation au carbone, par exemple, utilise l »isotope à longue durée de vie carbone-14 pour déterminer l »âge des objets.
Dans des circonstances normales, le carbone 14 est produit dans notre atmosphère par des réactions de rayons cosmiques avec l’azote 14. Il a une demi-vie d’environ 5 700 ans, ce qui signifie que la moitié d’une quantité de carbone 14 se sera désintégrée au cours de cette période.

Lorsqu’un organisme biologique est vivant, il absorbe environ un isotope du carbone 14 pour chaque billion d’isotopes stables du carbone 12 et le rapport carbone 12/ carbone 14 reste à peu près le même pendant la vie de l’organisme. Une fois qu’il meurt, le nouvel apport de carbone s’arrête.
Cela signifie que le rapport carbone-14 / carbone-12 change dans les restes de cet organisme au fil du temps.
Si nous extrayons du carbone à l’aide de méthodes chimiques à partir d’un échantillon, nous pouvons ensuite appliquer une méthode appelée spectrométrie de masse par accélérateur (AMS) pour séparer les isotopes de carbone individuels en poids.
AMS utilise le fait que les particules accélérées avec la même charge mais des masses différentes suivent des chemins distincts à travers les champs magnétiques. En utilisant ces chemins séparés, nous pouvons déterminer les rapports isotopiques avec une précision incroyable.
Comme vous pouvez le voir dans ces exemples, nous appliquons notre connaissance des isotopes de différentes manières. Nous les produisons, les détectons, les extrayons et les étudions dans le double but de comprendre pourquoi le noyau atomique se comporte comme il le fait et comment nous pouvons exploiter son pouvoir à notre avantage.