Déterminer certains paramètres tels que la taille, la longueur et l’angle à l’échelle atomique n’est pas facile. En raison de l’importance de ces paramètres, les scientifiques ont développé des méthodes pour déduire ou calculer les paramètres au niveau atomique. L’ordre des liaisons et la longueur des liaisons sont deux paramètres importants qui indiquent le type et la force des liaisons entre une paire d’atomes.
Cet article explique,
1. Quels sont l’Ordre et la Longueur de la liaison
2. Comment Calculer l’Ordre et la Longueur des obligations
– Comment Calculer l’Ordre des obligations r– – Comment Calculer la Longueur des obligations
Que sont l’Ordre et la Longueur des obligations
La longueur des obligations et l’ordre des obligations sont deux paramètres associés aux obligations covalentes. L’ordre des liaisons est le nombre de liaisons chimiques entre deux atomes et la longueur des liaisons est la distance entre deux noyaux d’atomes liés de manière covalente. Cet article explique comment calculer l’ordre et la longueur des liaisons au niveau atomique.
Comment calculer l’ordre des liaisons
L’ordre des liaisons est le nombre de liaisons chimiques entre deux atomes. Il indique la stabilité d’une liaison. Dans les liaisons covalentes, l’ordre des liaisons est le nombre d’électrons partagés. Par exemple, l’ordre de liaison d’une paire d’atomes liés par une liaison simple est un, tandis que l’ordre de liaison d’une paire d’atomes liés par une double liaison est deux. L’ordre de liaison zéro indique qu’il n’y a pas de liaison entre les atomes. La stabilité d’une molécule augmente avec l’ordre de liaison croissant. Les molécules avec liaison par résonance n’ont pas besoin d’être un entier. Dans les composés covalents à deux atomes, l’ordre de liaison entre une paire d’atomes est déterminé en dessinant d’abord la structure de Lewis, puis en déterminant le type de liaisons entre les atomes – liaison zéro, liaison simple, double ou triple. Par exemple, l’ordre de liaison de l’hydrogène gazeux est déterminé comme suit.
- Dessinez la structure de Lewis
H: H
- Déterminez le nombre de liaisons /paire d’électrons de valence
Une paire d’électrons, donc l’ordre des liaisons est 1.
S’il y a plus de deux atomes, l’ordre de liaison est déterminé comme suit. Voir l’exemple : ion nitrate.
- Dessinez la structure de Lewis
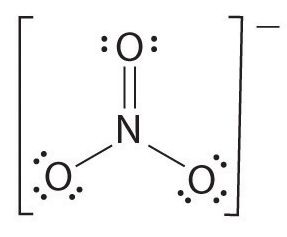
- Comptez le nombre total de liaisons (selon l’ion nitrate, ses 4)
- Le nombre de liaisons de groupes de liaisons entre atomes individuels (selon l’ammoniac, ses 3)
- Par conséquent, l’ordre de liaison = Nombre total de liaisons / nombre de groupes de liaisons
= 4/3
= 1,33
Par conséquent, l’ordre de liaison de l’ion nitrate est 1.33
Comment calculer la longueur de liaison
La longueur de liaison est la distance entre deux noyaux d’atomes liés de manière covalente. La longueur de liaison est généralement comprise entre 0,1 et 0,2 nm. Lorsque deux atomes similaires sont liés ensemble, la moitié de la longueur de liaison est appelée rayon covalent. La longueur de liaison dépend du nombre d’électrons liés de deux atomes ou de l’ordre de liaison. Plus l’ordre de liaison est élevé, plus la longueur de liaison est courte en raison des fortes forces de traction des noyaux chargés positivement. L’unité de longueur de liaison est le picomètre. Dans les liaisons simples, doubles et triples, la longueur de liaison augmente de l’ordre de
triple liaison <double liaison <liaison simple
L’électronégativité peut être utilisée pour calculer la longueur de liaison entre deux atomes ayant des électronégativités différentes. La formule empirique suivante a été proposée par Shoemaker et Stevenson pour calculer la longueur de la liaison.
dA-B = rA +rB-0.09 (xA–xB)
dA-B est la distance de liaison entre deux atomes A et B, rA et rB sont des rayons covalents de A et B, et
(xA-xB) est la différence d’électronégativité entre A et B.
Une autre méthode est utilisée pour calculer la longueur de liaison approximative. Dans cette méthode, la première structure de Lewis est dessinée pour déterminer le type de liaison covalente. Puis en utilisant un graphique* réalisé sur les études réalisées par Cordero et al., et Pyykkö et Atsumi, les rayons correspondants des liaisons faites par chaque atome sont déterminés. Ensuite, la longueur de liaison est déterminée en prenant la somme des deux rayons. Par exemple, lors de la détermination de la longueur de liaison du dioxyde de carbone, la première structure de Lewis est dessinée.
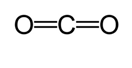
Selon le graphique, le rayon covalent de la double liaison carbone est de 67 picomètres et celui de la double liaison oxygène est de 57 picomètres. Par conséquent, la longueur de liaison du dioxyde de carbone est d’environ 124 picomètres (57 pm + 67 pm).
*Le graphique covalent se trouve ici
Référence :
Cordero, Beatriz, et al. » Rayons covalents revisités. »Transactions Dalton 21 (2008): 2832-2838.
Livrets. « Ordre et longueurs des liaisons. »Livrets de chimie. Livrets, 05 Déc. 2016. Web. 10 Janv. 2017.
Lister, Ted et Janet Renshaw. Comprendre la chimie pour un niveau Avancé. N.p. : Nelson Thornes, 2000. Imprimer.
Pratiyogita Darpan. « Propriétés des Éléments par rapport à leur Structure électronique. » Vision de la science de la concurrence Août. 1998 : n. pag. Imprimer.
Pyykkö, Pekka et Michiko Atsumi. « Rayons Covalents à Double Liaison moléculaire pour les éléments Li-E112. »Chemistry – A European Journal 15.46 (2009): 12770-12779.
![]()