Arènes plus gros
La plupart des arènes qui contiennent un seul cycle à six chaînons sont des liquides volatils, tels que le benzène et les xylènes, bien que certains arènes avec des substituants sur le cycle soient des solides à température ambiante. En phase gazeuse, le moment dipolaire du benzène est nul, mais la présence de substituants électronégatifs ou électropositifs peut entraîner un moment dipolaire net qui augmente les forces d’attraction intermoléculaires et augmente les points de fusion et d’ébullition. Par exemple, le 1,4-dichlorobenzène, un composé utilisé comme alternative au naphtalène dans la production de boules de naphtalène, a un point de fusion de 52,7 ° C, ce qui est considérablement supérieur au point de fusion du benzène (5,5 ° C).
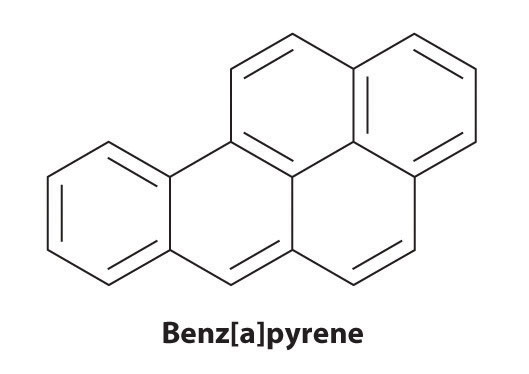
Certains hydrocarbures aromatiques, tels que le benzène et le benzpyrène, sont de puissantes toxines hépatiques et cancérigènes. En 1775, un médecin britannique, Percival Pott, décrit la forte incidence du cancer du scrotum chez les petits garçons utilisés comme ramoneurs et l’attribue à leur exposition à la suie. Ses conclusions étaient correctes: le benzpyrène, un composant de la suie de cheminée, des viandes grillées au charbon de bois et de la fumée de cigarette, était le premier cancérogène chimique identifié.
Bien que les arènes soient généralement tirés avec trois liaisons C =C, le benzène est environ 150 kJ/mol plus stable que ce à quoi on s’attendait s’il contenait trois doubles liaisons. Cette stabilité accrue est due à la délocalisation de la densité électronique π sur tous les atomes du cycle. Comparés aux alcènes, les arènes sont de pauvres nucléophiles. Par conséquent, ils ne subissent pas de réactions d’addition comme les alcènes; au contraire, ils subissent une variété de réactions de substitution aromatique électrophile qui impliquent le remplacement de –H sur l’arène par un groupe –E, tel que –NO2, –SO3H, un halogène ou un groupe alkyle, dans un processus en deux étapes. La première étape consiste à ajouter l’électrophile (E) au système π du benzène, formant un carbocation. Dans la deuxième étape, un proton est perdu du carbone adjacent sur l’anneau :
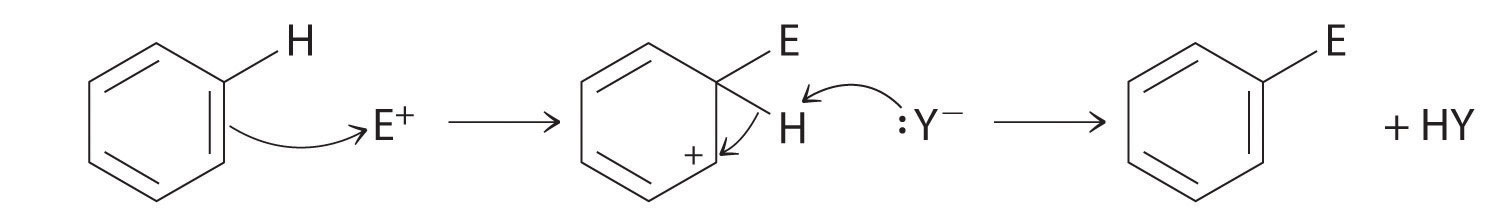
Le carbocation formé dans la première étape est stabilisé par résonance.
Les arènes subissent des réactions de substitution plutôt que d’élimination en raison de la stabilité accrue résultant de la délocalisation de leur densité d’électrons π.
De nombreux arènes substitués ont une activité biologique puissante. Certains exemples incluent des médicaments et des antibiotiques courants tels que l’aspirine et l’ibuprofène, des drogues illicites telles que les amphétamines et le peyotl, l’acide aminé phénylalanine et des hormones telles que l’adrénaline, comme indiqué ci-dessous.
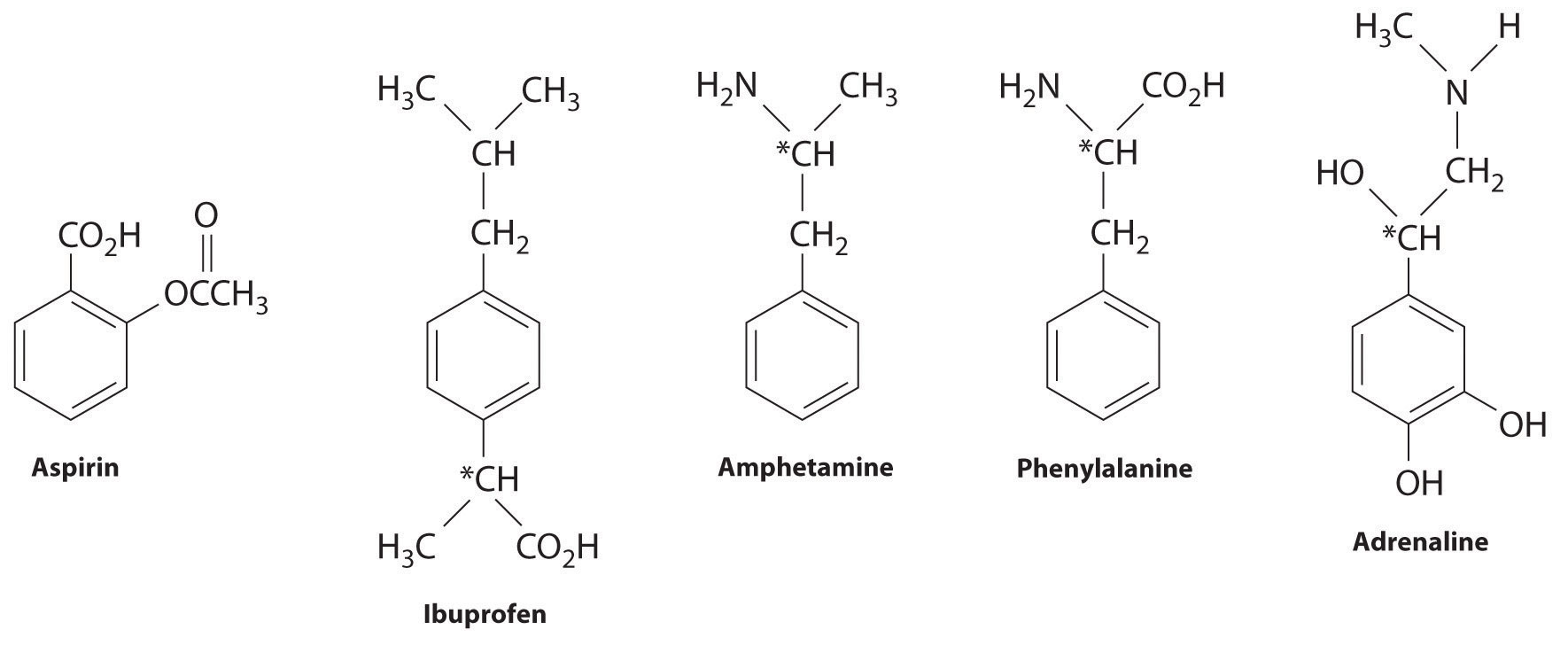
L’aspirine (activité antifever), l’ibuprofène (activité antifever et anti-inflammatoire) et l’amphétamine (stimulant) ont des effets pharmacologiques. La phénylalanine est un acide aminé. L’adrénaline est une hormone qui provoque la réponse ”combat ou fuite » au stress.