Om du någonsin har studerat en periodisk tabell över elementen (se nedan) är du förmodligen redan medveten om att denna tabell avslöjar en hel del om de kemiska egenskaperna hos de atomer som utgör vår värld.
men du kanske inte inser att varje kvadrat på det periodiska bordet faktiskt representerar en familj av isotoper-atomer som delar samma namn och kemiska egenskaper, men har olika massor.
för att förstå vad isotoper är och hur vi kan använda dem måste vi titta närmare på en atoms inre.

byggstenar av materia
en atom består av en otroligt tät kärna (kallad en kärna) av protoner och neutroner, omgiven av ett diffust moln av elektroner.
Du kan tänka på protoner och neutroner som samma typ av partikel med en nyckelskillnad: protonerna är positivt laddade, medan neutroner bär ingen laddning. Detta innebär att protoner kan ”känna” elektriska eller magnetiska fält, medan neutroner inte kan.
elektronerna, som är mycket lättare än protoner eller neutroner, har samma laddningsstorlek som en proton men med motsatt tecken, vilket innebär att varje atom som har lika många protoner och elektroner är elektriskt neutral.
det är elektronerna som bestämmer det kemiska beteendet hos ett visst element.

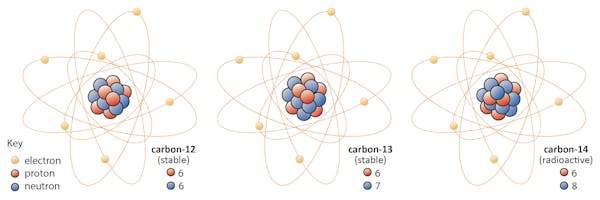
isotoper av ett element delar samma antal protoner men har olika antal neutroner. Låt oss använda kol som ett exempel.
det finns tre isotoper av kol som finns i naturen – kol-12, kol-13 och kol-14. Alla tre har sex protoner, men deras neutronnummer – 6, 7 respektive 8 – skiljer sig åt. Detta innebär att alla tre isotoper har olika atommassor (kol-14 är den tyngsta), men delar samma atomnummer (Z=6).kemiskt är alla tre oskiljbara, eftersom antalet elektroner i var och en av dessa tre isotoper är densamma.
så olika isotoper av samma element är identiska, kemiskt sett. Men vissa isotoper har förmågan att kringgå denna regel genom att helt omvandlas till ett annat element.
marscherar mot stabilitet
denna transformativa förmåga som vissa isotoper har att göra med det faktum att inte alla isotoper är stabila, och är det som ledde Frederick Soddy till hans Nobelprisvinnande upptäckt av isotoper 1913.
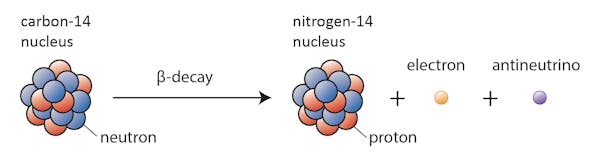
vissa isotoper-som kol-12 – kommer gärna fortsätta att existera som kol om inte något extraordinärt händer. Andra-kol-14, säger – kommer någon gång att förfalla till en stabil isotop i närheten.
i detta fall ändras en av neutronerna i kol-14 till en proton som bildar kväve-14. Under denna process, som kallas betaförfall, avger kärnan strålning i form av en elektron och en antineutrino.
det finns många faktorer som kan orsaka en kärna att förfallna. En av de viktigaste är förhållandet mellan protoner och neutroner som en viss kärna har. Om en kärna har för många neutroner (definitionen av ”för många” beror på hur tung kärnan är) finns det en chans att den kommer att förfallna mot stabilitet.
detsamma gäller om en kärna har för många protoner. Detta är en av anledningarna till att vissa isotoper av ett givet element är radioaktiva, medan andra inte är det.
från Stjärnornas magar
Nu kanske du undrar hur alla dessa isotoper skapades i första hand. Som det visar sig är denna fråga komplex, men ger viss sanning till ordspråket att vi alla är gjorda av stjärnstoft.
några av de lättare isotoperna bildades mycket tidigt i universums historia, under Big Bang. Andra är resultatet av processer som sker inom stjärnor eller som ett resultat av slumpkollisioner mellan mycket energiska kärnor – kända som kosmiska strålar – i vår atmosfär.de flesta naturligt förekommande isotoper är den slutliga (stabila eller långlivade) produkten som härrör från en lång serie kärnreaktioner och sönderfall.
i de flesta av dessa fall har ljuskärnor varit tvungna att krossa tillsammans med tillräckligt med energi för att tillåta den starka kraften – en limliknande bindning som bildas när protoner och neutroner kommer nära nog att röra-för att övervinna den elektromagnetiska kraften – som skjuter protoner ifrån varandra. Om den starka kraften vinner ut, binder de kolliderande kärnorna samman, eller säkring, för att bilda en tyngre kärna.
vår sol är ett bra exempel på detta. En av dess huvudsakliga kraftkällor är en serie fusionsreaktioner och beta-sönderfallsprocesser som omvandlar väte till helium.

omvandla kunskap till Verktyg
sedan början av 1900-talet, när förekomsten av isotoper först realiserades, har kärnfysiker och kemister sökt efter sätt att studera hur isotoper kan bildas, hur de sönderfaller och hur vi kan använda dem.det visar sig att isotopernas natur – deras kemiska enhetlighet, deras nukleära särskiljningsförmåga – gör dem användbara för ett brett spektrum av tillämpningar inom så olika områden som medicin, arkeologi, jordbruk, kraftproduktion och gruvdrift.
Om du någonsin har haft en PET-skanning har du gynnats av en biprodukt av radioaktivt sönderfall av vissa isotoper (ofta kallade medicinska isotoper). Vi producerar dessa medicinska isotoper med hjälp av vår kunskap om hur kärnreaktioner fortsätter, med hjälp av kärnreaktorer eller acceleratorer som kallas cyklotroner.
men vi har också hittat sätt att använda sig av naturligt förekommande radioaktiva isotoper. Kol dejting, till exempel, använder sig av den långlivade isotopkol-14 för att bestämma hur gamla föremål är.
under normala omständigheter produceras kol – 14 i vår atmosfär via kosmiska strålreaktioner med kväve-14. Den har en halveringstid på cirka 5 700 år, vilket innebär att hälften av en mängd kol-14 kommer att ha förfallit bort under den tidsperioden.

medan en biologisk organism lever, tar den ungefär en kol-14-isotop för varje biljon stabil kol-12-isotoper och kol-12 till kol-14-förhållandet förblir ungefär detsamma medan organismen lever. När det dör, stannar nytt intag av kol.
detta betyder förhållandet mellan kol – 14 och kol-12 förändringar i resterna av denna organism över tiden.
om vi extraherar kol med kemiska metoder från ett prov kan vi sedan tillämpa en metod som kallas accelerator mass spectrometry (AMS) för att separera de enskilda kolisotoper efter vikt.
AMS använder sig av det faktum att accelererade partiklar med samma laddning men olika massor följer separata vägar genom magnetfält. Genom att använda dessa separata vägar, vi kan bestämma isotopförhållanden med otrolig noggrannhet.
som du kan se från dessa exempel tillämpar vi vår kunskap om isotoper på olika sätt. Vi producerar dem, upptäcker dem, extraherar dem och studerar dem med det dubbla syftet att förstå varför atomkärnan beter sig som den gör och hur vi kan utnyttja dess kraft till vår fördel.