El metabolismo celular normal depende del mantenimiento del pH de la sangre dentro de límites muy estrechos (7,35-7,45).
Incluso las excursiones relativamente leves fuera de este rango de pH normal pueden tener efectos nocivos, incluida la reducción del suministro de oxígeno a los tejidos, las disturbancias electrolíticas y los cambios en la contractilidad del músculo cardíaco; la supervivencia es precaria si el pH de la sangre cae por debajo de 6,8 o aumenta por encima de 7,8.
El problema para el cuerpo es que el metabolismo normal está asociado con la producción continua de iones de hidrógeno (H+) y dióxido de carbono(CO2), que tienden a reducir el pH. El mecanismo que supera este problema y sirve para mantener el pH normal de la sangre(es decir, preservar la homeostasis ácido-base) es una sinergia compleja de acción que involucra tampones químicos en la sangre, los glóbulos rojos(eritrocitos), que circulan en la sangre, y la función de tres órganos: pulmones, riñones y cerebro.
Antes de explicar cómo estos cinco elementos contribuyen al mantenimiento general del pH sanguíneo, sería útil revisar rápidamente algunos conceptos básicos.
- ¿Qué es un ácido, qué es una base y qué es el pH?
- ¿Qué es un tampón? – el sistema tampón de bicarbonato
- Función pulmonar, transporte de CO2 y equilibrio ácido-base
- Riñones y equilibrio ácido-base
- ALTERACIONES DEL EQUILIBRIO ÁCIDO-BASE
- Causas de alteraciones ácido-base
- Acidosis respiratoria: (pCO2(a) elevado,pH reducido)
- Alcalosis respiratoria – (reducción de CO2(a), aumento del pH)
- Acidosis metabólica– (disminución de Hco3 -, pH disminuido)
- Alcalosis metabólica – (aumento de Hco3– , aumento del pH)
- Compensación: una consecuencia de la disturbancia ácida
- Alteraciones mixtas ácido-base
- Resumen
- Algunos sugirieron leer más
¿Qué es un ácido, qué es una base y qué es el pH?
Un ácido es una sustancia que libera iones hidrogenados (H+) al disociarse en solución.
Por ejemplo: Ácido clorhídrico (HCl) se disocia a hidrogeniones e iones cloruro
HCl ![]() H+ + Cl-
H+ + Cl-
Ácido carbónico (H2CO3) se disocia a iones hidrogenados e iones bicarbonato
H2CO3 ![]() H+ +HCO3–
H+ +HCO3–
Distinguimos entre ácidos fuertes como el ácido clorhídrico y ácidos débiles como el ácido carbónico. La diferencia es que los ácidos fuertes se asocian más que los ácidos débiles. En consecuencia, la ionconcentración de hidrógeno de un ácido fuerte es mucho mayor que la de un ácido débil.
Una base es una sustancia que en solución acepta iones hidrogenados.
Por ejemplo, el bicarbonato base (HCO3–)acepta iones de hidrógeno para formar ácido carbónico:
HCO3– + H+ ![]() H2CO3
H2CO3
pH es una escala de 0-14 de acidez y alcalinidad. El agua pura tiene un pH de 7 y es neutra (ni ácida ni alcalina). pH por encima de 7 es alcalino y por debajo de 7 ácido. Por lo tanto, el pH de la sangre (7,35-7,45) es ligeramente alcalino, aunque en medicina clínica el término alcalosis se reserva, quizás de manera confusa, para un pH de sangre superior a 7.45y el término acidosis se reserva para el pH de la sangre inferior a 7,35.
El pH es una medida de la concentración de iones de hidrógeno (H+).Los dos están relacionados de acuerdo con la siguiente ecuación:
pH = – log10
donde está la concentración de iones de hidrógeno inmoles por litro (mol/L)
De esta ecuación
pH 7.4 = H+ concentración de 40 nmol/L
pH 7.0 = H+ concentración de 100 nmol/L
pH 6.0 = H+ concentración de 1000 nmol/L
Está claro que:
- los dos parámetros cambian inversamente; a medida que aumenta la concentración de iones de hidrógeno, el pH cae
- debido a la relación logarítmica, un gran cambio en la concentración de iones de hidrógeno es en realidad un pequeño cambio en el pH. Por ejemplo, duplicar la concentración de iones de hidrógeno hace que el pH caiga solo en 0.3
¿Qué es un tampón? – el sistema tampón de bicarbonato
Los tampones son sustancias químicas en solución que minimizan el cambio de pH que se produce cuando se añaden ácidos mediante la «limpieza» de iones de hidrógeno. Un tampón es una solución de un ácido débil y su base conjugada. En la sangre, el sistema tampón principal es el ácido débil, ácido carbónico (H2CO3) y su base conjugada, bicarbonato (HCO3–). Para explicar cómo este sistema minimiza los cambios en el pH, supongamos que agregamos un ácido fuerte, por ejemplo, HCl, al tampón de bicarbonato:
El ácido se disociará, liberando iones de hidrógeno:
HCl ![]() H + + Cl –
H + + Cl –
El tampón de bicarbonato luego «absorbe» los iones de hidrógeno, formando ácido carbónico en el proceso:
HCO3– + H+ ![]() H2CO3 (ácido carbónico)
H2CO3 (ácido carbónico)
El punto importante es que debido a que los iones de hidrógeno de HCl se han incorporado al ácido carbónico débil, que no se disocian con tanta facilidad, el número total de iones de hidrógeno en solución y, por lo tanto, el pH no cambia tanto como se habría producido en ausencia del tampón.
Aunque un tampón minimiza en gran medida el cambio de forma, no lo elimina porque incluso un ácido débil (como el ácido carbónico) se disocia en cierta medida. El pH de una solución tampón es una función de las concentraciones relativas del ácido débil y su base conjugada.
pH = 6,1 + log ( /)
Donde = concentración de bicarbonato
= concentración de ácido carbónico
Esta relación, conocida como la ecuación de Henderson-Hasselbalch,muestra que el pH se rige por la relación entre la concentración de base(HCO3–) y la concentración de ácido(H2CO3).
A medida que se agregan iones de hidrógeno al tampón de bicarbonato:
H+ +HCO3– ![]() H2CO3
H2CO3
se consume bicarbonato (base) (disminuye la concentración) y se produce ácido carbónico (aumenta la concentración). Si se siguen agregando hidrogeniones, todo el bicarbonato eventualmente se absorberá (convertido en ácido carbónico) y se produciría un efecto de nobuffering: el pH caería bruscamente si se añadiera más ácido.
Sin embargo, si el ácido carbónico se pudiera eliminar continuamente del sistema y el bicarbonato se regenerara constantemente, entonces la capacidad de amortiguación y, por lo tanto, el pH se podría mantener a pesar de la adición continua de iones de hidrógeno.
Como se verá con más detalle de la fisiología del equilibrio ácido-base, es decir, en efecto, lo que sucede en el cuerpo. En efecto, los pulmones aseguran la eliminación del ácido carbónico (como dióxido de carbono) y los riñones aseguran la regeneración continua del bicarbonato.
Este papel de los pulmones depende de una característica singular del sistema tampón de bicarbonato y de la capacidad del ácido carbónico para convertirse en dióxido de carbono y agua.
La siguiente ecuación describe la relación de allelements del sistema tampón bicarbonato, ya que opera en thebody
H+ +HCO3– ![]() H2CO3
H2CO3 ![]() H2O + CO2
H2O + CO2
es importante tener en cuenta que las reacciones son reversibles.La dirección depende de la concentración relativa de cada elemento. De modo que, por ejemplo, un aumento del dióxido de carbono fuerza la reacción a la izquierda con una mayor formación de ácido carbónico y, en última instancia, de iones de hidrógeno.
Esto explica el potencial ácido del dióxido de carbono y nos lleva a la importante contribución que los pulmones y los glóbulos rojos hacen al equilibrio general de base ácida.
Función pulmonar, transporte de CO2 y equilibrio ácido-base
Una cantidad constante de CO2 en sangre, esencial para el equilibrio normal ácido-base, refleja un equilibrio entre el producido como resultado del metabolismo de las células tisulares y el excretado por el aire comprimido de los pulmones.Al variar la velocidad a la que se elimina el dióxido de carbono, los pulmones regulan el contenido de dióxido de carbono de la sangre.La secuencia de eventos desde la producción de dióxido de carbono en los tejidos hasta su eliminación en el aire espirado se describe en la Fig. 1.El dióxido de carbono se difunde de las células tisulares a la sangre capilar circundante (Fig. 1a). Una pequeña proporción se disuelve en el plasma sanguíneo y se transporta sin cambios a los pulmones.
Pero la mayoría se difunde en glóbulos rojos donde se combina con agua para formar ácido carbónico.El ácido se disocia con la producción de iones de hidrógeno y bicarbonato. Los iones de hidrógeno se combinan con la hemoglobina desoxigenada(la hemoglobina actúa como un tampón aquí), evitando una caída peligrosa en el pH celular, y el bicarbonato se difunde a lo largo de una concentración de radiación de los glóbulos rojos al plasma.
Por lo tanto, la mayor parte del dioxidocarbónico producido en los tejidos se transporta a los pulmones en forma de plasma sanguíneo de bicarbonateína.
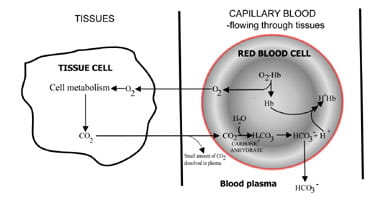
Fig. 1a. CO2 producido en tejidos convertidos en bicarbonato para su transporte a los pulmones.
|
|
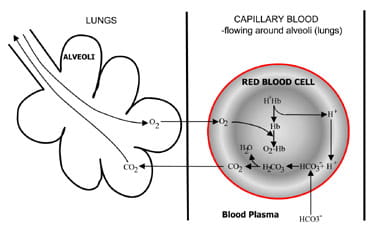
Fig. 1b. At the lungs bicarbonate convertedback to CO2 and eliminated by the lungs.
En los alvéolos pulmonares el proceso se invierte (Fig. 1b).Los iones de hidrógeno se desplazan de la hemoglobina a medida que absorbe el oxígeno del aire inspirado. Los iones de hidrógeno ahora son amortiguados por un bicarbonato que se difunde desde el plasma de vuelta a los glóbulos rojos, y se forma ácido carbónico. A medida que aumenta la concentración, se convierte en agua y dióxido de carbono. Finalmente, el dióxido de carbono desciende por un gradiente de concentración de glóbulos rojos a alvéolos para la extracción en aire espirado.
Los quimiorreceptores respiratorios en el tronco encefálico responden a los cambios en la concentración de dióxido de carbono en la sangre, lo que provoca una mayor ventilación (respiración) si la concentración de dióxido de carbono aumenta y una ventilación más reducida si el dióxido de carbono cae.
Riñones y equilibrio ácido-base
El metabolismo celular normal resulta en la producción continua de iones de hidrógeno. Hemos visto que al combinarse con estos iones de hidrógeno, el tampón de bicarbonato en la sangre minimiza su efecto. Sin embargo,el almacenamiento en búfer solo es útil a corto plazo, y en última instancia, los iones de hidrógeno deben eliminarse del cuerpo.Además, es importante que el bicarbonato que se utiliza para los iones de hidrógeno del búfer se reemplace continuamente.
Estas dos tareas, la eliminación de iones de hidrógeno y la regeneración de bicarbonato, son realizadas por los riñones. Las células del túbulo renal son ricas en laenzima anhidrasa carbónica, que facilita la formación de ácido carbónico a partir de dióxido de carbono y agua. El ácido carbónico disocia el tobicarbonato y los iones de hidrógeno. El bicarbonato se reabsorbe en la sangre y los iones de hidrógeno pasan a la luz del túbulo y se eliminan del cuerpo en la orina.
Esta eliminación urinaria depende de la presencia en la orina de tampones, iones principalifosfato y amoníaco.
ALTERACIONES DEL EQUILIBRIO ÁCIDO-BASE
La mayoría de las alteraciones ácido-base son el resultado de
- enfermedad o daño a órganos (riñón, pulmones, cerebro) cuya función normal es necesaria para la homeostasis ácido-base,
- enfermedad que causa un aumento anormal de la producción de ácidos metabólicos de tal manera que los mecanismos homeostáticos se ven desbordados
- intervención médica (p. ej. ventilación mecánica, algunos medicamentos)
La gasometría arterial es el análisis de sangre que se utiliza para identificar y controlar las alteraciones ácido-base. Tres parámetros medidos durante el análisis de gases sanguíneos, el pH de la sangre arterial (pH), la presión parcial de dióxido de carbono en la sangre arterial (pCO2(a)) y la concentración de bicarbonato (HCO3–) son de importancia crucial (véase el cuadro I para el rango de referencia (normal)).Los resultados de estas tres permiten clasificar la disturbancia ácida en una de las cuatro categorías etiológicas:
- Respiratory acidosis
- Respiratory alkalosis
- Metabolic acidosis
- Metabolic alkalosis
|
Adults |
Neonates |
|
|
pH |
7.35-7.45 |
7.30-7.40 |
|
pCO2 (kPa) |
4.7-6.0 |
3.5-5.4 |
|
Bicarbonate |
22-28 |
15-25 |
TABLE I. Rangos de referencia aproximados (normales)
Para comprender cómo se utilizan los resultados de pH, pCO2(a)y bicarbonato para clasificar las perturbaciones ácido-base de esta manera, debemos volver a la ecuación de Henderson-Hasselbalch
pH = 6.1 + log (/ )
Medimos el pH y el bicarbonato, pero no el ácido carbónico(H2CO3). Sin embargo, existe una relación entre pCO2 (a) y H2CO3 que permite la reformulación de la ecuación de Henderson-Hasselbalch entre los tres parámetros(pH, pCO2 (a) y bicarbonato) medidos durante el análisis de gases sanguíneos:
pH = 6,1 + log (/(pCO2 (a) × 0.23))
Al eliminar todas las constantes de esta ecuación, la relación entre los tres parámetros medidos puede ser más simplificada:
pH pH / pCO2(a)
Esta relación, crucial para comprender todo lo que sigue en relación con las perturbaciones de la base ácida, establece que el pH arterial de la sangre es proporcional a la relación de concentración de bicarbonato con pCO2(a). Permite las siguientes reducciones:
- El pH permanece normal siempre que la relación : pCO2(a) permanece normal
- El pH aumenta (es decir, se produce alcalosis) si aumenta o disminuye la pCO2(a).
- Disminución del pH (p. ej. se produce acidosis) si disminuye o aumenta la pCO2(a)
- Si ambos pCO2(a) y se incrementan en relativamente la misma cantidad, la relación y, por lo tanto, el pH son normales
- Si ambos pCO2(a) y se disminuyen en relativamente la misma cantidad, la relación y, por lo tanto, el pH son normales.
Las alteraciones ácido-base afectan principalmente a eitherpCO2 (a), en cuyo caso se denomina perturbación respiratoria, o, en cuyo caso, se denomina disturbancia no respiratoria o metabólica:
- Si la alteración primaria es una pCO2(a) elevada (que causa acidosis – véase más arriba), la afección se denomina acidosis respiratoria
- Si la alteración primaria es una pCO2(a) reducida (que causa alcalosis – véase más arriba), la afección se denomina alcalosis respiratoria
- Si la alteración primaria se asocia con una reducción del bicarbonato (que da lugar a acidosis – véase más arriba), la afección se denomina acidosis metabólica
- Si la alteración primaria se asocia con una reducción del bicarbonato (que da lugar a acidosis – véase más arriba), la afección se denomina acidosis metabólica
- Si la alteración primaria asociada con bicarbonato elevado (que resulta en alcalosis, consulte más arriba), la afección se denomina alcalosis metabólica
Causas de alteraciones ácido-base
Acidosis respiratoria: (pCO2(a) elevado,pH reducido)
La acidosis respiratoria se caracteriza por un aumento de la pCO2(a) debido a una ventilación alveolar inadecuada(hipoventilación) y la consiguiente eliminación reducida de CO2 de la sangre. Las enfermedades respiratorias, como la neumononeumonía, el enfisema, el asma y la enfermedad por vías respiratorias obstructivas crónicas, pueden estar asociadas con hipoventilación suficiente para provocar acidosis respiratoria.
Algunos medicamentos (p. ej. morfina y antibióticos) pueden causar acidosis respiratoria al deprimir el centro respiratorio en el cerebro. Los daños o traumatismos en la pared torácica y la musculatura involucrada en la mecánica de la respiración pueden reducir la velocidad de ventilación. Esto explica la acidosis respiratoria que puede complicar el curso de enfermedades como la poliomielitis,el síndrome de Guillain-Barré y la recuperación de un trauma torácico grave.
Alcalosis respiratoria – (reducción de CO2(a), aumento del pH)
Por el contrario, la alcalosis respiratoria se caracteriza por una disminución de CO2 (a) debido a la ventilación alveolar excesiva y la eliminación excesiva de CO2 de la sangre.Una enfermedad en la que, debido a la reducción del oxígeno en la sangre (hipoxemia), se estimula el centro respiratorio puede provocar alcalosis respiratoria.
Los ejemplos aquí incluyen anemia severa, embolismo pulmonar y síndrome respiratorio del adulto. La hiperventilación suficiente para provocar alcalosis respiratoria puede ser una característica de los ataques de ansiedad y responder al dolor intenso. Una de las propiedades menos bienvenidas del salicilato (aspirina) es su efecto estimulante en el centro respiratorio. Este efecto explica la alcalosis respiratoria que se produce después de una sobredosis de salicilato. Por último, la ventilación mecánica demasiado entusiasta puede causar alcalosis respiratoria.
Acidosis metabólica– (disminución de Hco3 -, pH disminuido)
La reducción del bicarbonato es siempre una característica de la acidosis metabólica. Esto ocurre por una de dos razones: mayor uso de bicarbonato para amortiguar una carga de ácido anormal o mayor pérdida de bicarbonato del cuerpo. La cetoacidosis diabética y la acidosis láctica son dos afecciones caracterizadas por la sobreproducción de ácidos metabólicos y el consiguiente agotamiento del bicarbonato.
En el primer caso, las concentraciones sanguíneas anormalmente altas de cetácidos(ácido b-hidroxibutírico y ácido acetoacético) reflejan los diversos trastornos metabólicos que resultan de la deficiencia de insulina.
Todas las células producen ácido láctico si tienen deficiencia de oxígeno,por lo que el aumento de la producción de ácido láctico y la resultante acidosis metabólica se producen en cualquier condición en la que el suministro de oxígeno a los tejidos está gravemente comprometido.
Los ejemplos incluyen paro cardiaco y cualquier afección asociada con shock hipovolémico (por ejemplo, pérdida masiva de fluidos). El hígado juega un papel importante en la eliminación de la pequeña cantidad de ácido láctico que se produce durante el metabolismo celular normal, de modo que la acidosis láctica puede ser una característica de la falla hepática.
La pérdida anormal de bicarbonato del cuerpo puede ocurrir durante la diarrea grave. Si no se controla, esto puede provocar acidosis metabólica.La falta de regeneración de bicarbonato y excreción de iones de hidrógeno explica la acidosis metabólica que se produce en la falla renal.
Alcalosis metabólica – (aumento de Hco3– , aumento del pH)
El bicarbonato siempre se eleva en la alcalosis metabólica. En raras ocasiones, la administración excesiva de bicarbonato o la ingestión de preparados antiácidos de bicarbonateína puede causar alcalosis metabólica, pero esto suele ser transitorio. La pérdida anormal de iones de hidrógeno del cuerpo puede ser el principal problema. El bicarbonato, que de otro modo sería absorbido en la amortiguación de estos iones de hidrógeno perdidos, se acumula en la sangre. El jugo gástrico es ácido y la gastricaspiración o cualquier proceso de enfermedad en el que el contenido gástrico se pierde del cuerpo representa una pérdida de iones de hidrógeno.
El vómito punzante de jugo gástrico, por ejemplo, explica la alcalosis metabólica que puede ocurrir en pacientes con tenosis pilórica. La depleción severa de potasio puede causar alcalosis metabólicosdebido a la relación recíproca entre hidrógeno y potasio.
Compensación: una consecuencia de la disturbancia ácida
Es vital para la vida que el pH no se aleje demasiado de lo normal,y el cuerpo siempre intentará devolver un pH anormal hacia lo normal cuando se perturbe el equilibrio ácido-base. La compensación es el nombre dado a este proceso de preservación de la vida. Para entender la compensación, es importante recordar que el pH se rige por la relación : pCO2(a).Mientras la relación sea normal, el pH será normal.
Considere al paciente con acidosis metabólica cuyo pH es bajo porque el bicarbonato es bajo. Para compensar por lo bajo y restaurar la proporción importante hacia lo normal, el paciente debe bajar hispCO2(a). Los quimiorreceptores en el centro respiratorio del cerebro responden a una concentración creciente de iones de hidrógeno(pH bajo), causando un aumento de la ventilación (hiperventilación) y, por lo tanto, una mayor eliminación de dióxido de carbono; el CO2(a) cae y la relación : pCO2(a) regresa a la normalidad.
Compensación por alcalosis metabólica en la que es alta, por el contrario, implica depresión de la respiración y, por lo tanto, retención de dióxido de carbono para que la pCO2(a) se eleve para igualar el aumento en . Sin embargo, la depresión de la respiración tiene el efecto secundario no deseado de amenazar la oxigenación adecuada de los tejidos. Por esta razón, la compensación respiratoria de la alcalosis metabólica es limitada.
Las alteraciones primarias de la pCO2 (a) (acidosis respiratoria y alcalosis) se compensan mediante ajustes renales de excreción de iones de hidrógeno que dan lugar a cambios que compensan adecuadamente el cambio primario de la pCO2 (a). Por lo tanto, la compensación renal para la acidosis respiratoria (pCO2 elevado(a)) implica una mayor reabsorción de bicarbonato, y la compensación renal para la alcalosis respiratoria(pCO2 reducido(a)) implica una absorción reducida de bicarbonatos.
El concepto de equilibrio ácido-base durante la compensación se transmite visualmente en la Fig. 2. La tabla II resume los resultados de los gases sanguíneos que caracterizan a las cuatro perturbaciones ácido-base antes y después de la compensación.
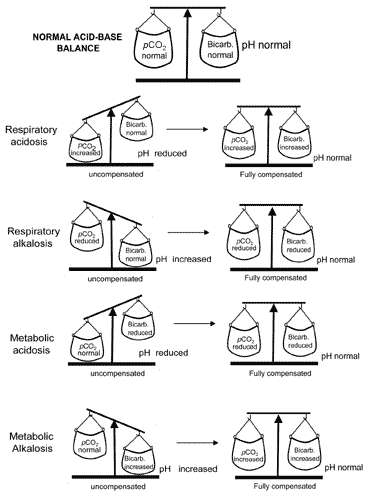
Fig. 2. El «equilibrio ácido-base» : compensationrestores normal pH
|
Primary disturbance |
||||
|
Respiratory |
Repiratory |
Metabolic |
Metabolic |
|
|
Some |
Emphysema |
Hyper- |
Renal failure |
Bicarbonate Potassium |
|
Compen- |
RENAL |
RENAL |
RESPIRA- |
RESPIRA- |
|
Initial blood |
pH |
pH |
pH |
pH |
|
Blood gas |
pH pCO2 |
pH pCO2 |
pH pCO2 |
Limitada |
|
Blood gas |
pH normal |
pH normal |
pH normal |
Limited |
Versión de tabla fácil de imprimir, pdf.
TABLA II. La gasometría sanguínea produce alteraciones del equilibrio ácido-base
La compensación respiratoria para una perturbación metabólica primaria ocurre mucho más rápidamente que la compensación metabólica (renal) para una perturbación respiratoria primaria. En el segundo caso, la compensación se produce en días y no en horas.
Si la compensación da lugar a un retorno del pH a la normalidad, se dice que el paciente está totalmente compensado. Pero en muchos casos, la compensación vuelve a la normalidad sin lograr realmente la normalidad; en tales casos, se dice que el paciente está parcialmente compensado.
Por las razones descritas anteriormente, la alcalosis metabólica rara vez se compensa por completo.
Alteraciones mixtas ácido-base
De la discusión anterior se podría suponer que todos los pacientes con alteraciones ácido-base sufren solamente de una de las cuatro categorías de equilibrio ácido-base. Este puede ser el caso, pero en circunstancias particulares los pacientes pueden presentar más de una perturbación.
Por ejemplo, considere al paciente con una enfermedad crónica del pulmón, como el enfisema, que tiene una acidosis respiratoria parcialmente compensada de larga data. Si este paciente también fuera adiabético que no había tomado su dosis normal de insulina y, como resultado, estaba en un estado de cetoacidosis diabética, los resultados de los gases sanguíneos reflejarían el efecto combinado de la acidosis respiratoria y la acidosis metabólica.
Estas alteraciones mixtas ácido-base no son infrecuentes y pueden ser difíciles de desentrañar basándose únicamente en los resultados arteriales de los gases sanguíneos.
Resumen
El mantenimiento de un pH sanguíneo normal involucra varios sistemas de órganos y depende de la integridad circulatoria. No es sorprendente que la alteración del equilibrio ácido-base pueda complicar el curso de enfermedades muy diversas, así como traumatismos en muchas partes del cuerpo. El cuerpo tiene un poder considerable para preservar el pH de la sangre, y las disturbancias generalmente implican una enfermedad crónica grave o una enfermedad crítica aguda.
Los resultados del análisis de gasometría arterial pueden identificar alteraciones ácido–base y proporcionar información valiosa sobre su causa.
Algunos sugirieron leer más
- Thomson WST, Adams JF, Cowan RA. Equilibrio ácido-base clínico. Oxford: Oxford Medical Publications 1997
- Harrison RA. Equilibrio ácido-base. Respir Care Clin N. America 1995; 1,1: 7-21
- Woodrow P. Análisis de gasometría arterial. Nursing Standard 2004; 18,21: 45-52
- Sirker AA, Rhodes A, Gounds RM, Bennet ED. Fisiología ácido-base: el enfoque «tradicional» y «moderno». Anaesthesia 2002; 57: 348-56