Debido a que se eliminan la mayoría de los iones hidróxido nuevos, el pH no aumenta mucho.
Eliminación de los iones hidróxido reaccionando con iones de hidrógeno
Recuerde que hay algunos iones de hidrógeno presentes de la ionización del ácido etanoico.
![]()
![]()
iones de Hidróxido puede combinar con estos para hacer que el agua. Tan pronto como esto sucede, los consejos de equilibrio para reemplazarlos. Esto sigue sucediendo hasta que se eliminan la mayoría de los iones hidróxido.
![]()
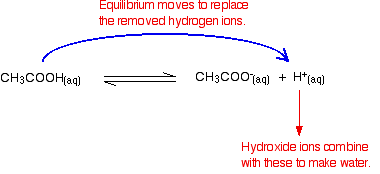
de Nuevo, porque tienen equilibrios involucrados, no todos los iones de hidróxido quitado sólo la mayoría de ellos. El agua que se forma se ioniza en muy poca medida para dar unos pocos iones de hidrógeno e iones de hidróxido.
Soluciones tampón alcalinas
Tomaremos una mezcla de amoníaco y soluciones de cloruro de amonio como típico.
El amoníaco es una base débil, y la posición de este equilibrio estará bien a la izquierda:
![]()
![]()
Agregar cloruro de amonio a esto agrega muchos iones de amonio adicionales. De acuerdo con el Principio de Le Chatelier, eso inclinará la posición del equilibrio aún más a la izquierda.
Por lo tanto, la solución contendrá estas cosas importantes:
-
mucho amoníaco sin reaccionar;
-
muchos iones de amonio del cloruro de amonio;
-
suficientes iones de hidróxido para hacer que la solución sea alcalina.
Otras cosas (como el agua y los iones cloruro) que están presentes no son importantes para el argumento.
Agregar un ácido a esta solución tampón
Hay dos procesos que pueden eliminar los iones de hidrógeno que está agregando.
Eliminación por reacción con amoníaco
La sustancia básica más probable con la que un ion de hidrógeno va a chocar es una molécula de amoníaco. Reaccionarán para formar iones de amonio.
![]()
![]()
la Mayoría, pero no todos, de los iones de hidrógeno será eliminado. El ion amonio es débilmente ácido, por lo que algunos de los iones de hidrógeno se liberarán de nuevo.
Eliminación de los iones de hidrógeno reaccionando con iones de hidróxido
Recuerde que hay algunos iones de hidróxido presentes de la reacción entre el amoníaco y el agua.
![]()
![]()
los iones de Hidrógeno se puede combinar con estos iones de hidróxido para formar agua. Tan pronto como esto sucede, el equilibrio se inclina para reemplazar los iones hidróxido. Esto sigue sucediendo hasta que se eliminan la mayoría de los iones de hidrógeno.
![]()
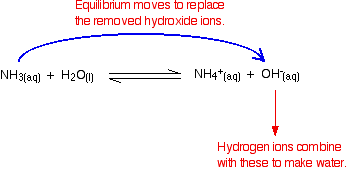
De nuevo, debido a que tiene equilibrios involucrados, no se eliminan todos los iones de hidrógeno, solo la mayoría de ellos.
Añadiendo un álcali a esta solución tampón
Los iones hidróxido del álcali se eliminan mediante una reacción simple con iones de amonio.
![]()
![]()
Debido a que el amoníaco formado es una base débil, puede reaccionar con el agua, por lo que la reacción es ligeramente reversible. Esto significa que, de nuevo, la mayoría (pero no todos) de los iones hidróxido se eliminan de la solución.
Cálculos que involucran soluciones de búfer
Esta es solo una breve introducción. Hay más ejemplos, incluidas varias variaciones, de más de 10 páginas en mi libro de cálculos de química.
Soluciones tampón ácidas
Esto es más fácil de ver con un ejemplo específico. Recuerde que un tampón ácido se puede hacer a partir de un ácido débil y una de sus sales.
Supongamos que tiene una solución tampón que contiene 0,10 mol dm – 3 de ácido etanoico y 0.20 mol dm-3 de etanoato de sodio. ¿Cómo se calcula su pH?
En cualquier solución que contenga un ácido débil, hay un equilibrio entre el ácido no ionizado y sus iones. Por lo tanto, para el ácido etanoico, tiene el equilibrio:
![]()
![]()
La presencia de iones etanoato del etanoato de sodio habrá movido el equilibrio a la izquierda, pero el equilibrio todavía existe.
Eso significa que puede escribir la constante de equilibrio, Ka, para ella:
![]()
![]()
Cuando haya realizado cálculos utilizando esta ecuación previamente con un ácido débil, habrá asumido que las concentraciones de los iones de hidrógeno y los iones de etanoato eran las mismas. Cada molécula de ácido etanoico que se divide da uno de cada tipo de ion.
Eso ya no es cierto para una solución tampón:
![]()
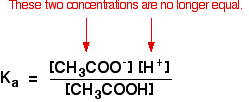
Si el equilibrio se ha empujado aún más hacia la izquierda, el número de iones de etanoato procedentes del ácido etanoico será completamente insignificante en comparación con los del etanoato de sodio.
Por lo tanto, asumimos que la concentración de iones de etanoato es la misma que la concentración de etanoato de sodio, en este caso, 0,20 mol dm – 3.
En un cálculo de ácido débil, normalmente asumimos que tan poco del ácido se ha ionizado que la concentración del ácido en equilibrio es la misma que la concentración del ácido que usamos. Esto es aún más cierto ahora que el equilibrio se ha movido aún más a la izquierda.
Así que las suposiciones que hacemos para una solución tampón son:
![]()
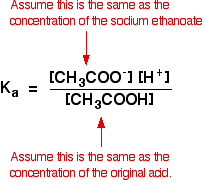
Ahora, si conocemos el valor de Ka, podemos calcular la concentración de iones de hidrógeno y, por lo tanto, el pH.
Ka para ácido etanoico es 1.74 x 10-5 mol dm-3.
Recuerde que queremos calcular el pH de una solución tampón que contenga 0,10 mol dm-3 de ácido etanoico y 0,20 mol dm-3 de etanoato de sodio.
![]()
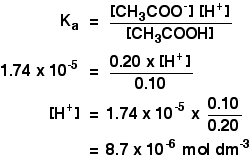
Entonces todo lo que tiene que hacer es encontrar el pH usando la expresión
pH = -log10
Usted todavía tendrá el valor de la concentración de iones de hidrógeno en su calculadora, así que presione el botón de registro e ignore el signo negativo (para permitir el signo menos en la expresión de pH).
Debería obtener una respuesta de 5,1 a dos cifras significativas. No puede ser más preciso que esto, porque sus concentraciones solo se dieron a dos cifras.