¿Cuánta energía se libera en la hidrólisis de ATP?
Modo de lector
El ATP se conoce a menudo como la moneda de energía de la célula. Cientos de reacciones en la célula, desde transformaciones metabólicas hasta eventos de señalización, se acoplan a la hidrólisis (literalmente, «aflojamiento de agua») de ATP por agua . La reacción ATP + H2O <> ADP + Pi transforma el trifosfato de adenosina (ATP) en difosfato de adenosina (ADP) y fosfato inorgánico (Pi). El cambio de energía libre asociado con esta reacción impulsa una gran fracción de reacciones celulares con el potencial de membrana y la reducción de potencia siendo las otras dos fuentes de energía dominantes. Pero, ¿cuánto vale exactamente esta moneda energética y qué revela sobre las transacciones químicas que se pueden comprar? Por supuesto, no hay una respuesta única a esta pregunta, ya que la cantidad de energía liberada por esta reacción de hidrólisis depende de las condiciones intracelulares, pero es posible hacerse una idea del «valor» aproximado de esta moneda recurriendo a algunas estimaciones simples.

Figura 1: La relación de la energía libre de Gibbs de la hidrólisis de ATP en condiciones estándar con la constante de equilibrio, y la relación de la energía libre de hidrólisis en condiciones fisiológicas con las concentraciones de reactivos fisiológicos.
El cambio de energía libre de Gibbs (ΔG) debido a la hidrólisis de ATP depende de las concentraciones de los diversos participantes en la reacción, como se muestra en la Figura 1. Cuando las concentraciones están más lejos de sus valores de equilibrio, el valor absoluto de ΔG es mayor. En condiciones «estándar» (p. ej. concentraciones de 1 M para todos los reactivos, excepto el agua, que se toma a su concentración característica de 55 M) la energía libre de Gibbs de la hidrólisis de ATP varía de -28 a -34 kJ / mol (es decir, ≈12 kBT, BNID 101989) dependiendo de la concentración del catión Mg2+. La dependencia de los iones Mg se produce porque los iones de magnesio cargados positivamente ayudan a estabilizar la molécula de ATP. Sin embargo, en la celda las condiciones nunca están ni siquiera cerca de los valores de estado estándar. Por ejemplo, una concentración de 1M de ATP significaría que la masa de soluto sería similar a la del solvente de agua en sí. En la figura 1 mostramos la derivación a menudo confusa de la energía libre fisiológica (ΔG) dada la relación de concentraciones del valor estándar (ΔGo). La división por términos como los que se requieren para cuidar de las unidades como un logaritmo siempre debe contener un término sin unidades. A veces es sorprendente pensar que si la célula estuviera en equilibrio, el valor de ΔG habría sido cero, y no habría energía para ganar por hidrólisis de ATP. Afortunadamente, este nunca es el caso en los organismos vivos. .
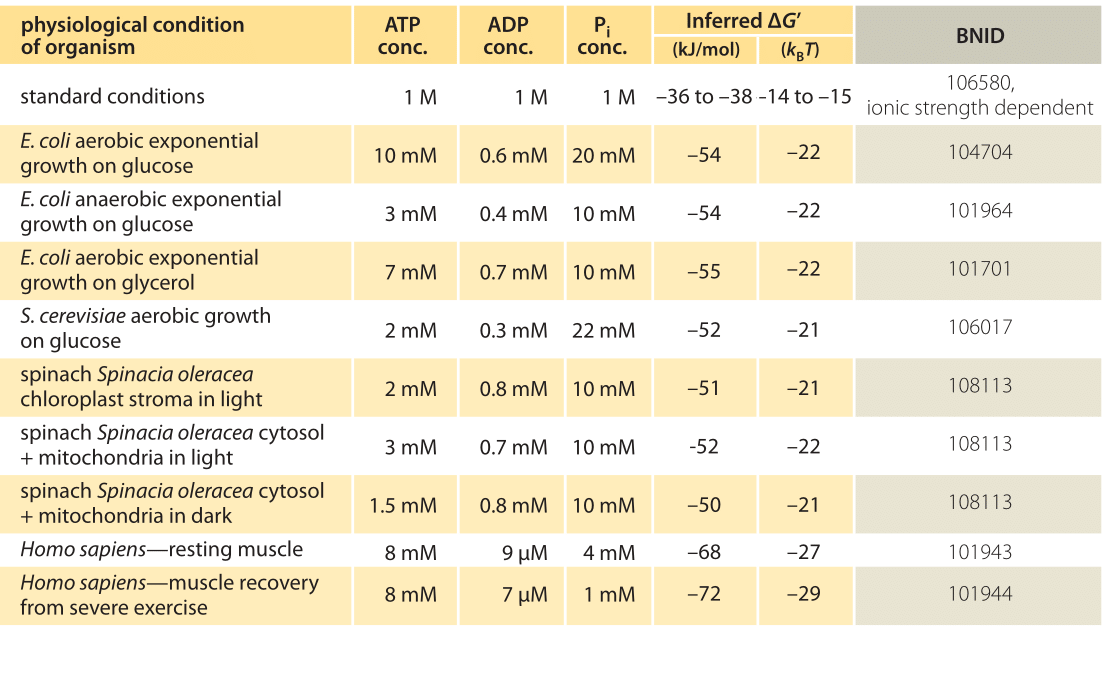
Tabla 1: Energía libre para hidrólisis de ATP en varios organismos y bajo diferentes condiciones fisiológicas. Cálculos de ΔG ‘inferidos basados en un valor de ΔG’ 0 de -37,6 kJ / mol. Esto hace que los valores de la tabla sean consistentes entre sí, pero crea pequeñas desviaciones de los valores ΔG’ reportados en las fuentes primarias. Tales desviaciones pueden ser el resultado de variaciones en la fuerza iónica, el pH y los sesgos de los métodos de medición. Los valores se redondean a uno o dos dígitos significativos. En espinacas, donde no se notificó concentración de Ip, se utilizó un valor característico de 10 mm (BNID 103984, 103983, 111358, 105540).
En la práctica, las condiciones fisiológicas dependen del organismo en estudio, del tejido o compartimento dentro de la célula en cuestión y de las demandas de energía actuales para reacciones metabólicas y de otro tipo. Por ejemplo, en el hígado de rata perfundido, se encontró que la relación ATP / ADP era de aproximadamente 10:1 en el citosol, pero 1: 10 en las mitocondrias bajo altas tasas de glucólisis, y bajo bajas tasas de glucólisis, ambas proporciones eran muy cercanas a 1 (BNID 111357). Por lo tanto, se espera un rango de valores para ΔG. La clave para entender este rango es tener una idea de cuánto difiere Q de K, es decir, cómo difieren las concentraciones de las condiciones estándar. Las concentraciones intracelulares típicas de todos los componentes relevantes (ATP, ADP y Pi) están en el rango mM, mucho más bajo que las condiciones estándar. La relación / con concentraciones en el rango de mM es mucho menor que una, y la reacción será energéticamente más favorable que en condiciones estándar, como se muestra en la Tabla 1. El valor más alto ≈-70 kJ / mol (≈30kBT) se calculó a partir de los valores en el músculo humano de los atletas que se recuperaban después del esfuerzo (BNID 101944). En células de E. coli que crecen con glucosa, se reportó un valor de -47 kJ/mol (≈20kBT, BNID 101964). Para poner estos números en perspectiva, un motor molecular que ejerce una fuerza de aproximadamente 5 pN (BNID 101832) sobre un tamaño de paso de 10 nm (BNID 101857) funciona de orden 50 Pn nm, requiriendo un poco más de 10 kBT de energía, dentro del rango de lo que un solo ATP puede entregar.
Los cálculos de ΔG requieren una medición precisa de las concentraciones intracelulares relevantes. Dichas concentraciones se miden in vivo en seres humanos mediante resonancia magnética nuclear. La forma natural del fósforo (31P) tiene propiedades magnéticas, por lo que no es necesario agregar ninguna sustancia externa. El tejido de interés, como el músculo, se coloca en un campo magnético fuerte y los cambios en la frecuencia de los pulsos de radio se utilizan para inferir la concentración de ATP y Pi directamente de los picos en los espectros de RMN. En E. coli, las concentraciones de ATP se pueden medir más directamente con un ensayo de bioluminiscencia de ATP. Una muestra de bacterias en crecimiento eliminadas del cultivo se puede analizar usando luciferasa, una proteína de bacterias que viven en simbiosis con calamares, pero que ya se ha unido a la caja de herramientas de los biólogos como un reportero molecular. La enzima luciferasa utiliza ATP en una reacción que produce luz que se puede medir con un luminómetro, y la concentración de ATP se puede inferir de la intensidad de la señal. Así que tenemos el contenido celular como entrada, la luciferasa como un «dispositivo» que transforma la cantidad de ATP en emisión de luz que sirve como salida medida. Usando herramientas como estas, se encuentra que en la «vida real» el ATP vale aproximadamente el doble que en condiciones «estándar» debido a que las concentraciones son más favorables para la reacción hacia adelante.
Terminamos señalando que es una pregunta permanente por qué el nucleótido de adenina fue seleccionado para servir como la moneda de energía principal con GTP y los otros nucleótidos que cumplen funciones mucho más secundarias. ¿Es un caso de elección aleatoria que más tarde se convirtió en «accidente congelado» o hubo una ventaja selectiva para ATP sobre GTP, CTP, UTP y TTP?




