Normal cellmetabolism beror på upprätthållandet av blodets phinom mycket smala gränser (7,35-7,45).
även relativt mildexkursioner utanför detta normala pH-område kan ha skadliga effekter, inklusive minskad syretillförsel till vävnader, elektrolytestörningar och förändringar i hjärtmuskelkontraktilitet; överlevnad ärsällsynt om blodets pH faller under 6,8 eller stiger över 7,8.
problemetför kroppen är att normal metabolism är förknippad medKontinuerlig produktion av vätejoner(H+) och koldioxid(CO2), som båda tenderar att minska pH. de mekanismsom övervinner detta problem och tjänar till att upprätthålla normalt blod pH(dvs. bevara syra-bas homeostas) är en komplex synergi avåtgärd som involverar kemiska buffertar i blod, röda blodkroppar (erytrocyter), som cirkulerar i blod och funktionen av treorgan: lungor, njurar och hjärna.
innan du förklarar hur dessa femelement bidrar till det övergripande underhållet av blodets pH, skulle det vara till hjälp att snabbt granska några grundläggande begrepp.
- Vad är en syra, vad är en bas och vad är pH?
- Vad är en buffert? – Bikarbonatbuffertsystemet
- lungfunktion, transport av CO2 och syrabasbalans
- njurar och syra-basbalans
- störningar av syra-basbalansen
- orsaker till syrabasstörningar
- respiratorisk acidos-(förhöjd pCO2(a),minskat pH)
- respiratorisk alkalos – (reduceradpco2( a), ökat pH)
- metabolisk acidos – (minskadhco3–, minskat pH)
- metabolisk alkalos – (ökadhco3– , ökat pH)
- kompensation-en följd av syrabasstörning
- blandade syrabasstörningar
- sammanfattning
- några föreslog vidareläsning
Vad är en syra, vad är en bas och vad är pH?
en syra är ett ämne som frigörvätejoner (H+) vid dissociation i lösning.
till exempel: Saltsyra (HCl) dissocierar till vätejoner och kloridjoner
HCl ![]() H+ + Cl-
H+ + Cl-
kolsyra (H2CO3) dissocierar tillvätejoner och bikarbonatjoner
H2CO3 ![]() h+ +HCO3–
h+ +HCO3–
vi skiljer mellan starka syror som saltsyra ochsvaga syror som kolsyra. Skillnaden är att starka syrordissociera mer än svaga syror. Följaktligen vätejonkoncentrationen av en stark syra är mycket högre än den hos en svagsyra.
en bas är ett ämne som i lösning accepterarvätejoner.
till exempel accepterar basbikarbonatet (HCO3–)vätejoner för att bilda kolsyra:
HCO3– + H+ ![]() H2CO3
H2CO3
pH är en skala av 0-14 av surhet och alkalinitet. Rent vatten harett pH på 7 och är neutralt (varken surt eller alkaliskt). pH över 7är alkaliskt och under 7 surt. Således är blodets pH (7,35-7,45) något alkaliskt men i klinisk medicin är termen alkalosis, kanske förvirrande, reserverad för blodets pH större än 7.45och termen acidos är reserverad för blodets pH mindre än 7,35.
pH är ett mått på vätejonkoncentration (H+).De två är relaterade enligt följandekvation:
pH = – log10
Var är koncentrationen av vätejoner inmol per liter (mol/L)
från denna ekvation
pH 7,4 = H+ koncentration av 40 nmol/L
pH 7,0 = H+ koncentration av 100 nmol/L
pH 6,0 = H+ koncentration av 1000 nmol/L
det är uppenbart att:
- de två parametrarna ändras omvänt; när vätejonkoncentrationen ökar faller pH
- på grund av det logaritmiska förhållandet är en stor förändring av vätejonkoncentrationen faktiskt en liten förändring i pH. till exempel fördubblar vätejonkoncentrationen pH att falla med bara 0,3
Vad är en buffert? – Bikarbonatbuffertsystemet
buffertar är kemikalier i lösning som minimerar förändringen i pH som uppstår när syror tillsätts genom att ’moppa upp’ vätejoner. En buffert är en lösning av en svag syra och desskonjugatbas. I blod är principbuffertsystemet det svagasyra, kolsyra (H2CO3) och dess konjugatbas, bikarbonat (HCO3–). För att förklara hurdetta system minimerar förändringar i pH, anta att vi lägger till en stark syra, t. ex. HCl, till bikarbonatbufferten:
syran kommer att dissociera och frigöra vätejoner:
HCl ![]() H + + Cl –
H + + Cl –
bikarbonatbufferten ”absorberar” sedan vätejonerna och bildar karbonsyra i processen:
HCO3 – + H + ![]() H2CO3 (kolsyra)
H2CO3 (kolsyra)
den viktiga punkten är att eftersom vätejonerna från Hclhar införlivats i den svaga kolsyran, som intedissocierar lika lätt, det totala antalet vätejoner i lösningoch därför förändras pH inte så mycket som skulle ha inträffati frånvaro av bufferten.
även om en buffert i hög grad minimerarph-förändring, eliminerar den inte det eftersom även en svag syra (somkarbonsyra) dissocierar i viss utsträckning. PH för en bufferlösning är en funktion av de relativa koncentrationerna av svagasyra och dess konjugatbas.
pH = 6.1 + log ( / )
var = koncentration avbikarbonat
= koncentration av kolsyra
detta förhållande, känt som Henderson-Hasselbalch ekvationen,visar att pH styrs av förhållandet mellan bas(HCO3–) koncentration och syra(H2CO3) koncentration.
som vätejoner tillsätts till bikarbonatbufferten:
H+ +HCO3– ![]() H2CO3
H2CO3
bikarbonat (bas) konsumeras (koncentrationsminskningar) ochkarbonsyra produceras (koncentrationsökningar). Om hydrogenjoner fortsätter att tillsättas, skulle allt bikarbonat så småningom konsumeras (omvandlas till kolsyra) och det skulle vara nobuffererande effekt – pH skulle då falla kraftigt om mer syra tillsattes.
men om kolsyra kontinuerligt kunde avlägsnas från systemet och bikarbonat ständigt regenereras, kunde buffertkapaciteten och därför pH bibehållas trots fortsatt tillsats av vätejoner.
som kommer att bli tydligt med mer detaljer om fysiologin avsyra-basbalans, det är i själva verket vad som händer i kroppen. Inessens säkerställer lungorna avlägsnande av kolsyra (som koloxid) och njurarna säkerställer kontinuerlig regenerering avbikarbonat.
denna roll av lungorna är beroende av en singulärkarakteristisk för bikarbonatbuffertsystemet och det är förmågan hos kolsyra att omvandlas till koldioxid ochvatten.
följande ekvation beskriver förhållandet mellan allaelement i bikarbonatbuffertsystemet som det fungerar ikroppen
H+ +HCO3–![]() H2CO3
H2CO3![]() H2O + CO2
H2O + CO2
det är viktigt att notera att reaktionerna är reversibla.Riktningen är beroende av den relativa koncentrationen av varjeelement. Så att till exempel en ökning av koldioxidkoncentrationen tvingar reaktionen till vänster med ökad formationav kolsyra och slutligen vätejoner.
detta förklararsyrapotential av koldioxid och leder oss till det viktiga bidrag som lungorna och röda cellerna gör till övergripande syrabasbalans.
lungfunktion, transport av CO2 och syrabasbalans
en konstant mängd CO2 i blod, som är nödvändig för normalsyra-basbalans, återspeglar en balans mellan det som produceras som resultat av vävnadscellmetabolism och det som utsöndras av lungorna inexcired luft.
genom att variera hastigheten vid vilken koldioxid ärutsöndras, reglerar lungorna koldioxidhalten i blodet.Sekvensen av händelser från koldioxidproduktion ivävnader till eliminering i utgående luft beskrivs i Fig. 1.Koldioxid diffunderar ut ur vävnadsceller för att omgekapillärt blod (Fig. 1a). En liten andel löses upp i blodplasma och transporteras till lungorna oförändrade.
men de flesta diffuserin i röda blodkroppar där den kombineras med vatten för att bilda kolsyra.Syran dissocierar med produktion av vätejoner ochbikarbonat. Vätejoner kombineras med deoxygenerat hemoglobin (hemoglobin fungerar som en buffert här), förhindrar en farligfall i cellulärt pH och bikarbonat diffunderar längs en koncentrationgradient från röda blodkroppar till plasma.
således transporteras det mesta av koldioxiden som produceras i vävnaderna till lungorna som bikarbonatein blodplasma.
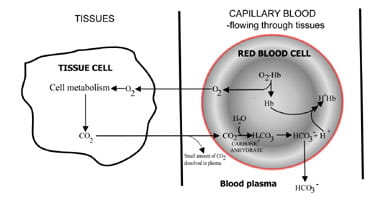
Fig. 1A. CO2 producerad i vävnaderomvandlas till bikarbonat för transport till lungor.
|
|
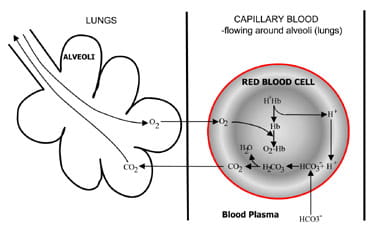
Fig. 1b. At the lungs bicarbonate convertedback to CO2 and eliminated by the lungs.
vid alveolerna i lungorna är processen omvänd (Fig. 1b).Vätejoner förskjuts från hemoglobin eftersom det tar upp syrefrån inspirerad luft. Vätejonerna buffras nu avbikarbonat som diffunderar från plasma tillbaka till röda blodkroppar och karbonsyra bildas. När koncentrationen av detta stiger är denomvandlas till vatten och koldioxid. Slutligen dioxiddiffuserar ner en koncentrationsgradient från röda blodkroppar till alveoler förexcretion i utgående luft.
respiratoriska kemoreceptorer i hjärnstammen svarar på förändringari koncentrationen av koldioxid i blodet, vilket orsakar ökadventilation (andning) om koldioxidkoncentrationen stiger ochminskad ventilation om koldioxid faller.
njurar och syra-basbalans
Normal cellulär metabolism resulterar i kontinuerlig produktion av vätejoner. Vi har sett att genom att kombinera meddessa vätejoner minimerar bikarbonatbufferten i blodderas effekt. Buffring är dock endast användbar på kort sikt, och i slutändan måste vätejoner avlägsnas från kroppen.Dessutom är det viktigt att bikarbonatet som används förbuffervätejoner ersätts kontinuerligt.
dessa två uppgifter,eliminering av vätejoner och regenerering av bikarbonat, äraccomplished av njurarna. Njurtubulceller är rika påenzymkolsyraanhydras, vilket underlättar bildandet av karbonsyrasyra från koldioxid och vatten. Kolsyra dissocierar tillbikarbonat och vätejoner. Bikarbonatet återabsorberas iblod och vätejonerna passerar in i tubulärens lumen ochelimineras från kroppen i urinen.
denna eliminering av urin ärberoende av närvaron i urin av buffertar, huvudsakligen fosfat-och ammoniakjoner.
störningar av syra-basbalansen
de flesta syra-basstörningar beror på
- sjukdom eller skador på organ (njure, lungor, hjärna) vars normala funktion är nödvändig för syra-bas homeostas,
- sjukdom som orsakar onormalt ökad produktion av metaboliska syror så att homeostatiska mekanismer är överväldigade
- medicinsk intervention (t. ex. mekanisk ventilation, vissa läkemedel)
arteriella blodgaser är blodprovet som används för att identifiera ochövervaka syrabasstörningar. Tre parametrar uppmätta underblodgasanalys, arteriellt blod pH( pH), partiellt tryck avkoldioxid i arteriellt blod (pCO2(a)) och koncentration av bikarbonat (HCO3–) är av crucial betydelse (Se tabell i för referens (normalt) intervall).Resultaten av dessa tre tillåter klassificering av syrabaseradstörning till en av fyra etiologiska kategorier:
- Respiratory acidosis
- Respiratory alkalosis
- Metabolic acidosis
- Metabolic alkalosis
|
Adults |
Neonates |
|
|
pH |
7.35-7.45 |
7.30-7.40 |
|
pCO2 (kPa) |
4.7-6.0 |
3.5-5.4 |
|
Bicarbonate |
22-28 |
15-25 |
TABLE I. För att förstå hur resultaten av pH, pCO2(a)och bikarbonat används för att klassificera syrabasstörningar i dettasätt måste vi återgå till Henderson-Hasselbalch ekvationen
pH = 6.1 + log (/ )
vi mäter pH och bikarbonat men inte kolsyra(H2CO3). Det finns emellertid ett förhållandemellan pCO2 (a) och H2co3vilket möjliggör omräkning av Henderson-Hasselbalch-ekvationen interms av de tre parametrarna (pH, pCO2(a) ochbikarbonat) mätt under blodgasanalys:
pH = 6,1 + logg ( /( pCO2(a) 0.23))
genom att ta bort alla konstanter från denna ekvation, förhållandet mellan de tre uppmätta parametrarna kan vara mer simplystated:
ph-c/pCO2(a)
detta förhållande, avgörande för en förståelse av allt som följer om syrabasstörningar, säger att arterialblod pH är proportionellt mot förhållandet mellan bikarbonatkoncentrationtill pCO2(a). Det tillåter följandededuktioner:
- pH förblir normalt så länge förhållandet : pCO2(a) förblir normalt
- pH ökar (dvs. alkalos uppstår) om antingen ökar eller pCO2(a) minskar.
- pH minskar (dvs. acidos uppstår) om antingen minskar eller pCO2(a) ökar
- om både pCO2(A) och ökas med relativt samma mängd, är förhållandet och därför pH normalt
- Om båda pCO2 (a) och minskas med relativt samma mängd är förhållandet och därför pH normalt.
syrabasstörningar påverkar främst hellerpco2( a), i vilket fall det kallas andningsstörning, eller i vilket fall det kallas anon-respiratorisk eller metaboliskstörning:
- Om den primära störningen är en upphöjd pCO2(A) (som orsakar acidos – se ovan) kallas tillståndet respiratorisk acidos
- Om den primära störningen är en reducerad pCO2(a) (som orsakar alkalos – se ovan) kallas tillståndet respiratorisk alkalos
- Om den primära störningen är associerad med reducerat bikarbonat (vilket resulterar i acidos – se ovan) kallas tillståndet metabolisk acidos
- Om den primära störningen är associerad med förhöjt bikarbonat (vilket resulterar i alkalos – se ovan) kallas tillståndet metabolisk alkalos
orsaker till syrabasstörningar
respiratorisk acidos-(förhöjd pCO2(a),minskat pH)
respiratorisk acidos kännetecknas av ökadpco2(a) på grund av otillräcklig alveolär ventilation(hypoventilation) och därmed minskad eliminering avco2 från blodet. Respiratorisk sjukdom, t. ex. bronkopneumoni, emfysem, astma och kroniska obstruktiva luftvägarsjukdom, kan alla vara associerade med hypoventilation tillräcklig för attorsaka respiratorisk acidos.
vissa läkemedel (t. ex. morfin ochbarbiturater) kan orsaka respiratorisk acidos genom att deprimeraandningscentrum i hjärnan. Skada eller trauma på bröstväggenoch muskulaturen som är involverad i andningsmekaniken kanminska ventilationshastigheten. Detta förklarar respiratorisk acidossom kan komplicera sjukdomsförloppet som poliomyelit, Guillain-Barre syndrom och återhämtning från allvarligt brösttrauma.
respiratorisk alkalos – (reduceradpco2( a), ökat pH)
däremot kännetecknas andningsalkalos av minskadpco2(a) på grund av överdriven alveolär ventilationoch resulterande överdriven eliminering av CO2 från blod.Sjukdom där, på grund av minskat syre i blod (hypoxemi), detandningscentrum stimuleras kan resultera i andningsorganalkalos.
exempel här inkluderar allvarlig anemi, lungembolismoch vuxen respiratorisk syndrom. Hyperventilation tillräcklig för attorsaka respiratorisk alkalos kan vara en egenskap av ångestattacker ochsvar på svår smärta. En av de mindre välkomna egenskaperna hossalicylat (aspirin) är dess stimulerande effekt på andningsorganencentrum. Denna effekt står för respiratorisk alkalos somuppstår efter överdosering av salicylat. Slutligen överentusiastiskmekanisk ventilation kan orsaka andningsalkalos.
metabolisk acidos – (minskadhco3–, minskat pH)
reducerat bikarbonat är alltid en egenskap hos metabolicacidos. Detta sker av en av två skäl: ökad användning avbikarbonat vid buffring av en onormal syrabelastning eller ökad förlustav bikarbonat från kroppen. Diabetisk ketoacidos och laktikacidos är två tillstånd som kännetecknas av överproduktion avmetaboliska syror och därmed utmattning av bikarbonat.
i det första fallet återspeglar onormalt höga blodkoncentrationer av keto-syror(B-hydroxismörsyra och acetoättiksyra) de allvarliga metabola derangements som härrör från insulindeficiency.
alla celler producerar mjölksyra om de har brist på syre,så ökad mjölksyraproduktion och resulterande metabolicacidos förekommer i alla tillstånd där syretillförsel tillvävnader är allvarligt äventyras.
exempel inkluderar hjärtstillestånd och alla tillstånd som är förknippade med hypovolemisk chock (t.ex. massivfluidförlust). Levern spelar en viktig roll för att avlägsna den litenmängd mjölksyra som produceras under normal cellmetabolism, så att mjölksyraacidos kan vara en egenskap hos levermisslyckande.
onormal förlust av bikarbonat från kroppen kan uppstå undersvår diarre. Om det inte kontrolleras kan detta leda till metabolisk acidos.Underlåtenhet att regenerera bikarbonat och utsöndra vätejonförklarar den metaboliska acidosen som uppstår vid njurmisslyckande.
metabolisk alkalos – (ökadhco3– , ökat pH)
bikarbonat höjs alltid i metabolisk alkalos. Sällan kan överdriven administrering av bikarbonat eller intag av bikarbonati antacida preparat orsaka metabolisk alkalos, men detta ärvanligtvis övergående. Onormal förlust av vätejoner från kroppen kanvara det primära problemet. Bikarbonat som annars skulle konsumeras för att buffra dessa förlorade vätejoner följdackumuleras i blod. Magsaft är sur och gastriskaspiration eller någon sjukdomsprocess där maginnehållet ärförlorad från kroppen representerar en förlust av vätejoner.
Denprojektil kräkningar av magsaft förklarar till exempelmetabolisk alkalos som kan uppstå hos patienter med pyloricstenos. Allvarlig kaliumutarmning kan orsaka metabolisk alkalospå grund av det ömsesidiga förhållandet mellan väte och kaliumjoner.
kompensation-en följd av syrabasstörning
det är viktigt för livet att pH inte avstår för långt från normalt, och kroppen kommer alltid att försöka returnera ett onormalt pH motnormalt när syra-basbalansen störs. Kompensation ges till denna livsbevarande process. För att förståkompensation är det viktigt att komma ihåg att pH styrs av theratio : pCO2(a).så länge förhållandet är normalt kommer pH att vara normalt.
Tänk på patienten med metabolisk acidos vars pH är lågteftersom bikarbonat är lågt. För att kompensera för det låga och återställaDet viktiga förhållandet mot normalt måste patienten sänka hispCO2 (a). Kemoreceptorer i andningsorganencentrum i hjärnan svarar på en stigande vätejonkoncentration (lågt pH), vilket orsakar ökad ventilation(hyperventilation) och därigenom ökad eliminering av koldioxid; pCO2(a) faller och förhållandet : pCO2 (a) återvändermot normalt.
kompensation för metabolisk alkalos i vilken är hög, däremot involverardepression av andning och därmed retention av koldioxidså att pCO2(a) stiger för att matcha ökningenin . Men depression avandning har den ovälkomna biverkningen av hotande tillräckligasyregenering av vävnader. Av denna anledning andningskompensation avmetabolisk alkalos är begränsad.
primära störningar av pCO2(a) (respiratoryacidos och alkalos) kompenseras genom njurjusteringar avvätejonutsöndring som resulterar i förändringar som kompenserar lämpligt förprimär förändring av pCO2 (a). Således innebär renalkompensationen för respiratorisk acidos (raisedpCO2(a)) ökad reabsorption av bikarbonat och njurkompensation för respiratorisk alkalos(reducerad pCO2(a)) innebär minskad bikarbonaterabsorption.
begreppet syra-basbalans under kompensationöverförs visuellt i Fig. 2. Tabell II sammanfattar blodgasenresultat som karakteriserar alla fyra syrabasstörningar föreoch efter kompensation.
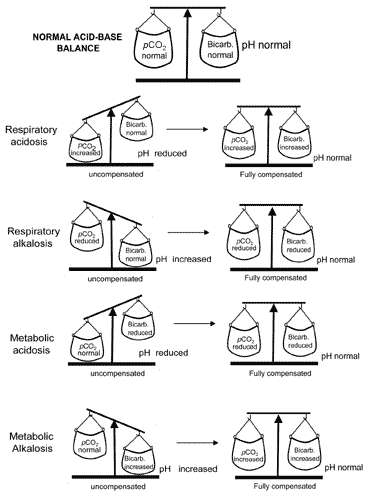
Fig. 2. ”Syra-basbalansen” : compensationrestores normal pH
|
Primary disturbance |
||||
|
Respiratory |
Repiratory |
Metabolic |
Metabolic |
|
|
Some |
Emphysema |
Hyper- |
Renal failure |
Bicarbonate Potassium |
|
Compen- |
RENAL |
RENAL |
RESPIRA- |
RESPIRA- |
|
Initial blood |
pH |
pH |
pH |
pH |
|
Blood gas |
ph pCO2 |
pH pCO2 |
ph pCO2 |
begränsad |
|
Blood gas |
pH normal |
pH normal |
pH normal |
Limited |
Utskriftsvänlig version av tabellen, pdf.
tabell II. blodgas resulterar i störningar avsyra-basbalans
andningskompensation för en primär metabolisk störningsker mycket snabbare än metabolisk (renal) kompensation för aprimär andningsstörning. I det andra fallet kompensationsker över dagar snarare än timmar.
om kompensation resulterar iåtergång av pH till normalt då patienten sägs vara fullycompensated. Men i många fall returnerar kompensationen pHtowards normalt utan att faktiskt uppnå normalitet; i sådana fallpatienten sägs vara delvis kompenserad.
Förskäl som beskrivs ovan är metabolisk alkalos mycket sällan fullkompenserad.
blandade syrabasstörningar
det kan antas av ovanstående diskussion att alla patienter med syrabasstörning lider av endast en av fyra kategorier av syrabasbalans. Detta kan mycket väl vara fallet,men under särskilda omständigheter kan patienter uppvisa mer änen störning.
tänk till exempel på patienten med en kronisklungssjukdom som emfysem som har en långvarig partiellkompenserad respiratorisk acidos. Om denna patient också var adiabetisk som inte hade tagit sin normala insulindos och som ett resultatvar i ett tillstånd av diabetisk ketoacidos, skulle blodgasresultat återspegla den kombinerade effekten av både respiratorisk acidos ochmetabolisk acidos.
sådana blandade syrabasstörningar är inte sällan förekommande och kan vara svåra att riva upp enbart på grundval av arteriella blodgasresultat.
sammanfattning
upprätthållandet av normalt blod pH involverar flera organsystemoch beror på cirkulationsintegritet. Det är inte förvånande dåden störningen av syra-basbalansen kan komplicera förloppet avallmänt olika sjukdomar såväl som trauma mot många delar avkropp. Kroppen har stor kraft för att bevara blodets pH, ochstörningar innebär vanligtvis antingen allvarlig kronisk sjukdom eller akutkritisk sjukdom.
resultaten av arteriell blodgasanalys kanidentifiera syrabasstörning och ge värdefull information somtill dess orsak.
några föreslog vidareläsning
- Thomson WST, Adams JF, Cowan RA. Klinisk syra-basbalans. Oxford: Oxford medicinska publikationer 1997
- Harrison RA. Syra-basbalans. Respir Vård Clin N. Amerika 1995; 1,1: 7-21
- Woodrow P. arteriell blodgasanalys. Omvårdnad Standard 2004; 18,21:45-52
- Sirker AA, Rhodos a, Gounds RM, Bennet ED. Syrabasfysiologi: den ’traditionella’ och ’moderna’ metoden. Anestesi 2002; 57: 348-56