Wie viel Energie wird bei der ATP-Hydrolyse freigesetzt?
Lesemodus
ATP wird oft als die Energiewährung der Zelle bezeichnet. Hunderte von Reaktionen in der Zelle von metabolischen Transformationen bis hin zu Signalereignissen sind mit der Hydrolyse (wörtlich „Wasserlockerung“) von ATP durch Wasser verbunden . Die Reaktion ATP + H2O <> ADP + Pi wandelt Adenosintriphosphat (ATP) in Adenosindiphosphat (ADP) und anorganisches Phosphat (Pi) um. Die mit dieser Reaktion verbundene Änderung der freien Energie treibt einen großen Teil der zellulären Reaktionen an, wobei das Membranpotential und die Reduktionsleistung die beiden anderen dominierenden Energiequellen sind. Aber wie viel ist diese Energiewährung genau wert und was verrät sie über die chemischen Transaktionen, die gekauft werden können? Natürlich gibt es keine Antwort auf diese Frage, da die Menge an Energie, die durch diese Hydrolysereaktion freigesetzt wird, von den intrazellulären Bedingungen abhängt, aber es ist möglich, ein Gefühl für den ungefähren „Wert“ dieser Währung zu bekommen, indem man auf einige einfache Schätzungen zurückgreift.

Abbildung 1: Das Verhältnis der Gibbs-freien Energie der ATP-Hydrolyse unter Standardbedingungen zur Gleichgewichtskonstante und das Verhältnis der freien Energie der Hydrolyse unter physiologischen Bedingungen zu den physiologischen Reaktandenkonzentrationen.
Die Gibbs-Änderung der freien Energie (ΔG) aufgrund der ATP-Hydrolyse hängt von den Konzentrationen der verschiedenen Reaktionsteilnehmer ab, wie in Abbildung 1 dargestellt. Wenn die Konzentrationen weiter von ihren Gleichgewichtswerten entfernt sind, ist der Absolutwert von ΔG größer. Unter „normalen“ Bedingungen (z. konzentrationen von 1M für alle Reaktanten außer Wasser, das in seiner charakteristischen Konzentration von 55M aufgenommen wird) Die freie Gibbs-Energie der ATP-Hydrolyse variiert von -28 bis -34 kJ / mol (d. H. ≈12 kBT, BNID 101989) in Abhängigkeit von der Konzentration des Kations Mg2+. Die Abhängigkeit von Mg-Ionen tritt auf, weil die positiv geladenen Magnesiumionen helfen, das ATP-Molekül zu stabilisieren. In der Zelle liegen die Bedingungen jedoch nie in der Nähe der Standardzustandswerte. Zum Beispiel würde eine Konzentration von 1M ATP bedeuten, dass die Masse des gelösten Stoffes der des Wasserlösungsmittels selbst ähnlich wäre. In Abbildung 1 zeigen wir die oft verwirrende Ableitung der physiologischen freien Energie (ΔG) beim Konzentrationsverhältnis vom Standardwert (ΔGo). Die Division durch Terme, wie sie erforderlich sind, um Einheiten als Logarithmus zu behandeln, sollte immer einen Term ohne Einheit enthalten. Es ist manchmal überraschend zu glauben, dass, wenn die Zelle im Gleichgewicht wäre, der Wert von ΔG Null gewesen wäre und es keine Energie gäbe, die durch ATP-Hydrolyse gewonnen werden könnte. Glücklicherweise ist dies bei lebenden Organismen nie der Fall. .
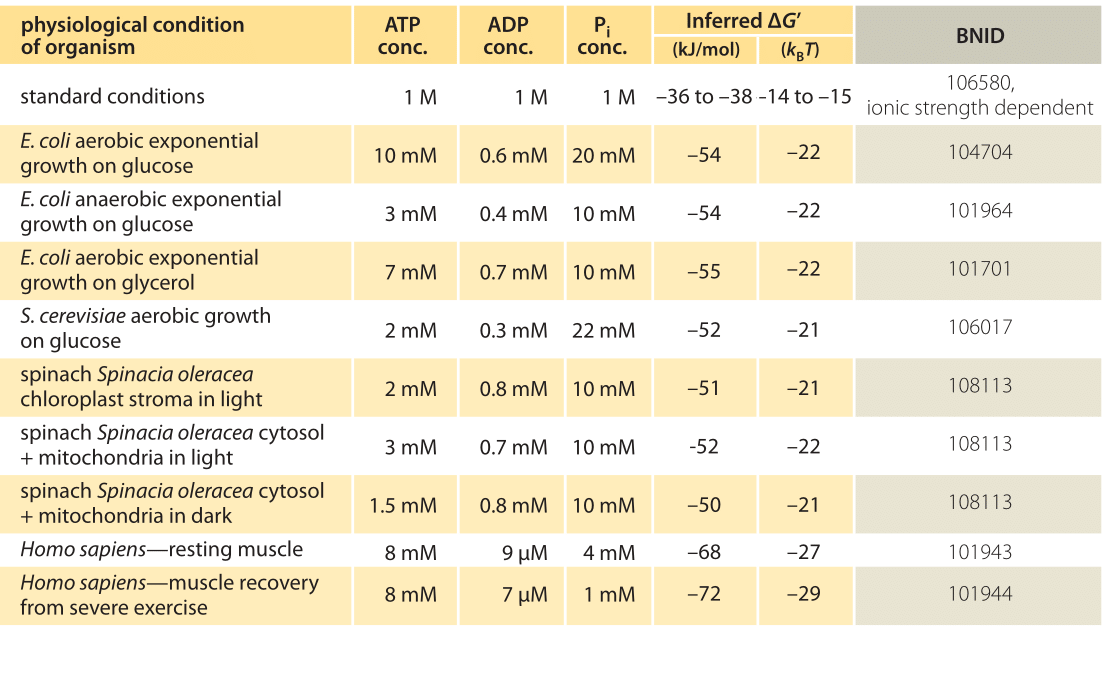
In der Praxis hängen die physiologischen Bedingungen vom untersuchten Organismus, dem Gewebe oder Kompartiment innerhalb der betrachteten Zelle und vom aktuellen Energiebedarf für metabolische und andere Reaktionen ab. Zum Beispiel wurde in der perfundierten Rattenleber das ATP zu ADP Verhältnis gefunden, um ungefähr 10:1 im Cytosol aber 1:10 in den Mitochondrien unter hohen Raten von Glykolyse zu sein, und unter niedrigen Raten von Glykolyse waren beide Verhältnisse viel nah an 1 (BNID 111357). Daher wird ein Wertebereich für ΔG erwartet. Der Schlüssel zum Verständnis dieses Bereichs besteht darin, ein Gefühl dafür zu bekommen, wie sehr sich Q von K unterscheidet, dh wie sich die Konzentrationen von den Standardbedingungen unterscheiden. Die typischen intrazellulären Konzentrationen aller relevanten Komponenten (ATP, ADP und Pi) liegen im mM-Bereich, viel niedriger als unter Standardbedingungen. Das Verhältnis / mit Konzentrationen im mM-Bereich ist viel niedriger als eins, und die Reaktion wird energetisch günstiger sein als bei Standardbedingungen, wie in Tabelle 1 gezeigt. Der höchste Wert ≈-70 kJ / mol (≈30kBT) wurde aus Werten im menschlichen Muskel von Sportlern berechnet, die sich nach Anstrengung erholten (BNID 101944). In E. coli-Zellen, die auf Glucose wachsen, wurde ein Wert von -47 kJ/mol berichtet (≈20kBT, BNID 101964). Um diese Zahlen in die richtige Perspektive zu rücken, arbeitet ein molekularer Motor, der eine Kraft von ungefähr 5 pN (BNID 101832) über eine Schrittgröße von 10 nm (BNID 101857) ausübt, in der Größenordnung von 50 pN nm und benötigt etwas mehr als 10 kBT Energie, gut im Bereich dessen, was ein einzelnes ATP liefern kann.
Die Berechnungen von ΔG erfordern eine genaue Messung der relevanten intrazellulären Konzentrationen. Solche Konzentrationen werden in vivo beim Menschen mittels Kernspinresonanz gemessen. Die natürliche Form von Phosphor (31P) hat magnetische Eigenschaften, so dass keine externe Substanz hinzugefügt werden muss. Das interessierende Gewebe wie Muskeln wird in ein starkes Magnetfeld versetzt und Frequenzverschiebungen von Funkpulsen werden verwendet, um die Konzentration von ATP und Pi direkt aus den Peaks in den NMR-Spektren abzuleiten. In E. darüber hinaus können die ATP-Konzentrationen mit einem ATP-Biolumineszenztest direkter gemessen werden. Eine Probe wachsender Bakterien, die aus der Kultur entfernt wurde, kann mit Luciferase untersucht werden, einem Protein aus Bakterien, die in Symbiose mit Tintenfischen leben, aber inzwischen als molekularer Reporter in die Toolbox von Biologen aufgenommen wurden. Das Luziferaseenzym verwendet ATP in einer Reaktion, die Licht erzeugt, das mit einem Luminometer gemessen werden kann, und die ATP-Konzentration kann aus der Signalstärke abgeleitet werden. Wir haben also den Zellinhalt als Eingabe, Luziferase als „Gerät“, das die Menge an ATP in Lichtemission umwandelt, die als gemessene Ausgabe dient. Mit solchen Werkzeugen stellt man fest, dass ATP im „wirklichen Leben“ etwa doppelt so viel wert ist wie unter „Standard“ -Bedingungen, da die Konzentrationen für die Vorwärtsreaktion günstiger sind.Zum Schluss stellen wir fest, dass es eine ständige Frage ist, warum das Adeninnukleotid als Hauptenergiewährung ausgewählt wurde, wobei GTP und die anderen Nukleotide eine viel untergeordnete Rolle spielen. Handelt es sich um eine zufällige Wahl, die später zu einem „eingefrorenen Unfall“ wurde, oder gab es für ATP einen selektiven Vorteil gegenüber GTP, CTP, UTP und TTP?




