Eine durch Vektoren übertragene Krankheit (insbesondere eine biologische Übertragung anstelle einer mechanischen) ist eine Krankheit, bei der die Übertragung von Infektionen in einer Population (der Wirtspopulation) nur über eine zweite Population (Vektoren) erfolgt. Vektoren sind in der Regel hämatophage (blutfressende) Arthropoden wie Mücken, Sandfliegen oder Zecken. Es gibt viele solcher Krankheiten, deren Dynamik unter dem Gesichtspunkt der Infektionskontrolle von großem Interesse ist. Malaria, Leishmaniose, Dengue-Fieber und das West-Nil-Virus sind nur einige Beispiele, die derzeit enorme soziale Auswirkungen auf die menschliche Bevölkerung haben.
Jedes Jahr infizieren sich in der Region 225 Millionen Menschen mit dem Malariaparasiten, und im Jahr 2009 führten rund 781.000 davon zu krankheitsbedingter Mortalität. Die Geschichte ist ähnlich für Leishmaniose, wo es weltweit rund 12 Millionen Menschen gibt, von denen angenommen wird, dass sie zu einem bestimmten Zeitpunkt infiziert sind, und etwa 80.000 Menschen jährlich an der schwersten Form, der viszeralen Leishmaniose, sterben. Solche Krankheiten sind in den Entwicklungsländern weit verbreitet; eine Kombination aus optimalem Lebensraum für Vektoren in tropischen Regionen und mangelnder medizinischer Hilfe führt dort zu großflächigen Endemiten.
Menschliche Krankheiten sind nicht das einzige Problem; Es gibt viele andere, die andere Wirtsklassen infizieren, die ebenfalls von Interesse sind, insbesondere unter dem Gesichtspunkt der Erhaltung gefährdeter Arten.
Der typische Infektionsverlauf für die vektorübertragene Übertragung, wobei Krankheit, Wirt- oder Vektorspezien ignoriert werden, beginnt damit, dass ein infizierter Vektor (ein blutfütternder oder saugender erwachsener Arthropode) einem anfälligen Mitglied der Wirtspopulation eine Blutmahlzeit entnimmt. Einmal gebissen, hat der Wirt die Chance, sich mit der Krankheit zu infizieren. In diesem Stadium gilt der Wirt bei einer Infektion als exponiert, hat jedoch keine nachteiligen Auswirkungen auf die Infektion und kann die Krankheit nicht übertragen. Die Zeit nach der Infektion, aber vor der Infektion, wird als Latenzzeit bezeichnet. Wenn der Parasit ein bestimmtes Stadium seines Fortpflanzungszyklus erreicht hat, wird der Wirt infektiös, und wenn er gebissen wird, kann er die Krankheit durch sein mit Parasiten infiziertes Blut auf einen anfälligen Vektor übertragen und den Übertragungszyklus abschließen (siehe Abbildung unten).
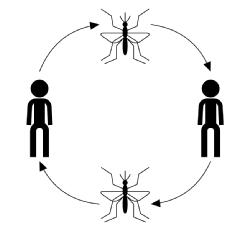
Die Übertragung von Krankheiten ist normalerweise gekennzeichnet durch:
- Häufigkeit und räumliche Ausbreitung von Wirten und Vektoren
- Demographie
- eine Fütterungsrate oder Vektor Wunsch zu beißen
- Erfolg oder Misserfolg der Übertragung
Typischerweise basieren mathematische Modelle von durch Vektoren übertragenen Krankheiten auf einem SI(R) -Modell mit zwei Populationen, das „kreuzweise“ Infektionsbedingungen aufweist, wobei und
sind die Infektionskraft von Begriffen für Hosts bzw. Vektoren:
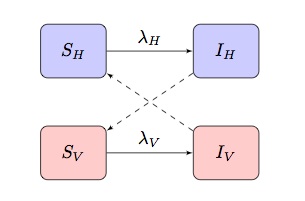
Abhängig von der zu modellierenden Krankheit und Population kann dies angepasst werden, um andere spezifischere Merkmale zu berücksichtigen.
Modellierung der Dynamik von vektorübertragenen Krankheiten
Es gibt viele verschiedene Arten von mathematischen Modellen für die Übertragung von vektorübertragenen Krankheiten; idealerweise sollen diese mathematisch nachvollziehbar und so einfach wie möglich gehalten werden, während die allgemeine Dynamik des biologischen Systems erhalten bleibt. Es überrascht nicht, dass Modelle aus der Literatur stark variieren; von deterministisch bis stochastisch, endemisch (einschließlich Geburten- und Sterberaten) oder epidemisch (Ausbruch von begrenzter Dauer), einschließlich räumlicher Ausbreitung, räumlicher Heterogenität, Latenzzeiten, Altersstruktur, Erwerb und Verlust von Immunität, mehreren Stämmen und vielen anderen. Selbst wenn nur eine bestimmte Krankheit betrachtet wird, können die Variationen der Krankheit innerhalb verschiedener Populationen nicht nur zu Änderungen der Parametrisierung führen, sondern auch dazu, wie man den Modellierungsansatz verfolgen möchte.
Ein Teil von Kats Arbeit konzentriert sich auf die Vereinfachungen, die häufig vorgenommen werden, um die Komplexität von Modellen zu reduzieren. In dieser Arbeit werden die Auswirkungen der Verwendung von „Host-only“ -Übertragungsmodellen wie der Quasi-Gleichgewichtsannahme auf die Krankheitsdynamik und auch der Effekt des Weglassens der Latenzzeit auf epidemische Vorhersagen berücksichtigt.
Leishmaniose
Wird von Erin vervollständigt
Afrikanische Trypanosomiasis (HAT) beim Menschen
Die afrikanische Trypanosomiasis (HAT) beim Menschen, umgangssprachlich als Schlafkrankheit bekannt, ist eine tödliche Krankheit, die in weiten Teilen Afrikas südlich der Sahara endemisch ist. 70 Millionen Menschen leben in Risikogebieten mit einer Fläche von über eineinhalb Millionen Quadratkilometern. Während die Prävalenz von HAT nicht so hoch ist wie die anderer durch Vektoren übertragener Krankheiten wie Malaria oder Dengue-Fieber (es gab etwas mehr als 7000 gemeldete Fälle von HAT, aber 2012 schätzungsweise 207 Millionen Malariafälle), hat der Mangel an chemischer Prophylaxe, die äußerst unangenehme (und oft tödliche) Behandlung und der Mangel an substanzieller wissenschaftlicher Forschung HAT HAT nun auf die Liste der vernachlässigten Tropenkrankheiten der WHO gesetzt.
Der Vektor für HUT ist der Tsetse; die Notwendigkeit, sich mit Blut zu ernähren, um Hunger zu verhindern, und eine einzigartige Vektor-Parasiten-Interaktion (die ein „tenerales Anfälligkeitsphänomen“ verursacht) bedeuten, dass sich Hatching deutlich von anderen durch Vektoren übertragenen Krankheiten wie Malaria unterscheidet.
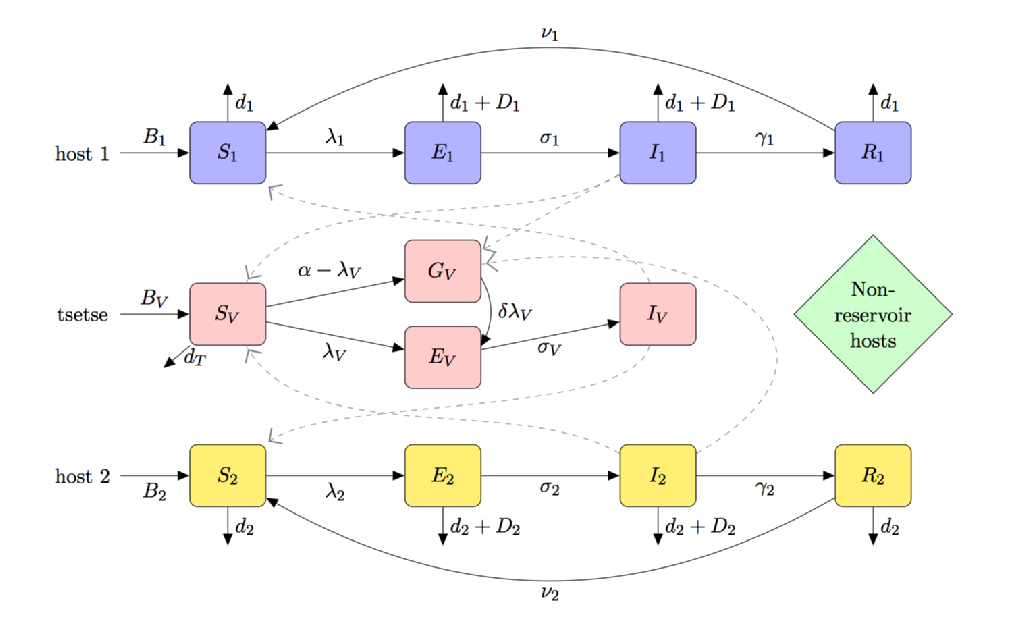
Die folgende Abbildung ist eine Kompartimentskarikatur eines Modells für HAT, das Folgendes enthält:
- (partielle) tenerale Fliegenanfälligkeit
- Multiwirt-Arten (einschließlich Reservoir- und Nichtreservoir-Wirte)
- Tsetse-Fütterungspräferenz
- Verhungern von ungefütterten Tsetse
Blauzungenkrankheit (BTV)
Die Blauzungenkrankheit ist eine Viruserkrankung (BTV) von Wiederkäuern, die von verschiedenen Culicoides-Gattungen und Mückenarten übertragen wird. Zu den Symptomen für an BTV erkrankte Tiere gehörten Beschwerden, hohes Fieber und Zyanose der Zunge, was der Krankheit ihren Namen gibt. Bei Schafen weist die BTV-Krankheit eine hohe assoziierte Mortalität auf. Bis in die späten 1990er Jahre war das europäische BTV-Sortiment vollständig mit dem Sortiment des Mückenvektors C. Imicola verbunden. Ende der 90er und Anfang der 2000er Jahre kam es zu einer bisher beispiellosen Ausbreitung von BTV in Gebiete Europas, die Teil des Verbreitungsgebiets anderer Mückenarten sind, wie z. B. des C. Obsoletus-Komplexes und eng verwandter Mückenarten. Insbesondere ein Ausbruch mit Ursprung in den Niederlanden im Jahr 2006 ist das erste aufgezeichnete Beispiel für einen BTV-Einfall in den 50. In den folgenden Sommern wurden in ganz Nordeuropa BTV-Fälle entdeckt, darunter in Belgien, Deutschland, Großbritannien und Dänemark, die die Fähigkeit der Blauzungenkrankheit belegen, in der nordeuropäischen Umwelt zu überwintern. Ein rätselhaftes Merkmal der nordeuropäischen Serologie der Blauzungenkrankheit ist, dass die Krankheit durch einen bestimmten Stamm (BTV-8) verursacht wurde, der für die Einfälle in Südeuropa verantwortlich war, d. H. Spanien (BTV-4) und Italien (BTV-2).
Die Vorhersage der Auswirkungen des BTV-Eindringens und des besten Designs der Tierhaltung und der Seuchenbekämpfung erfordert modernste Modellierungsmethoden. Es ist viel über die Epidemiologie von BTV bekannt, z. B. ein solides Verständnis der erwarteten Virämieperiode für Rinder- und Schafwirte und die Auswirkung der klimatischen Temperatur auf die Inkubationszeit der Blauzungenkrankheit innerhalb ihres Mückenvektors. Die Abschätzung des räumlich-zeitlichen Risikos durch die Ausbreitung von Vektoren weg von infizierten Wirtstieren bleibt jedoch eine erhebliche Herausforderung. Das Inferenzproblem ist hier multifaktoriell und erfordert nicht nur Parameterinferenz, sondern auch statistisch fundierte Modellauswahl.
Malaria
Malaria folgt dem generischen Übertragungszyklus wie zuvor beschrieben; Der Vektor ist die weibliche Mücke, die ihre Blutmahlzeit als Teil des Fortpflanzungsprozesses nimmt; Die Männchen der Art sind nektarartig und spielen als solche keine Rolle im Übertragungszyklus. Die Häufigkeit der Fütterung wird durch diesen biologischen Bedarf bestimmt, und so liegt die durchschnittliche Fütterungsrate normalerweise bei etwa einmal alle vier Tage, und es wird normalerweise angenommen, dass die Sättigung für eine Charge Eier innerhalb dieser einen Mahlzeit erreicht wird. Es gibt viele verschiedene Arten von Malaria, von denen einige Menschen betreffen (dies kann durch eine von vier verschiedenen Arten von Plasmodium verursacht werden) und andere Tiere betreffen. Die Gattung Anopheles ist für die Übertragung auf den Menschen verantwortlich, von denen etwa nur 30 von 400 Arten überwiegend die Ausbreitung der Infektion verursachen.Ein Schlüsselmerkmal, das Malaria beeinflusst, ist die Temperatur; Selbst wenn die Mücke in dem gegebenen Gebiet lebt, Außentemperaturen von unter etwa 16C (genau gemäßigt ist abhängig von der Art des Parasiten), ist es nicht warm genug, um Entwicklung zu ermöglichen. Im Allgemeinen, da die Temperatur von 16C steigt, desto kürzer ist die Inkubationszeit mit einem plötzlichen Halt über etwa 32C, da der Parasit nicht in der Lage ist, über diese Temperaturen hinaus zu überleben.
Vogelmalaria und der hawaiianische Honeycreeper
Einige Systeme können jedoch weitaus komplexer sein als das oben angegebene allgemeine Beispiel. Ein solches Beispiel ist der hawaiianische Honeycreeper (Drepanididae); Es leidet nicht nur unter den negativen Auswirkungen der Vogelmalaria (Plasmodium relictum), die über die Mücke (Culex quinquefasciatus) übertragen wird, sondern auch unter den Auswirkungen des Klimawandels und der Prädation. Das Zusammenspiel zwischen diesen dominierenden Faktoren ist groß, wobei Temperaturen und die Fülle an Raubtieren den Krankheitsverlauf und die Fähigkeit (oder Unfähigkeit) der Vögel beeinflussen, dem Aussterben zu widerstehen. Darüber hinaus weisen einige Arten des Honeycreeper die Fähigkeit auf, Resistenz gegen Malaria zu verleihen, keine schädlichen Auswirkungen der Krankheit zu erleiden, während sie infektiös bleiben (diese werden häufiger als Träger bezeichnet und verursachen versehentlich ein Infektionsreservoir, indem sie die normale „krankheitsfreie“ Lebenserwartung überleben, sich aber dennoch ausbreiten Infektion.
Diese Arbeit wurde veröffentlicht als:
K. S. Rock et al. „Modellierung der Zukunft des hawaiianischen Honeycreeper: Ein ökologisches und epidemiologisches Problem“. Ökologische Modellierung (Juni 2012)