- 9.5 Verstöße gegen die Oktettregel
- Lernziel
- Beispiel 9
- Key Takeaway
- Warum kann ein ungerades Elektronenmolekül die Oktettregel nicht erfüllen? Warum kann ein Atom in der zweiten Reihe des Periodensystems keine expandierten Valenzschalenmoleküle bilden? Zeichnen Sie ein akzeptables Lewis-Elektronen-Punktdiagramm für diese Moleküle, die gegen die Oktettregel verstoßen. NO2 XeF4 Zeichnen Sie ein akzeptables Lewis-Elektronen-Punktdiagramm für diese Moleküle, die gegen die Oktettregel verstoßen. BCl3 ClO2 Zeichnen Sie ein akzeptables Lewis-Elektronen-Punktdiagramm für diese Moleküle, die gegen die Oktettregel verstoßen. POF3 ClF3 Zeichnen Sie ein akzeptables Lewis-Elektronen-Punktdiagramm für diese Moleküle, die gegen die Oktettregel verstoßen. SF4 BeH2
- Antworten
9.5 Verstöße gegen die Oktettregel
Lernziel
- Erkennen Sie die drei Haupttypen von Verstößen gegen die Oktettregel.
So wichtig und nützlich die Oktettregel bei der chemischen Bindung ist, es gibt einige bekannte Verstöße. Dies bedeutet nicht, dass die Oktettregel nutzlos ist – ganz im Gegenteil. Wie bei vielen Regeln gibt es Ausnahmen oder Verstöße.
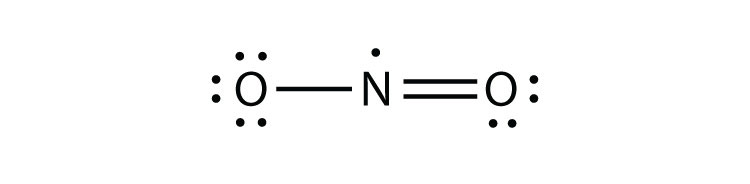
Es gibt drei Verstöße gegen die Oktettregel. Ungerade Elektronenmoleküleein Molekül mit einer ungeraden Anzahl von Elektronen in der Valenzhülle eines Atoms. stellt den ersten Verstoß gegen die Oktettregel dar. Obwohl es nur wenige gibt, haben einige stabile Verbindungen eine ungerade Anzahl von Elektronen in ihren Valenzschalen. Bei einer ungeraden Anzahl von Elektronen muss mindestens ein Atom im Molekül gegen die Oktettregel verstoßen. Beispiele für stabile Ungerade-Elektronen-Moleküle sind NO, NO2 und ClO2. Das Lewis-Elektronen-Punktdiagramm für NO lautet wie folgt:
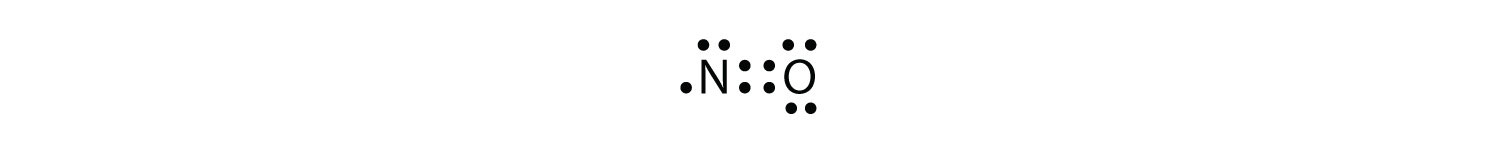
Obwohl das O-Atom ein Oktett von Elektronen hat, hat das N-Atom nur sieben Elektronen in seiner Valenzschale. Obwohl NO eine stabile Verbindung ist, ist es chemisch sehr reaktiv, wie die meisten anderen ungeraden Elektronenverbindungen.
Elektronenarme Moleküleein Molekül mit weniger als acht Elektronen in der Valenzhülle eines Atoms. stellen Sie die zweite Verletzung der Oktettregel dar. Diese stabilen Verbindungen haben weniger als acht Elektronen um ein Atom im Molekül. Die häufigsten Beispiele sind die kovalenten Verbindungen von Beryllium und Bor. Zum Beispiel kann Beryllium zwei kovalente Bindungen bilden, was zu nur vier Elektronen in seiner Valenzschale führt:
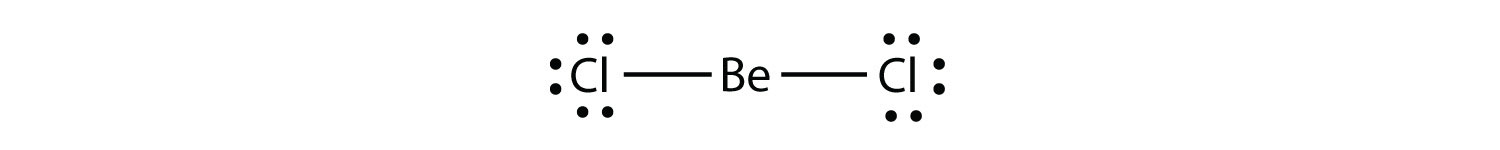
Bor bildet üblicherweise nur drei kovalente Bindungen, was zu nur sechs Valenzelektronen um das B-Atom führt. Ein bekanntes Beispiel ist BF3:
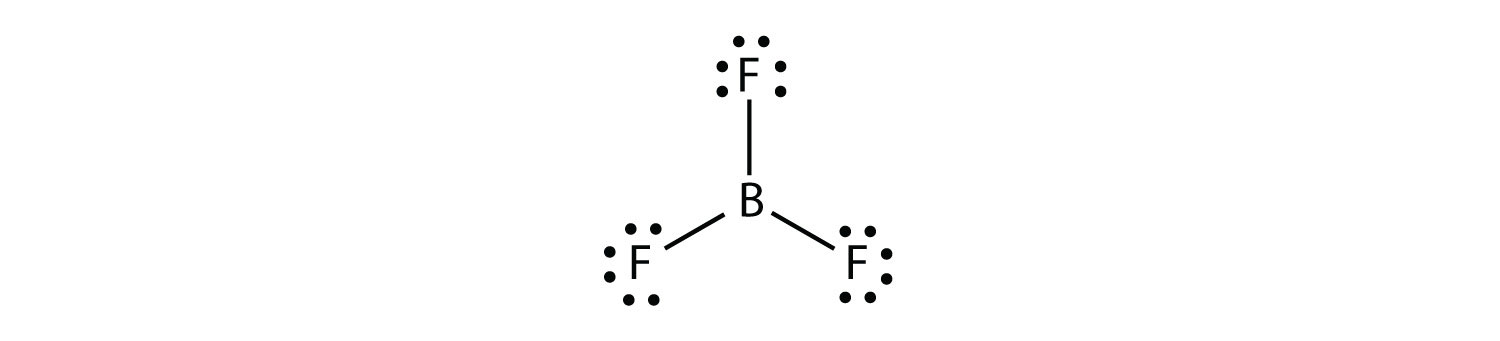
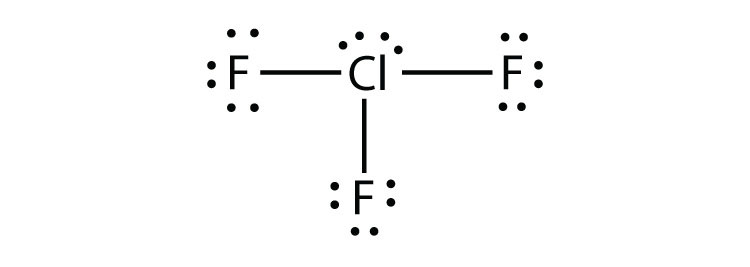
Die dritte Verletzung der Oktettregel findet sich in solchen Verbindungen mit mehr als acht Elektronen, die ihrer Valenzschale zugeordnet sind. Diese werden erweiterte Valenzschalenmoleküle genanntein Molekül mit mehr als acht Elektronen in der Valenzschale eines Atoms.. Solche Verbindungen werden nur von Zentralatomen in der dritten Reihe des Periodensystems oder darüber hinaus gebildet, die leere d-Orbitale in ihren Valenzschalen haben, die an der kovalenten Bindung teilnehmen können. Eine solche Verbindung ist PF5. Das einzige vernünftige Lewis-Elektronen-Punktdiagramm für diese Verbindung hat das P-Atom, das fünf kovalente Bindungen bildet:
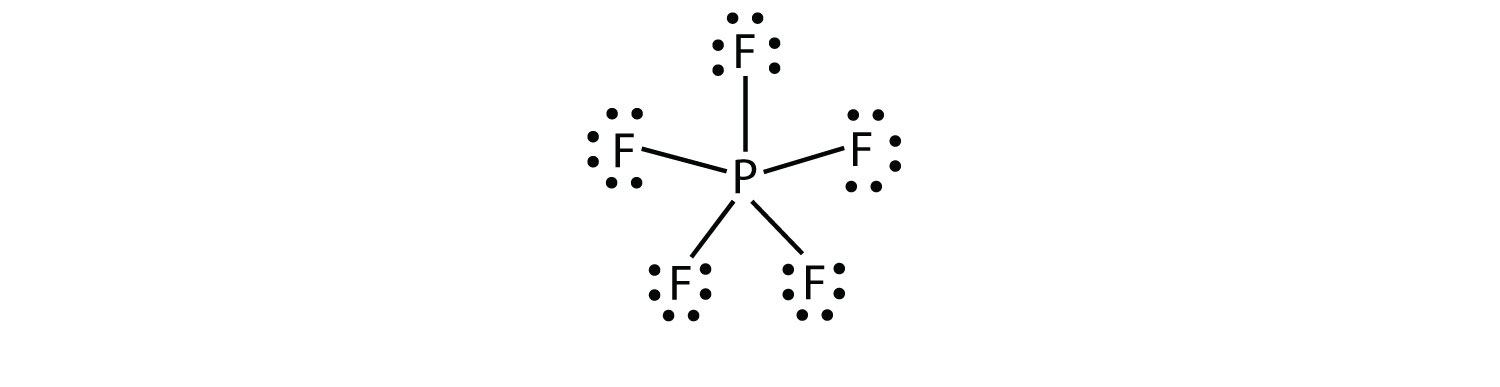
Formal hat das P-Atom 10 Elektronen in seiner Valenzhülle.
Beispiel 9
Identifizieren Sie jeden Verstoß gegen die Oktettregel, indem Sie ein Lewis-Elektronen-Punktdiagramm zeichnen.
- ClO
- SF6
Lösung
-
Mit einem Cl-Atom und einem O-Atom hat dieses Molekül 6 + 7 = 13 Valenzelektronen, es ist also ein ungerades Elektronenmolekül. Ein Lewis-Elektronen-Punktdiagramm für dieses Molekül ist wie folgt:

-
In SF6 bildet das zentrale S-Atom sechs kovalente Bindungen zu den sechs umgebenden F-Atomen, so dass es ein expandiertes Valenzschalenmolekül ist. Sein Lewis-Elektronen-Punktdiagramm ist wie folgt:
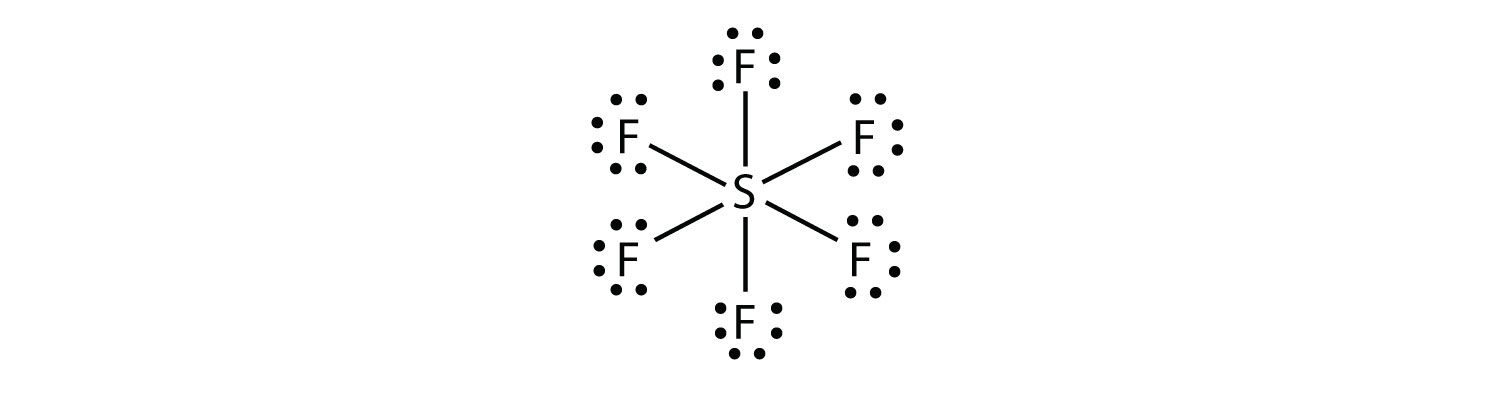
Testen Sie sich selbst
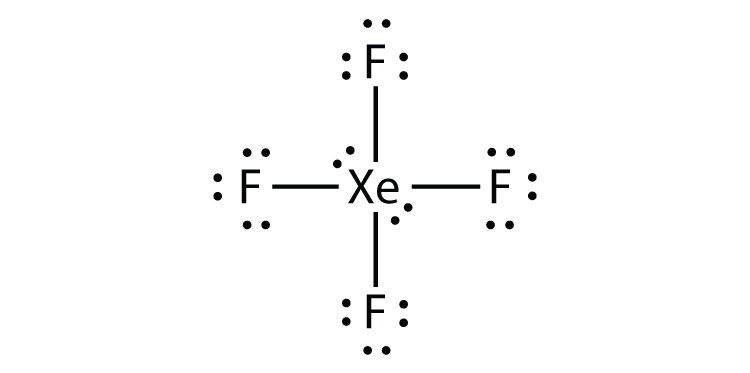
Identifizieren Sie die Verletzung der Oktettregel in XeF2, indem Sie ein Lewis-Elektronen-Punktdiagramm zeichnen.
Antwort
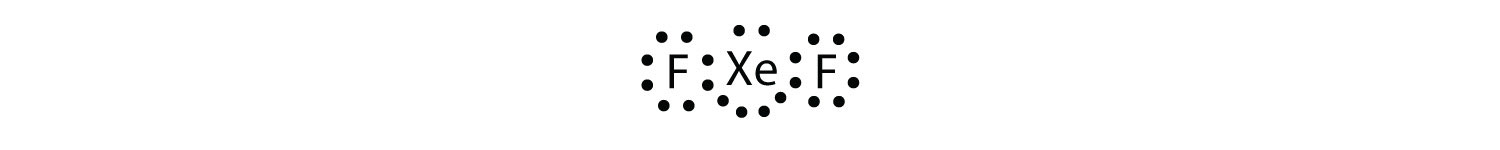
Das Xe-Atom hat eine erweiterte Valenzschale mit mehr als acht Elektronen.
Key Takeaway
- Es gibt drei Verstöße gegen die Oktettregel: Moleküle mit ungeraden Elektronen, Moleküle mit Elektronenmangel und Moleküle mit erweiterter Valenzschale.
-
Warum kann ein ungerades Elektronenmolekül die Oktettregel nicht erfüllen?
-
Warum kann ein Atom in der zweiten Reihe des Periodensystems keine expandierten Valenzschalenmoleküle bilden?
-
Zeichnen Sie ein akzeptables Lewis-Elektronen-Punktdiagramm für diese Moleküle, die gegen die Oktettregel verstoßen.
- NO2
- XeF4
-
Zeichnen Sie ein akzeptables Lewis-Elektronen-Punktdiagramm für diese Moleküle, die gegen die Oktettregel verstoßen.
- BCl3
- ClO2
-
Zeichnen Sie ein akzeptables Lewis-Elektronen-Punktdiagramm für diese Moleküle, die gegen die Oktettregel verstoßen.
- POF3
- ClF3
-
Zeichnen Sie ein akzeptables Lewis-Elektronen-Punktdiagramm für diese Moleküle, die gegen die Oktettregel verstoßen.
- SF4
- BeH2
Warum kann ein ungerades Elektronenmolekül die Oktettregel nicht erfüllen?
Warum kann ein Atom in der zweiten Reihe des Periodensystems keine expandierten Valenzschalenmoleküle bilden?
Zeichnen Sie ein akzeptables Lewis-Elektronen-Punktdiagramm für diese Moleküle, die gegen die Oktettregel verstoßen.
- NO2
- XeF4
Zeichnen Sie ein akzeptables Lewis-Elektronen-Punktdiagramm für diese Moleküle, die gegen die Oktettregel verstoßen.
- BCl3
- ClO2
Zeichnen Sie ein akzeptables Lewis-Elektronen-Punktdiagramm für diese Moleküle, die gegen die Oktettregel verstoßen.
- POF3
- ClF3
Zeichnen Sie ein akzeptables Lewis-Elektronen-Punktdiagramm für diese Moleküle, die gegen die Oktettregel verstoßen.
- SF4
- BeH2
Antworten
-
Es gibt keine Möglichkeit, alle Elektronen zu paaren, wenn es eine ungerade Anzahl von ihnen gibt.
-
-