Generischer Name: Terbutalinsulfat
Darreichungsform: Injektion, Lösung
Medizinisch überprüft von Drugs.com . Zuletzt aktualisiert am 1. September 2020.
- Übersicht
- Nebenwirkungen
- Dosierung
- Professionell
- Wechselwirkungen
- Mehr
Eine sterile wässrige Lösung zur subkutanen Injektion
Nur Rx
WARNUNG: VERLÄNGERTE TOKOLYSE
Terbutalinsulfat wurde nicht zugelassen und sollte nicht für eine verlängerte Tokolyse (über 48-72 Stunden hinaus) verwendet werden. Insbesondere sollte Terbutalinsulfat nicht zur Erhaltungstokolyse im ambulanten oder häuslichen Bereich verwendet werden. Schwerwiegende Nebenwirkungen, einschließlich Tod, wurden nach Verabreichung von Terbutalinsulfat an schwangere Frauen berichtet. Bei der Mutter umfassen diese Nebenwirkungen eine erhöhte Herzfrequenz, vorübergehende Hyperglykämie, Hypokaliämie, Herzrhythmusstörungen, Lungenödem und Myokardischämie. Eine erhöhte fetale Herzfrequenz und eine neonatale Hypoglykämie können als Folge der Verabreichung durch die Mutter auftreten (siehe KONTRAINDIKATIONEN: Verlängerte Tokolyse).
- Terbutalin Beschreibung
- Terbutalin – Klinische Pharmakologie
- Präklinische
- Pharmakokinetik
- Indikationen und Verwendung für Terbutalin
- Gegenanzeigen
- Warnhinweise
- Verschlechterung des Asthmas
- Verwendung von entzündungshemmenden Mitteln
- Kardiovaskuläre Wirkungen
- Krampfanfälle
- Vorsichtsmaßnahmen
- Allgemein
- Wechselwirkungen mit anderen Arzneimitteln
- Karzinogenese, Mutagenese, Beeinträchtigung der Fertilität
- Schwangerschaft -Teratogene Wirkungen
- Anwendung bei Wehen und Entbindung
- Stillende Mütter
- Pädiatrische Anwendung
- Geriatrische Anwendung
- Nebenwirkungen
- Überdosierung
- Dosierung und Anwendung von Terbutalin
- Wie wird Terbutalin geliefert
- HAUPTANZEIGEFELD
- HAUPTANZEIGEFELD PANEL
- SERIALIZATION IMAGE
- Mehr über Terbutalin
- Verbraucherressourcen
- Professionelle Ressourcen
- Verwandte Behandlungsleitfäden
Terbutalin Beschreibung
Terbutalinsulfat, USP, der Wirkstoff der Terbutalinsulfat‑Injektion, USP, ist ein beta-adrenerger Agonist-Bronchodilatator, der als sterile, nicht pyrogene, wässrige Lösung in Fläschchen zur subkutanen Verabreichung erhältlich ist. Jeder Milliliter Lösung enthält 1 mg Terbutalinsulfat, USP (0,82 mg der freien Base), Natriumchlorid zur Isotonisierung, 0,055% Edetat-Dinatriumdihydrat als Stabilisierungsmittel und Salzsäure zur Einstellung auf einen Ziel-pH-Wert von 4. Terbutalinsulfat ist (±) -a – 3,5-Dihydroxybenzylalkoholsulfat (2:1) (Salz). Die Molekülformel ist (C12H19N03) 2 • H2SO4 und die Strukturformel ist:
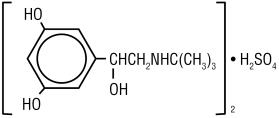
Terbutalinsulfat, USP ist ein weißes bis grauweißes kristallines Pulver. Es ist geruchlos oder riecht schwach nach Essigsäure. Es ist in Wasser und in 0,1 N Salzsäure löslich, in Methanol leicht löslich und in Chloroform unlöslich. Sein Molekulargewicht beträgt 548,65.
Terbutalin – Klinische Pharmakologie
Terbutalinsulfat-Injektion ist ein beta-adrenerger Rezeptoragonist. In vitro und in vivo pharmakologische Studien haben gezeigt, dass Terbutalin eine bevorzugte Wirkung auf beta2‑adrenerge Rezeptoren ausübt. Während erkannt wird, dass beta2-adrenerge Rezeptoren die vorherrschenden Rezeptoren in der glatten Bronchialmuskulatur sind, deuten Daten darauf hin, dass es eine Population von Beta2-Rezeptoren im menschlichen Herzen gibt, die in einer Konzentration zwischen 10% und 50% vorhanden sind. Die genaue Funktion dieser Rezeptoren wurde nicht nachgewiesen (siehe WARNHINWEISE). Kontrollierte klinische Studien bei Patienten, denen Terbutalin subkutan verabreicht wurde, haben keine bevorzugte beta2-adrenerge Wirkung gezeigt.Die pharmakologischen Wirkungen von beta-adrenergen Agonisten, einschließlich Terbutalin, sind zumindest teilweise auf die Stimulation durch beta-adrenerge Rezeptoren der intrazellulären Adenylcyclase zurückzuführen, dem Enzym, das die Umwandlung von Adenosintriphosphat (ATP) in cyclisches 3′,5′-Adenosinmonophosphat (cAMP) katalysiert. Erhöhte cAMP-Spiegel sind mit einer Entspannung der glatten Bronchialmuskulatur und einer Hemmung der Freisetzung von Mediatoren der sofortigen Überempfindlichkeit aus Zellen, insbesondere aus Mastzellen, verbunden.Kontrollierte klinische Studien haben gezeigt, dass die Injektion von Terbutalinsulfat Bronchospasmen bei akuten und chronisch obstruktiven Lungenerkrankungen lindert, indem die Lungenflussraten signifikant erhöht werden (z. B. ein Anstieg des FEV1 um 15% oder mehr). Nach subkutaner Verabreichung von 0, 25 mg Terbutalinsulfat-Injektion tritt normalerweise innerhalb von 5 Minuten eine messbare Änderung der exspiratorischen Flussrate auf, und innerhalb von 15 Minuten tritt ein klinisch signifikanter Anstieg des FEV1 auf. Die maximale Wirkung tritt normalerweise innerhalb von 30 bis 60 Minuten auf, und die klinisch signifikante Bronchodilatatoraktivität kann 1,5 bis 4 Stunden anhalten. Die Dauer der klinisch signifikanten Verbesserung ist vergleichbar mit der bei Equimilligramm-Dosen von Adrenalin beobachteten.
Präklinische
Studien an Labortieren (Minipigs, Nagetiere und Hunde) haben das Auftreten von Herzrhythmusstörungen und plötzlichem Tod (mit histologischen Hinweisen auf Myokardnekrose) gezeigt, wenn Beta-Agonisten und Methylxanthine gleichzeitig verabreicht werden. Die klinische Bedeutung dieser Befunde ist unbekannt.
Pharmakokinetik
Die subkutane Verabreichung von 0,5 mg Terbutalinsulfat an 17 gesunde, erwachsene, männliche Probanden führte zu einer mittleren (SD) maximalen Plasma-Terbutalinkonzentration von 9,6 (3,6) ng/ ml, die bei einer medianen (s) Zeit von 0,5 (0,08 bis 1,0) Stunden nach der Dosierung beobachtet wurde. Die mittlere (SD) AUC (0 bis 48) und die Gesamtkörperclearance betrugen 29,4 (14,2) h•ng/ml bzw. 311 (112) ml/min. Die terminale Halbwertszeit wurde bei 9 der 17 Probanden bestimmt und hatte einen Mittelwert (SD) von 5,7 (2,0) Stunden.
Nach subkutaner Verabreichung von 0, 25 mg Terbutalinsulfat an zwei männliche Probanden wurden etwa 20 Minuten nach der Dosierung maximale Terbutalin-Serumkonzentrationen von 5, 2 und 5, 3 ng/ ml beobachtet.
Die Eliminationshalbwertszeit des Arzneimittels betrug bei 10 von 14 Patienten etwa 2,9 Stunden nach subkutaner Verabreichung, bei den anderen 4 Patienten wurden jedoch längere Eliminationshalbwertszeiten (zwischen 6 und 14 Stunden) gefunden. Etwa 90% des Arzneimittels wurden 96 Stunden nach subkutaner Verabreichung im Urin ausgeschieden, wobei etwa 60% davon unverändert waren. Es scheint, dass das Sulfatkonjugat ein Hauptmetabolit von Terbutalin ist und die Ausscheidung über den Urin der primäre Eliminationsweg ist.
Indikationen und Verwendung für Terbutalin
Terbutalinsulfat-Injektion, USP ist zur Vorbeugung und Umkehrung von Bronchospasmus bei Patienten ab 12 Jahren mit Asthma und reversiblem Bronchospasmus im Zusammenhang mit Bronchitis und Emphysem indiziert.
Gegenanzeigen
1. Verlängerte Tokolyse
Terbutalinsulfat wurde nicht zugelassen und sollte nicht für eine verlängerte Tokolyse (über 48-72 Stunden) verwendet werden. Insbesondere sollte Terbutalinsulfat nicht zur Erhaltungstokolyse im ambulanten oder häuslichen Bereich verwendet werden (siehe WARNHINWEIS: Verlängerte Tokolyse).
2. Überempfindlichkeit
Die Injektion von Terbutalinsulfat ist bei Patienten kontraindiziert, von denen bekannt ist, dass sie überempfindlich auf sympathomimetische Amine oder einen Bestandteil dieses Arzneimittels reagieren.
Warnhinweise
Verschlechterung des Asthmas
Asthma kann sich akut über einen Zeitraum von Stunden oder chronisch über mehrere Tage oder länger verschlechtern. Wenn der Patient mehr Dosen von Terbutalinsulfat als üblich benötigt, kann dies ein Marker für die Destabilisierung von Asthma sein und erfordert eine Neubewertung des Patienten und des Behandlungsschemas unter besonderer Berücksichtigung der möglichen Notwendigkeit einer entzündungshemmenden Behandlung, z. B. Kortikosteroide.
Verwendung von entzündungshemmenden Mitteln
Die Verwendung von beta-adrenergen Agonisten-Bronchodilatatoren allein ist möglicherweise nicht ausreichend, um Asthma bei vielen Patienten zu kontrollieren. Die Zugabe von entzündungshemmenden Mitteln, z. B. Kortikosteroiden, sollte frühzeitig in Betracht gezogen werden.
Kardiovaskuläre Wirkungen
Terbutalinsulfat kann wie alle anderen beta-adrenergen Agonisten bei einigen Patienten eine klinisch signifikante kardiovaskuläre Wirkung hervorrufen, gemessen an Pulsfrequenz, Blutdruck und / oder Symptomen. Obwohl solche Effekte nach Verabreichung von Terbutalinsulfat in empfohlenen Dosen ungewöhnlich sind, muss das Arzneimittel möglicherweise abgesetzt werden, wenn sie auftreten. Darüber hinaus wurde berichtet, dass Beta‑Agonisten Veränderungen im Elektrokardiogramm (EKG) hervorrufen, wie z. B. Abflachung der T-Welle, Verlängerung des QTc-Intervalls und Depression des ST-Segments. Die klinische Bedeutung dieser Befunde ist unbekannt. Daher sollte Terbutalinsulfat wie alle sympathomimetischen Amine bei Patienten mit Herz-Kreislauf-Erkrankungen, insbesondere Koronarinsuffizienz, Herzrhythmusstörungen und Bluthochdruck, mit Vorsicht angewendet werden.
Krampfanfälle
Es gab seltene Berichte über Krampfanfälle bei Patienten, die Terbutalin erhielten; Krampfanfälle traten bei diesen Patienten nach Absetzen des Arzneimittels nicht mehr auf.
Vorsichtsmaßnahmen
Allgemein
Terbutalin sollte wie alle sympathomimetischen Amine bei Patienten mit Herz-Kreislauf-Erkrankungen, einschließlich ischämischer Herzkrankheit, Bluthochdruck und Herzrhythmusstörungen, mit Vorsicht angewendet werden; bei Patienten mit Hyperthyreose oder Diabetes mellitus; und bei Patienten, die ungewöhnlich auf sympathomimetische Amine ansprechen oder an Krampfstörungen leiden. Signifikante Veränderungen des systolischen und diastolischen Blutdrucks wurden beobachtet und könnten bei einigen Patienten nach Anwendung eines beta-adrenergen Bronchodilatators auftreten.
Sofortige Überempfindlichkeitsreaktionen und Exazerbationen von Bronchospasmus wurden nach Verabreichung von Terbutalin berichtet.
Beta-adrenerge Agonistenmedikamente können bei einigen Patienten eine signifikante Hypokaliämie hervorrufen, möglicherweise durch intrazelluläres Shunting, was zu nachteiligen kardiovaskulären Wirkungen führen kann. Die Abnahme ist normalerweise vorübergehend und erfordert keine Ergänzung.Es wurde berichtet, dass hohe Dosen von intravenösem Terbutalin bereits bestehenden Diabetes mellitus und Ketoazidose verschlimmern.
Wechselwirkungen mit anderen Arzneimitteln
Die gleichzeitige Anwendung von Terbutalinsulfat-Injektionen mit anderen Sympathomimetika wird nicht empfohlen, da die kombinierte Wirkung auf das Herz-Kreislauf-System für den Patienten schädlich sein kann.
Monoaminoxidasehemmer oder trizyklische Antidepressiva:Terbutalin sollte Patienten, die mit Monoaminoxidasehemmern oder trizyklischen Antidepressiva behandelt werden, oder innerhalb von 2 Wochen nach Absetzen solcher Mittel mit äußerster Vorsicht verabreicht werden, da die Wirkung von Terbutalin auf das Gefäßsystem potenziert werden kann.
Betablocker: Beta-adrenerge Rezeptorblocker blockieren nicht nur die pulmonale Wirkung von Beta-Agonisten wie der Injektion von Terbutalinsulfat, sondern können bei Asthmatikern auch schwere Bronchospasmen hervorrufen. Daher sollten Patienten mit Asthma normalerweise nicht mit Betablockern behandelt werden. Unter bestimmten Umständen, z. B. als Prophylaxe nach Myokardinfarkt, kann es jedoch keine akzeptablen Alternativen zur Verwendung von beta-adrenergen Blockern bei Patienten mit Asthma geben. In diesem Fall könnten kardioselektive Betablocker in Betracht gezogen werden, obwohl sie mit Vorsicht angewendet werden sollten.
Diuretika: Die EKG-Veränderungen und / oder Hypokaliämie, die sich aus der Verabreichung von nichtkaliumsparenden Diuretika (wie Schleifen- oder Thiaziddiuretika) ergeben können, können durch Beta-Agonisten akut verschlimmert werden, insbesondere wenn die empfohlene Dosis des Beta-Agonisten überschritten wird. Obwohl die klinische Bedeutung dieser Wirkungen nicht bekannt ist, wird bei gleichzeitiger Anwendung von Beta-Agonisten mit nicht kaliumsparenden Diuretika Vorsicht geboten.
Karzinogenese, Mutagenese, Beeinträchtigung der Fertilität
In einer 2-Jahres-Studie an Sprague‑Dawley-Ratten verursachte Terbutalinsulfat eine signifikante und dosisabhängige Zunahme der Inzidenz von benignen Leiomyomen des Mesovariums bei diätetischen Dosen von 50 mg / kg und darüber (ungefähr das 810-fache der maximal empfohlenen subkutanen Tagesdosis (sc) für Erwachsene auf mg / m2-Basis). In einer 21-monatigen Studie an CD-1-Mäusen zeigte Terbutalinsulfat bei diätetischen Dosen von bis zu 200 mg / kg (ungefähr das 1.600-fache der empfohlenen maximalen täglichen SC-Dosis für Erwachsene auf mg / m2-Basis) keine Hinweise auf Tumorgenität. Das Mutagenitätspotential von Terbutalinsulfat wurde nicht bestimmt.Reproduktionsstudien an Ratten, die Terbutalinsulfat verwendeten, zeigten keine Beeinträchtigung der Fertilität bei oralen Dosen von bis zu 50 mg/kg (ungefähr das 810-fache der empfohlenen maximalen täglichen SC-Dosis für Erwachsene auf mg / m2-Basis).
Schwangerschaft -Teratogene Wirkungen
Schwangerschaftskategorie C
Es liegen keine ausreichenden und gut kontrollierten Studien zu Terbutalinsulfat bei Schwangeren vor. Veröffentlichte Tierstudien zeigen, dass Rattennachkommen Veränderungen im Verhalten und in der Gehirnentwicklung aufweisen, einschließlich einer verminderten Zellproliferation und -differenzierung, wenn Muttertiere im späten Stadium der Schwangerschaft und Stillzeit subkutan mit Terbutalin behandelt wurden. Die Terbutalin-Exposition in Ratten-Muttertieren betrug ungefähr das 24- bis 48-fache der üblichen Humandosis bei Erwachsenen von 2-4 mg / Tag auf mg / m2-Basis.
Terbutalinsulfat wurde nicht zugelassen und sollte nicht für eine verlängerte Tokolyse (über 48-72 Stunden hinaus) verwendet werden. Insbesondere sollte Terbutalinsulfat nicht zur Erhaltungstokolyse im ambulanten oder häuslichen Bereich verwendet werden. Schwerwiegende Nebenwirkungen, einschließlich Tod, wurden nach Verabreichung von Terbutalinsulfat an schwangere Frauen berichtet. Bei der Mutter umfassen diese Nebenwirkungen eine erhöhte Herzfrequenz, vorübergehende Hyperglykämie, Hypokaliämie, Herzrhythmusstörungen, Lungenödem und Myokardischämie. Eine erhöhte fetale Herzfrequenz und eine neonatale Hypoglykämie können als Folge der Verabreichung durch die Mutter auftreten (siehe WARNHINWEIS: Verlängerte Tokolyse und KONTRAINDIKATIONEN: Verlängerte Tokolyse).
In tierembryofetalen Entwicklungsstudien wurden keine teratogenen Wirkungen bei Nachkommen beobachtet, wenn trächtige Ratten und Kaninchen Terbutalinsulfat in oralen Dosen von bis zu 50 mg / kg / Tag erhielten, etwa das 810-fache bzw. das 1.600-fache der maximal empfohlenen täglichen subkutanen Dosis für Erwachsene auf mg / m2-Basis.
Terbutalinsulfat sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
Anwendung bei Wehen und Entbindung
Aufgrund des Potenzials einer Störung der Uteruskontraktilität durch Beta-Agonisten sollte die Anwendung der Terbutalinsulfat-Injektion zur Linderung von Bronchospasmus während der Wehen auf Patienten beschränkt werden, bei denen der Nutzen das Risiko deutlich überwiegt.
Terbutalin passiert die Plazenta. Nach einmaliger intravenöser Verabreichung von Terbutalin an 22 Frauen in der späten Schwangerschaft, die aus klinischen Gründen durch einen elektiven Kaiserschnitt entbunden wurden, lagen die Nabelschnurblutspiegel von Terbutalin zwischen 11% und 48% der mütterlichen Blutspiegel.
Stillende Mütter
Es ist nicht bekannt, ob dieses Arzneimittel in die Muttermilch übergeht. Daher sollte die Terbutalinsulfat-Injektion während der Stillzeit nur angewendet werden, wenn der potenzielle Nutzen das mögliche Risiko für das Neugeborene rechtfertigt.
Pädiatrische Anwendung
Die Injektion von Terbutalinsulfat wird für Patienten unter 12 Jahren nicht empfohlen, da die klinischen Daten zur Feststellung der Sicherheit und Wirksamkeit unzureichend sind.
Geriatrische Anwendung
Klinische Studien zur Injektion von Terbutalinsulfat umfassten keine ausreichende Anzahl von Probanden ab 65 Jahren, um festzustellen, ob sie anders als jüngere Probanden ansprechen. Andere berichtete klinische Erfahrungen haben keine Unterschiede in den Reaktionen zwischen älteren und jüngeren Patienten festgestellt. Im Allgemeinen sollte die Dosisauswahl für einen älteren Patienten vorsichtig sein und normalerweise am unteren Ende des Dosierungsbereichs beginnen, was die größere Häufigkeit einer verminderten Leber-, Nieren- oder Herzfunktion sowie einer Begleiterkrankung oder einer anderen medikamentösen Therapie widerspiegelt.
Nebenwirkungen
Nebenwirkungen, die bei der Injektion von Terbutalinsulfat beobachtet wurden, ähneln denen, die häufig bei anderen Sympathomimetika beobachtet werden. Alle diese Reaktionen sind vorübergehender Natur und erfordern normalerweise keine Behandlung.
Die folgende Tabelle vergleicht Nebenwirkungen, die bei Patienten beobachtet wurden, die mit Terbutalinsulfat-Injektion (0, 25 mg und 0, 5 mg) behandelt wurden, mit denen, die bei Patienten beobachtet wurden, die mit Epinephrin-Injektion (0, 25 mg und 0, 5 mg) behandelt wurden, während acht doppelblinden Crossover-Studien mit insgesamt 214 Patienten.
| Incidence (%) of Adverse Reactions | |||||
| Terbutaline (%) | Epinephrine (%) | ||||
|
0.25 mg |
0.5 mg N = 205 |
0.25 mg N = 153 |
0.5 mg N = 61 |
||
| Reaction Central Nervous System |
|||||
| Tremor | 7.8 | 38.0 | 16.3 | 18.0 | |
| Nervousness | 16.9 | 30.7 | 8.5 | 31.1 | |
| Dizziness | 1.3 | 10.2 | 7.8 | 3.3 | |
| Headache | 7.8 | 8.8 | 3.3 | 9.8 | |
| Drowsiness | 11.7 | 9.8 | 14.4 | 8.2 | |
| Cardiovascular | |||||
| Palpitations | 7.8 | 22.9 | 7.8 | 29.5 | |
| Tachycardia | 1.3 | 1.5 | 2.6 | 0.0 | |
| Respiratory | |||||
| Dyspnea | 0.0 | 2.0 | 2.0 | 0.0 | |
| Chest discomfort | 1.3 | 1.5 | 2.6 | 0.0 | |
| Gastrointestinal | |||||
| Nausea/vomiting | 1.3 | 3.9 | 1.3 | 11.5 | |
| Systemic | |||||
| Weakness | 1.3 | 0.5 | 2.6 | 1.6 | |
| Flushed feeling | 0.0 | 2.4 | 1.3 | 0.0 | |
| Sweating | 0.0 | 2.4 | 0.0 | 0.0 | |
| Pain at injection site | 2.6 | 0.5 | 2,6 | 1,6 | |
Hinweis: Einige Patienten erhielten mehr als eine Dosierung Stärke von Terbutalin sulfat und Adrenalin. Darüber hinaus gab es Berichte über Angstzustände, Muskelkrämpfe und Mundtrockenheit (< 0,5%). Es gab seltene Berichte über Erhöhungen der Leberenzyme und über Überempfindlichkeitsvaskulitis bei Verabreichung von Terbutalin.
Um VERMUTETE NEBENWIRKUNGEN zu melden, wenden Sie sich an Hikma Pharmaceuticals USA Inc.. bei 1-877-233-2001, oder die FDA bei 1-800-FDA-1088 oder www.fda.gov/medwatch .
Überdosierung
Die mediane letale SC-Dosis von Terbutalinsulfat bei reifen Ratten betrug ungefähr 165 mg / kg (ungefähr das 2.700-fache der maximal empfohlenen täglichen sc-Dosis für Erwachsene auf mg / m2-Basis). Die mediane letale SC-Dosis von Terbutalinsulfat bei jungen Ratten betrug ungefähr 2.000 mg / kg (ungefähr das 32.000-fache der maximal empfohlenen täglichen sc-Dosis für Erwachsene auf mg / m2-Basis).
Die erwarteten Symptome bei Überdosierung sind die einer übermäßigen beta-adrenergen Stimulation und / oder das Auftreten oder die Übertreibung eines der unter NEBENWIRKUNGEN aufgeführten Symptome, z. B. Krampfanfälle, Angina pectoris, Hypertonie oder Hypotonie, Tachykardie mit Raten bis zu 200 Schlägen pro Minute, Arrhythmien, Nervosität, Kopfschmerzen, Tremor, trockener Mund, Herzklopfen, Übelkeit, Schwindel, Müdigkeit, Unwohlsein und Schlaflosigkeit. Hypokaliämie kann ebenfalls auftreten. Es gibt kein spezifisches Gegenmittel. Die Behandlung besteht aus dem Absetzen der Terbutalinsulfat-Injektion zusammen mit einer geeigneten symptomatischen Therapie. Die vernünftige Verwendung eines kardioselektiven Beta-Rezeptorblockers kann in Betracht gezogen werden, wobei zu berücksichtigen ist, dass ein solches Medikament Bronchospasmus hervorrufen kann. Es gibt keine ausreichenden Beweise, um festzustellen, ob die Dialyse für eine Überdosierung der Terbutalinsulfat-Injektion von Vorteil ist.
Dosierung und Anwendung von Terbutalin
Durchstechflaschen sollten nur zur subkutanen Verabreichung und nicht zur intravenösen Infusion verwendet werden.
Sterilität und genaue Dosierung können nicht gewährleistet werden, wenn die Durchstechflaschen nicht entsprechend der DOSIERUNG UND VERABREICHUNG verwendet werden.
Unbenutzte Portion nach einmaligem Gebrauch verwerfen.
Die übliche subkutane Dosis der Terbutalinsulfat-Injektion beträgt 0,25 mg, die in den lateralen Deltabereich injiziert werden. Wenn innerhalb von 15 bis 30 Minuten keine signifikante klinische Besserung eintritt, kann eine zweite Dosis von 0, 25 mg verabreicht werden. Wenn der Patient dann nicht innerhalb von weiteren 15 bis 30 Minuten anspricht, sollten andere therapeutische Maßnahmen in Betracht gezogen werden. Die Gesamtdosis innerhalb von 4 Stunden sollte 0,5 mg nicht überschreiten.Hinweis: Parenterale Arzneimittel sollten vor der Verabreichung visuell auf Partikel und Verfärbungen untersucht werden, wann immer Lösung und Behälter dies zulassen.
Wie wird Terbutalin geliefert
Terbutalinsulfat-Injektion, USP, 1 mg / ml, wird in einem Volumen von 1 ml in einem 2 ml Braunglasfläschchen geliefert. Jede Durchstechflasche enthält 1 mg Terbutalinsulfat pro 1 ml Lösung; 0,25 ml Lösung liefern die übliche klinische Dosis von 0,25 mg.
NDC 0143-9375-10 Karton mit 10 Durchstechflaschen.
Bei 20° bis 25°C (68° bis 77°F) lagern.
Vor Licht schützen, indem die Durchstechflaschen bis zur Abgabe im Originalkarton aufbewahrt werden.
Nicht verwenden, wenn die Lösung verfärbt ist.
Unbenutzte Portion nach einmaligem Gebrauch verwerfen.
Hergestellt von:
HIKMA FARMACÊUTICA (PORTUGAL), S. A..
Estrada do Rio da Mó, nº 8, 8A e 8B-Fervença,
2705 – 906 Terrugem SNT,
PORTUGAL
Vertrieben von:
Hikma Pharmaceuticals USA Inc.
Eatontown, NJ 07724 USA
Novaplus ist ein eingetragenes Warenzeichen von Vizient, Inc.
Überarbeitet: Oktober 2020
PIN552-NOV/2
HAUPTANZEIGEFELD
NDC 0143-9375-01 NUR Rx
Terbutalin
SULFAT
INJEKTION, USP
1 mg/ml
NUR ZUR SUBKUTANEN
VERWENDUNG

HAUPTANZEIGEFELD PANEL
NDC 0143-9375-10 NUR Rx
Terbutalin
SULFAT
INJEKTION, USP
1 mg / ml
ZUR SUBKUTANEN
NUR VERWENDEN
10 X 1 ml Einzeldosisflaschen
STERILE, NICHT PYROGENE, WÄSSRIGE
LÖSUNG ZUR SUBKUTANEN INJEKTION.
NICHT VERWENDEN, WENN DIE LÖSUNG VERFÄRBT IST.
HINWEIS: DIE ÜBLICHE EINZELDOSIS BETRÄGT EIN VIERTEL
DES FLÄSCHCHENINHALTS. SEE PRESCRIBING
INFORMATION.
SERIALIZATION IMAGE
| Terbutaline SULFATE Terbutaline sulfate injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Hikma Pharmaceuticals USA Inc. (001230762)
Registrant – HIKMA FARMACEUTICA (PORTUGAL), S. A. (452742943)
Mehr über Terbutalin
- Nebenwirkungen
- Während der Schwangerschaft oder Stillzeit
- Dosierungsinformationen
- Arzneimittelbilder
- Arzneimittelwechselwirkungen
- Alternativen vergleichen
- Preise & Gutscheine
- Auf Englisch
- 11 Bewertungen
- Wirkstoffklasse: adrenerge Bronchodilatatoren
- FDA-Warnungen (1)
Verbraucherressourcen
- Patienteninformationen
- Terbutalin (Fortgeschrittenes Lesen)
- Terbutalin Subkutan (fortgeschrittenes Lesen)
Professionelle Ressourcen
- Verschreibungsinformationen
- Terbutalin (Professionelle Patientenberatung)
- Terbutalin Tabletten (FDA)
Verwandte Behandlungsleitfäden
- Vorzeitige Wehen
- Allergisches Asthma
- Asthma, Wartung
- Asthma, akut
Medizinischer Haftungsausschluss