Wie Sie wissen, ist Dmitri Mendelejew der Vater des Periodensystems. Aber wussten Sie, dass das moderne Periodensystem, das wir verwenden, tatsächlich von einem Wissenschaftler namens Henry Moseley entwickelt wurde? Lassen Sie uns die faszinierende Geschichte hinter dem Periodensystem lernen.
Suggested Videos
Modernes Periodensystem
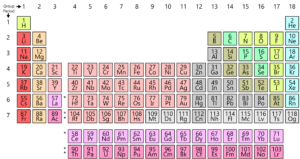
Wie Sie wissen, sind alle Elemente auf der Erde in einem Raster oder einer Matrix angeordnet, die als Modernes Periodensystem bezeichnet wird. Die Anordnung dieser Elemente erfolgt nach einem Muster. Das Periodensystem wurde tatsächlich entwickelt und von Mendelejew in den frühen 1800er Jahren. Es wurde jedoch 1913 von Henry Moseley, einem englischen Physiker, perfektioniert. Durch Anpassungen des periodischen Gesetzes verbesserte er alle Mängel der Mendelejew-Tabelle. Schauen wir uns diese Entwicklung an.
Durchsuchen Sie weitere Themen unter Periodische Klassifikation der Elemente
- Frühere Versuche zur Klassifizierung von Elementen
- Position der Elemente im modernen Periodensystem
- Trends im modernen Periodensystem
Verwendung der Ordnungszahl
Lassen Sie uns zunächst einen Blick auf die Struktur eines Atoms werfen. Jedes Atom besteht aus einem Kern, der aus Protonen und Neutronen besteht. Hier haben die Protonen eine positive Ladung und ein Neutron hat keine Ladung. Jetzt umgeben Elektronen (die eine negative Ladung tragen) den Kern. Nun ist die Atommassenzahl die Gesamtzahl der Protonen und Neutronen in einem Atom. Und die Ordnungszahl ist die Anzahl der Protonen in einem Atom. Diese Ordnungszahl ist für jedes Element einzigartig, was bedeutet, dass jedes Element auf dem Planeten seine eigene eindeutige Ordnungszahl hat.Es war Henry Moseley, der ein besseres Arrangement vorschlug als Mendelejew. Er ordnete die Elemente eher nach ihrer Ordnungszahl als nach ihrer Atommasse an. Auf diese Weise verbesserte er den vorherigen Tisch und beseitigte einige seiner Schwierigkeiten und Anomalien.
Position von Wasserstoff
Mendelejew konnte nie die richtige Position von Wasserstoff in seiner Tabelle herausfinden. Da Wasserstoff entweder ein Elektron gewinnen oder verlieren kann, kann es einen Platz in der Gruppe 1 oder 17 finden. Seine elektronische Konfiguration ähnelt der von Alkalimetallen. Obwohl es sich auch mit Metallen und Nichtmetallen verbinden kann, die kovalente Bindungen wie Halogene bilden.
Aber im modernen Periodensystem gibt es kein Dilemma. Da die Ordnungszahl von Wasserstoff 1 ist, findet er am Anfang der Tabelle seinen entsprechenden Platz.
Isotope
Isotope sind verschiedene Atome eines Elements, von denen jedes die gleiche Anzahl von Protonen, aber eine unterschiedliche Anzahl von Neutronen in ihren Kernen hat. Dies bedeutet, dass, obwohl ihre Atommasse variiert, ihre Ordnungszahl gleich ist. Wie zum Beispiel ist Kohlenstoff-14 ein radioaktives Isotop des Kohlenstoffatoms, das acht Neutronen hat.Während dies für Mendelejew ein Problem darstellte, da die Tabelle von der Atommasse abhing, ist es kein Problem mit dem modernen Periodensystem. Alle Isotope der Elemente haben keine separaten Stellen auf dem Tisch.
Reihenfolge bestimmter Elemente
Mendelejew stand bei der Verwendung der Atommasse zum Anordnen von Elementen vor einem anderen Problem. Es gab bestimmte Fälle, in denen diese Anordnung gebrochen wurde, so dass Elemente mit ähnlichen Eigenschaften in einer Gruppe zusammen waren. Nehmen wir das Beispiel von Jod und Tellur. Jetzt ist die Atommasse von Jod niedriger als Tellur. Und doch stellte Mendelejew es nach Tellur, so dass es in der gleichen Gruppe wie Fluor und Chlor sein könnte.
Im modernen Periodensystem wird die Atommasse irrelevant und Elemente werden anhand ihrer Ordnungszahl mit ähnlichen Elementen gruppiert.
Seltenerdelemente
Das moderne Periodensystem löste ein weiteres Problem, indem es die Seltenerdelemente wie Cer, Lanthan, Erbium usw. in einer separaten Tabelle am Ende des Periodensystems platzierte, um das Periodische Gesetz nicht zu stören.
Gelöstes Beispiel für Sie
Q: Von allen 118 Elementen, die uns bekannt sind, wie viele Elemente kommen natürlich vor?