Schlüsselbegriffe
Stellen Sie sicher, dass Sie die folgenden Schlüsselbegriffe definieren und im Kontext verwenden können.
- Adams’Katalysator
- Hydrierung
Study Notes
Chemische Reaktionen, die heterogen sind, haben Reaktanten, die sich in mindestens zwei verschiedenen Phasen befinden (z. B. Gas mit einem Feststoff), wohingegen homogene Reaktionen in einer einzigen Phase auftreten (z. B. Gas mit einem anderen Gas).
Einige Verwirrung kann aus der Beschreibung des Katalysators entstehen, der bei der Reaktion zwischen Alkenen und Wasserstoff verwendet wird. Drei Metalle – Nickel, Platin und Palladium — werden üblicherweise verwendet, aber ein Chemiker kann nicht einfach ein Stück eines dieser Metalle in eine Mischung aus Alken und Wasserstoff geben und eine Reaktion erhalten. Jeder Metallkatalysator muss auf besondere Weise hergestellt werden:
- Nickel wird normalerweise in einer fein verteilten Form verwendet, die als „Raney-Nickel“ bezeichnet wird.“ Es wird hergestellt, indem eine Ni-Al-Legierung mit NaOH umgesetzt wird.
- Palladium wird kommerziell auf einer inerten Substanz wie Kohle (Pd/C) „geträgert“ erhalten. Das Alken wird üblicherweise in Ethanol gelöst, wenn Pd/C als Katalysator verwendet wird.
- Platin wird als PtO2, Adams ‚Katalysator, verwendet, obwohl es eigentlich Platinmetall ist, das der Katalysator ist. Der zur Anlagerung an die Kohlenstoff-Kohlenstoff-Doppelbindung verwendete Wasserstoff reduziert auch das Platin(IV)-oxid zu feinteiligem Platinmetall. Als Lösungsmittel für das Alken wird Ethanol oder Essigsäure verwendet.
Andere Arten von Verbindungen, die Mehrfachbindungen enthalten, wie Ketone, Ester und Nitrile, reagieren unter den zur Hydrierung von Alkenen verwendeten Bedingungen nicht mit Wasserstoff. Die folgenden Beispiele zeigen die Reduktion eines Alkens, jedoch bleiben die vorhandenen Keton- und Nitrilgruppen intakt und werden nicht reduziert.

Aromatische Ringe werden unter den zur Reduktion von Alkenen verwendeten Bedingungen ebenfalls nicht reduziert, obwohl diese Ringe drei Kohlenstoff-Kohlenstoff-Doppelbindungen zu enthalten scheinen. Wie Sie später sehen werden, enthalten aromatische Ringe keine Doppelbindungen, und viele Chemiker ziehen es vor, den Benzolring als Sechseck mit einem Kreis darin darzustellen

anstatt als Sechseck mit drei alternierenden Doppelbindungen.
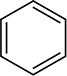
Die Darstellung des Benzolrings wird weiter in Abschnitt 15.2 diskutiert.
Die Reaktion zwischen Kohlenstoff-Kohlenstoff-Doppelbindungen und Wasserstoff liefert eine Methode zur Bestimmung der Anzahl der in einer Verbindung vorhandenen Doppelbindungen. Beispielsweise reagiert ein Mol Cyclohexen mit einem Mol Wasserstoff zu einem Mol Cyclohexan:

aber ein Mol 1,4-Cyclohexadien reagiert mit zwei Mol Wasserstoff zu einem Mol Cyclohexan:
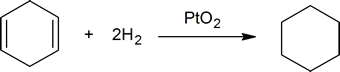
Ein Chemiker würde sagen, dass Cyclohexen mit einem Äquivalent Wasserstoff und 1,4-Cyclohexadien mit zwei Äquivalenten Wasserstoff reagiert. Wenn Sie eine bekannte Menge eines unbekannten, ungesättigten Kohlenwasserstoffs nehmen und bestimmen, wie viel Wasserstoff er absorbiert, können Sie leicht die Anzahl der im Kohlenwasserstoff vorhandenen Doppelbindungen bestimmen (siehe Frage 2 unten).
Die Addition von Wasserstoff an eine Kohlenstoff-Kohlenstoff-Doppelbindung wird Hydrierung genannt. Der Gesamteffekt einer solchen Addition ist die reduktive Entfernung der funktionellen Doppelbindungsgruppe. Regioselektivität ist kein Problem, da an jedes der Doppelbindungskohlenstoffe dieselbe Gruppe (ein Wasserstoffatom) gebunden ist. Die einfachste Quelle für zwei Wasserstoffatome ist molekularer Wasserstoff (H2), aber das Mischen von Alkenen mit Wasserstoff führt zu keiner erkennbaren Reaktion. Obwohl die gesamte Hydrierungsreaktion exotherm ist, verhindert eine hohe Aktivierungsenergie, dass sie unter normalen Bedingungen stattfindet. Diese Einschränkung kann durch die Verwendung eines Katalysators umgangen werden, wie im folgenden Diagramm gezeigt.
Ein Beispiel für eine Alkenadditionsreaktion ist ein Prozess namens hydrogenation.In bei einer Hydrierreaktion werden zwei Wasserstoffatome über die Doppelbindung eines Alkens addiert, was zu einem gesättigten Alkan führt. Die Hydrierung einer Doppelbindung ist eine thermodynamisch günstige Reaktion, da sie ein stabileres (energieärmeres) Produkt bildet. Mit anderen Worten, die Energie des Produkts ist niedriger als die Energie des Reaktanten; Somit ist es exotherm (Wärme wird freigesetzt). Die freigesetzte Wärme wird als Hydrierungswärme bezeichnet, die ein Indikator für die Stabilität eines Moleküls ist.


Katalysatoren sind Substanzen, die die Geschwindigkeit (Geschwindigkeit) einer chemischen Reaktion verändern, ohne verbraucht zu werden oder als Teil des Produkts zu erscheinen. Katalysatoren wirken, indem sie die Aktivierungsenergie von Reaktionen senken, aber sie ändern nicht die relative potentielle Energie der Reaktanten und Produkte. Feinteilige Metalle wie Platin, Palladium und Nickel gehören zu den am weitesten verbreiteten Hydrierkatalysatoren. Die katalytische Hydrierung erfolgt in mindestens zwei Stufen, wie im Diagramm dargestellt. Zunächst muss das Alken zusammen mit einem Teil des Wasserstoffs an der Oberfläche des Katalysators adsorbiert werden. Als nächstes verschieben sich zwei Wasserstoffatome von der Metalloberfläche zu den Kohlenstoffen der Doppelbindung, und der resultierende gesättigte Kohlenwasserstoff, der schwächer adsorbiert wird, verlässt die Katalysatoroberfläche. Die genaue Art und der Zeitpunkt der letzten Ereignisse sind nicht gut verstanden.

Wie im Energiediagramm gezeigt, ist die Hydrierung von Alkenen exotherm und es wird Wärme freigesetzt, die dem ΔE (grün gefärbt) im Diagramm entspricht. Diese Reaktionswärme kann verwendet werden, um die thermodynamische Stabilität von Alkenen mit unterschiedlicher Anzahl von Alkylsubstituenten an der Doppelbindung zu bewerten. In der folgenden Tabelle sind beispielsweise die Hydriertemperaturen für drei C5H10-Alkene aufgeführt, die das gleiche Alkan-Produkt (2-Methylbutan) ergeben. Da eine große Reaktionswärme einen hochenergetischen Reaktanten anzeigt, sind diese Wärme umgekehrt proportional zu den Stabilitäten der Alkenisomeren. In grober Näherung sehen wir, dass jeder Alkylsubstituent an einer Doppelbindung diese funktionelle Gruppe um etwas mehr als 1 kcal / Mol stabilisiert.
| Alkene Isomer | (CH3)2CHCH=CH2 3-methyl-1-butene |
CH2=C(CH3)CH2CH3 2-methyl-1-butene |
(CH3)2C=CHCH3 2-methyl-2-butene |
|---|---|---|---|
| Heat of Reaction ( ΔHº ) |
–30.3 kcal/mole | –28.5 kcal/mole | –26.9 kcal/mole |

Aus dem hier gezeigten Mechanismus würden wir erwarten, dass die Zugabe von Wasserstoff mit syn-Stereoselektivität erfolgt. Dies ist häufig der Fall, aber die Hydrierkatalysatoren können auch eine Isomerisierung der Doppelbindung vor der Wasserstoffaddition bewirken, wobei die Stereoselektivität unsicher sein kann.

Png
- Bei der Reaktion
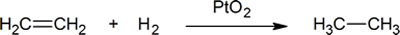
- 0,500 mol Ethen reagieren mit _______ mol Wasserstoff. So könnte ein Chemiker sagen, dass Ethen mit einem _______ von Wasserstoff reagiert.
- Ethen wird _______; während _______ oxidiert wird.
- Die Oxidationszahl von Kohlenstoff in Ethen ist _______; in Ethan ist es _______.
- Wenn 1.000 g eines bestimmten Triglycerids (Fett) mit Wasserstoffgas in Gegenwart von Adams’Katalysator behandelt werden, wird festgestellt, dass das Volumen an Wasserstoffgas, das bei 99,8 kPa und 25,0 ° C verbraucht wird, 162 ml beträgt. Ein separates Experiment zeigt, dass die Molmasse des Fettes 914 g mol−1 beträgt. Wie viele Kohlenstoff-Kohlenstoff-Doppelbindungen enthält die Verbindung?
Antworten:
-
-
Antwort anzeigen
-
Antwort anzeigen
-
Antwort anzeigen
-
-
Antwort anzeigen
Examples
Question
Predict the products if the following alkenes were reacted with catalytic hydrogen.

Solution

Contributors
- Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
- Prof. Steven Farmer (Sonoma State University)
- Organische Chemie mit einem biologischen Schwerpunkt von Tim Soderberg (University of Minnesota, Morris)