- Einführung
- Materialien und Methoden
- Stämme
- DNA-Extraktion
- stx1- und stx2-PCR-Amplifikationen
- DNA-Sequenzierung
- Mikroplatten-Vero-Zellpräparationen
- Zellfreie Bakterienpräparate
- Zytotoxischer Assay und LD50-Bestimmung
- Blockade- und Toxinneutralisationstest
- OMVs-Beschaffung und DNA-Extraktion aus OMVs
- Ergebnisse
- stx1- und stx2-Gen-PCR-Amplifikationen
- DNA-Sequenzierung
- Zytotoxischer Assay und LD50-Bestimmung
- Toxin Neutralisation
- stx1-Gen-PCR-Amplifikationen von OMVs
- Diskussion
- Autorenbeiträge
- Finanzierung
- Erklärung zum Interessenkonflikt
- Danksagung
- Abkürzungen
Einführung
Seit mehreren Jahren ist die Bedeutung von Aeromonas spp. mehrere Studien zeigten, dass der pathogene Mechanismus von Aeromonas multifaktoriell ist, da viele Virulenzfaktoren beteiligt sind, einschließlich der Produktion von Zytotoxinen (Castro-Escarpulli et al., 2002, 2003). Diese Toxine können Durchfall oder hämorrhagische Kolitis verursachen und eine wichtige Rolle bei der Entwicklung des hämolytisch-urämischen Syndroms (HUS) und der TTP spielen (Bogdanović et al., 1991; Fang et al., 1999; Monforte-Cirac et al., 2010).
Zu den Zytotoxinen, die an diesen Krankheiten beteiligt sind, gehören Shiga-Toxin und das eng verwandte Stx. Stx-Varianten werden in Shigella-, Enterobacter-, Citrobacter-, Acinetobacter-, Campylobacter- und Hamiltonella-Bakterienspezies exprimiert (Mauro und Koudelka, 2011). Alperi und Figueras (2010) beschrieben das Vorhandensein von Stx1 und Stx2 in klinischen Isolaten von Aeromonas spp., verbunden mit Gastroenteritis, hämorrhagischer Kolitis und HUS. Gene, die für diese Toxine kodieren, befinden sich in verschiedenen lambdoiden Bakteriophagen, die diesen Stamm lysogenisieren. Darüber hinaus hat die Gattung Aeromonas ein Nullsekretionssystem namens OMVs. OMVs könnten ein Mittel sein, mit dem einige Proteine, RNA, periplasmatische Raumkomponenten und andere mit Virulenz assoziierte Komponenten horizontal auf andere Gattungen übertragen werden können; Daher wird angenommen, dass OMVs eine wichtige Rolle bei der Pathogenität spielen (Guerrero-Mandujano et al., 2015a, b).
Aus diesem Grund war es das Ziel dieser Studie, den Schaden zu bewerten, der durch die Produktion von Stx durch Stämme verursacht wird, die aus Mexiko-Stadt-Kindern in Vero-Zellkulturen isoliert wurden.
Materialien und Methoden
Stämme
Diese Studie umfasste 66 klinische Isolate aus dem INP, 54 aus intestinalen und 12 aus extraintestinalen Infektionen. Stämme wurden aus Proben isoliert, die für Routinetests im genannten Krankenhaus erhalten wurden; Daher war keine Einverständniserklärung der Eltern oder Erziehungsberechtigten von Kindern erforderlich. Alle Stämme wurden genetisch durch 16S rDNA-RFLP identifiziert (Hernández-Cortez et al., 2011). Als Positivkontrolle wurde der typisierte Stamm für Escherichia coli O157:H7 CECT 4076 und als Negativkontrolle für die Toxinproduktion der Stamm E. coli K12 (5512 ENCB) aus der Sammlung des Medical Bacteriology Laboratory (Escuela Nacional de Ciencias Biologicas, IPN) verwendet. Die Stämme wurden für kurze Zeit bei Raumtemperatur auf Schrägen auf Blutagarbasis gehalten; Für eine längere Lagerung wurden sie entweder bei -70 ° C in 20% (w / v) Glycerin-Todd-Hewitt-Brühe (Oxoid, Mexiko) eingefroren oder in 7 lyophilisiert.5% Pferdeglukoseserum.
DNA-Extraktion
Alle Kulturen wurden auf tryptischem Soja-Agar bei 30 ° C für 18 h gezüchtet. Die genomische DNA jedes Stammes wurde durch InstaGene Matrix (BioRad®, Mexiko) gemäß den Anweisungen des Herstellers erhalten. DNA-Reinheit und -quantität wurden unter Verwendung des Spektrofotometers Ampli Quant AQ-07 bestimmt. DNA wurde bis zur Verwendung bei -20 °C gelagert.
stx1- und stx2-PCR-Amplifikationen
Das Vorhandensein von stx1 und stx2 aus DNA von OMVs und genomischer DNA wurde durch einzelne PCR-Reaktionen unter Verwendung der Primer STX1F/STX1R und STXF/STXR mit einem Produkt von 144 bzw. 217 bp nachgewiesen. Diese Primer wurden basierend auf der Sequenz der Untereinheit A. Die Primer, die Reaktions- und Amplifikationsbedingungen wurden wie zuvor von Hernández-Cortez et al. beschrieben al. (2013), mit den positiven (E. coli O157:H7) und negativen (E. coli K12) Kontrollen.
DNA-Sequenzierung
Polymerase-Kettenreaktionsprodukte wurden unter Verwendung eines PureLink Quick Gel Extraction Kit (Invitrogen®, Mexiko) gemäß den Anweisungen des Herstellers gereinigt. Die Produkte wurden direkt auf einem ABI-PRISM 310 Genetic Analyzer (Applied Biosystems, Foster City, CA, USA) unter Verwendung der für die PCR verwendeten Vorwärts- und Rückwärtsprimer gemäß den Anweisungen des Herstellers sequenziert. Die Sequenzierung wurde am Instituto de Biología, UNAM (Mexiko) durchgeführt. Die Sequenzanalyse wurde mit dem Basic Local Alignment Search Tool (BLAST) des National Center for Biotechnology Information (NCBI) durchgeführt.
Mikroplatten-Vero-Zellpräparationen
Dieses Verfahren wurde in 96-Well-Mikroplatten mit Vero (ATCC CCL81) -Zellmonolayer mit 80% Konfluenz unter Zugabe von minimal essentiellem Medium (MEM; Invitro®, Mexiko), ergänzt mit 10% v/ v fetalem Rinderserum (FBS; Invitro®, Mexiko), durchgeführt.
Die Zellsuspension wurde homogenisiert und mit einer Neubauer-Kammer auf 105-106 Zellen/ml eingestellt. Nach dem Einstellen wurde die Suspension in 200 µL Well abgeschieden. Die Mikroplatten wurden 24 h bei 37°C unter 5% CO2 inkubiert (CO2 Incubator, VWR Scientific, USA) (Giono-Cerezo et al., 1994).
Zellfreie Bakterienpräparate
Fünf Kolonien von jeder Blutagarplatte wurden in 3 ml Nährmedium (0,4% Hefeextrakt, 3% Casaminosäuren, 0,05% K2HPO4) inokuliert. Diese wurden 24 h bei 37°C inkubiert und die optische Dichte der verwendeten Bakterienkultur betrug 0,25 bei 600 nm. Zellfreie Präparationen wurden durch Zentrifugieren der Kulturen bei 14.000 g für 10 min bei 4°C und anschließende Filtration des Überstandes durch einen Membranfilter (Porengröße 0,45 pm, Sartorius Minisart NML) hergestellt. Zellfreie Überstände wurden bei -20°C gelagert. Auf diese Weise wurden insgesamt 66 zellfreie Bakterienpräparate erhalten; die Positivkontrolle (E. coli O157:H7) und die Negativkontrolle (E. coli K12) wurden ebenfalls auf die gleiche Weise erhalten (Giono-Cerezo et al., 1994).
Zytotoxischer Assay und LD50-Bestimmung
Das zellfreie Filtrat (20 µL) wurde ohne Antibiotika in Wells mit Zellen und dem jeweiligen Wachstumsmedium inokuliert. Inokulierte Zellen wurden für 96 h bei 37°C mit 5% CO2 inkubiert und alle 24 h am invertierten Mikroskop beobachtet. Es wurde erwartet, dass der zytotoxische Effekt als Abrundung und Schrumpfung von Zellen mit dicker Granulation und schließlich als fortschreitende und irreversible Zerstörung der Monoschicht auftritt. Alle Tests wurden doppelt durchgeführt; Lebensfähigkeitskontrollen mit MEM und Craig-Medium wurden ebenfalls durchgeführt (Giono-Cerezo et al., 1994).
Die LD50 wurde in Aeromonas-Stämmen bestimmt, die als positiv für die Verursachung zytotoxischer Schäden in Vero-Zellen nachgewiesen wurden. Eine Standard-96-Well-Mikroplatte mit Vero-Zellen wurde wie in 2.6 angegeben hergestellt, jedoch wurde das Medium auf 100 µL MEM mit 1% BFS umgestellt. Dieses Präparat wurde 100 µL zellfreier Bakterienpräparation ausgesetzt und an der gesamten Plattenreihe seriell verdünnt. Nach 24 h Inkubation bei 37°C mit 5% CO 2 wurde die LD50 unter dem inversen Mikroskop bestimmt. LD50 wurde der Vertiefung zugeordnet, in der 50% der Vero-Zellen beschädigt und 50% nicht beschädigt waren (Marques et al., 1986).
Blockade- und Toxinneutralisationstest
Der Toxinneutralisationstest wurde an den Stämmen durchgeführt, die zytotoxische Schäden in Vero-Zellen induzierten, da diese Schäden auf Stx hindeuten. Für diesen Test wurde eine Mikroplatte mit Vero-Zellen hergestellt, die zu einer Konfluenz von 90-100% mit der LD50 jeder zellfreien Bakterienpräparation gezüchtet wurden. Zur Durchführung des Neutralisationstests zum Nachweis von Zellschäden, die als Folge der Stx-Wirkung entstehen, wurden zwei monoklonale Antikörper (Universidad Nacional Autónoma de México) aus E. coli O157: H7 verwendet.
Für jedes Ab wurde eine Bradford-Proteinquantifizierung nach Herstellerangaben (Biorad) durchgeführt, mit einem Ergebnis von 78,2 bzw. 74,8 µg/µl anti-Stx1 und Anti-Stx2 A. Das konzentrierte Ab wurde aufgearbeitet und eine doppelte Verdünnung des Ab. Anschließend wurden 10 µL des Ab (anti-STX1 oder anti-STX2) mit 190 µL des zellfreien Überstandes bei einer Konzentration von LD50 für 1 h bei 37°C inkubiert. Anschließend wurden 200 µL des letzteren bei 90% Konfluenz in Vero-Zellen inokuliert und für 24 h bei 37°C mit 5% CO2 inkubiert (Marques et al., 1986).
OMVs-Beschaffung und DNA-Extraktion aus OMVs
Äußere Membranvesikel wurden aus Aeromonas hydrophila F-0050 erhalten. Das Protokoll wurde wie zuvor von Guerrero-Mandujano et al. (2015a).
Die DNA der OMVs wurde durch InstaGene Matrix (BioRad®, Mexiko) gemäß den Anweisungen des Herstellers erhalten. Anschließend wurde die DNA der OMVs mit der DNA-Extraktionsphenol-Chloroform-Technik gereinigt (Guerrero-Mandujano et al., 2015b).
Ergebnisse
stx1- und stx2-Gen-PCR-Amplifikationen
Das Polymerase-Kettenreaktionsscreening von 66 klinischen Aeromonas-Stämmen zeigte, dass 22/66 (33,3%) Stämme das stx1-Gen enthielten, 42/66 (63,6%) Stämme beide Gene enthielten, keine Stämme nur das stx2-Gen enthielten und 2/66 (3%) Stämme für beide Gene negativ waren.
DNA-Sequenzierung
Die BLASTn-Analyse zeigte eine Ähnlichkeit von 79 bis 99% und einen erwarteten Wert von 3e-16/2e-97 zwischen den stx-1 /stx-2-Genen von E. coli O157:H7 und dem Amplikon von Aeromonas spp., mme.
Zytotoxischer Assay und LD50-Bestimmung
Der in Vero-Zellkulturen durchgeführte Zytotoxizitätstest zeigte, dass 17/66 (25,7%) zellfreie Bakterienpräparate zytotoxische Schäden verursachten, was auf die Produktion eines aktiven Stx hindeutet (Abbildung 1), was durch die durch Stx verursachten charakteristischen Schäden aufgedeckt wird.
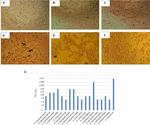
ABBILDUNG 1. Zytotoxizitätstest und LD50-Bestimmung in Vero-Zellkulturen durchgeführt. (A) Vero-Zellkultur mit minimalem essentiellem Medium (Lebensfähigkeitstest). (B) Vero-Zellkultur mit Craig-Medium (Lebensfähigkeitstest). (C) Negativkontrolle mit E. coli K12. (D) Positivkontrolle mit E. coli O157: H7, Zytotoxische Schädigung wird gezeigt (Pfeile) durch Zerstörung der Zellmonoschicht und „Old Lace“ -Effekt. (E) Zytotoxische Schädigung des Stammes A. hydrophila F-0050. (F) Zytotoxische Schädigung des Stammes A. caviae 421423. (G) Grafische Darstellung des LD50-Titers aller Stämme.
Die Ergebnisse zur Bestimmung des LD50-Titers waren wie folgt: 6/17 (35,2%) zellfreie Bakterienpräparate zeigten einen Titer von 1:16; 5/17 (29,4%) zellfreie Bakterienpräparate zeigten einen Titer von 1:8; 3/17 (17,6%) zellfreie Bakterienpräparate hatten einen Titer von 1:64; 2/17 (11,7%) zellfreie Bakterienpräparate mit einem Titer von 1: 32; und 1/17 (5,8%) zellfreie Bakterienpräparate mit einem Titer von 1:256 (Abbildung 1G).
Toxin Neutralisation
Die Anwendung von Anti-STX1 Ab in 11/17 (64.7%) wurde die Schädigung der Zellen im Überstand bei einer Konzentration von 39,1 µg/µL Ab vollständig inhibiert; in 4/17 (23,5%) zellfreien Bakterienpräparaten wurde bei gleicher Konzentration eine verminderte Zellschädigung beobachtet; und in 2/17 (11,7%) zellfreien Bakterienpräparaten wurde die Zellschädigung bei einer Konzentration von 78,2 µg/µL vollständig inhibiert. Die Verwendung des Ab anti-STX2 zeigte, dass in 9/17 (52,9%) zellfreien Bakterienpräparaten die Zellschädigung bei 37,4 µg / µl vollständig gehemmt wurde und 6/17 (35,2%) zellfreie Bakterienpräparate bei gleicher Konzentration eine verringerte Zellschädigung zeigten; und in 2/17 (11.7%) zellfreien Bakterienpräparaten wurde die Zellschädigung mit einer Ab-Konzentration von 74,8 µg/µL vollständig gehemmt (Abbildungen 2 und 3).

ABBILDUNG 2. Hemmung der in Vero-Zellkultur induzierten zytotoxischen Wirkung durch zellfreie Bakterienpräparate von Aeromonas spp. stämme, die das stx1- oder stx2-Gen tragen.
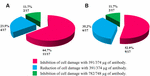
ABBILDUNG 3. Prozentsatz der Stämme, die eine Hemmung oder Verringerung der Zellschädigung zeigten. (A) Neutralisation mit dem Anti-Stx1 Ab. (B) Neutralisation mit dem Anti-Stx2 Ab.
stx1-Gen-PCR-Amplifikationen von OMVs
Polymerase-Kettenreaktion von OMVs’DNA von A. hydrophila F-0050 ergab, dass die OMVs das Gen stx1 enthielten; Daher könnte OMVs ein potenzielles Vehikel für den horizontalen Virulenzgen-Transfer sein (Abbildung 4).
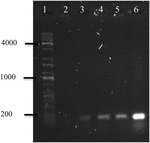
ABBILDUNG 4. Elektropherogramm der stx1-Genamplifikation aus der DNA von OMVs. (1) Kapa Universalleiter, (2) Negativkontrolle, (3) OMVs von A. hydrophila F-0050, (4) A. hydrophila F-0050, (5) OMVs von E. coli O157:H7 und (6) E. coli O157:H7.
Diskussion
Die Gattung Aeromonas könnte als Produzent von Stx ein aufkommender Erreger sein, der hauptsächlich bei pädiatrischen Patienten Durchfall verursacht (Hernández-Cortez et al., 2011; Figueras und Baez-Hidalgo, 2014). Dennoch ist diese Gattung im medizinischen Bereich relevanter geworden, da sie ein Erreger ist, der HUS verursacht (San Joaquín und Pickett, 1988; Bogdanović et al., 1991; Robson et al., 1992; Fang et al., 1999; Monforte-Cirac et al., 2010).
In dieser Studie fanden wir durch PCR-Amplifikation der stx1- und stx2-Gene, dass 22/66 (33.3%) der Aeromonadenstämme enthielten das stx1-Gen, 42/66 (63,6%) Stämme enthielten beide Gene und es gab keine Stämme, die stx2 allein enthielten. Dies kann dazu führen, dass wir vermuten, dass dieses Gen in den von pädiatrischen Patienten isolierten Aeromonas-Stämmen weit verbreitet ist und dass diese Patienten ein Risiko für die Entwicklung von HUS haben können.
Es gibt nur einen früheren Bericht, in dem die stx-Gene in Aeromonas-Stämmen untersucht wurden, die aus verschiedenen Krankenhäusern in Spanien isoliert wurden; Die erhaltenen Ergebnisse waren, dass 19/80 (23,7%) Stämme das stx1-Gen und nur 1/80 (1.25%) Stamm war für beide Gene positiv (Alperi und Figueras, 2010). Wir sollten jedoch berücksichtigen, dass die Gattung Aeromonas in Spanien ein bekannter gastrointestinaler Erreger ist, der routinemäßig bei Patienten mit gastrointestinalem Profil isoliert wird.
In Mexiko ist diese Gattung nicht in der Liste der Durchfallerreger enthalten und wird nicht isoliert.; infolgedessen ist es schwierig, den Patienten eine Behandlung und eine gute Lebensqualität zu geben, außerdem gibt es keine Statistiken über ihre Prävalenz. Darüber hinaus wird die Gattung aufgrund der sozioökonomischen Bedingungen der mexikanischen Bevölkerung, zu denen Wasserknappheit gehört, relevanter; Dies erleichtert seine Übertragung und erhöht die Möglichkeit, dass HUS zu einem Problem der öffentlichen Gesundheit wird.
Es wurde eine Sequenzierung der Amplikons durchgeführt und eine Blast-Suche durchgeführt, die 79-99% Ähnlichkeit und einen Erwartungswert von 3e-16/2e-97 zwischen den Genen stx1/stx2 im Vergleich zu E. coli O157:H7 zeigte.
Die LD50 wurde bestimmt, um die zytotoxische Schädigung in Vero-Zellkultur zu bewerten; mit diesem Parameter und basierend auf Marques et al. (1986) können die Stämme in niedrige (2 × 101 bis 6 × 102), moderate (103-104) und hohe (105-108) Produktion gruppiert werden (Abbildung 1G). In: Marques et al. (1986) führten eine Studie durch, in der sie einen ähnlichen Test wie in der vorliegenden Studie durchführten, aber mit verschiedenen Stämmen von STEC erhielten sie, dass 262/400 (63%) Stämme als niedrige Stx-Produzenten gruppiert wurden und 48% zytotoxische Schäden verursachten; dennoch wurde bei 40% dieser Stämme die zytotoxische Schädigung mit Anti-Stx-Antikörpern gehemmt.
In der vorliegenden Studie verursachten 25,7% der bakterienfreien Präparate zytotoxische Schäden, die für Stx in Vero-Zellen charakteristisch sind, was auf die Produktion von aktivem Stx hindeutet, alle Aeromonas-Stämme wurden als niedrige Produzenten von Stx gruppiert; In 50-70% der zellfreien Überstände wurde jedoch die Zellschädigung gehemmt, und in 20-30% der zellfreien Überstände wurde die Zellschädigung reduziert (Abbildung 3). Die zellfreien Überstände, in denen die Zellschädigung reduziert wurde Dies könnte auf zwei Varianten des im Überstand vorhandenen Toxins zurückzuführen sein, folglich konnte, da sie immunologisch unterschiedlich sind, die Stx nicht vollständig inhibiert werden und die Zellschädigung blieb bestehen (Marques et al., 1986).
Zwei frühere Studien (Haque et al., 1996; Alperi und Figueras, 2010) erhielten 10,2% bzw. 10,53% Stx1-produzierende Aeromonas-Stämme. Der Grund für einen höheren Prozentsatz an Aeromonas-Stämmen, die aktives Stx produzieren, könnte in der hohen Verfügbarkeit des Stx-Bakteriophagen in der Kultur liegen, da einige STEC-Stämme, die Träger des Stx-Bakteriophagen sind, aus städtischen Abwässern aus Kläranlagen, Abwässern aus Schlachthöfen und Rinderstühlen isoliert wurden (García-Aljaro et al., 2004, 2009). In ähnlicher Weise wurden Transduktionsstudien in vivo mit Stx-Phagen aus E. coli durchgeführt, die intestinale Mikrobiota-Bakterien infizieren können, wodurch Stämmen, die zuvor nicht infiziert waren, die toxigene Eigenschaft verliehen wird (Acheson et al., 1998; Schmidt et al., 1999; Gamage et al., 2003). Das gleiche könnte mit der Gattung Aeromonas passieren, wenn ein gastrointestinales Profil induziert wird, gefolgt von der Tatsache, dass die Gattung Aeromonas die Fähigkeit hat, Virulenzfaktoren in ihrem Genom zu erfassen und zu integrieren, und einer davon ist das Stx-kodierende Gen.
Der Rest der Stämme verursachte zytotonische Schäden in der Zelle, was möglicherweise auf die Produktion anderer Toxine als Stx hindeutet, da Aeromonas eine Gattung ist, die zwei zytotonische Enterotoxine produzieren kann, thermostabile (AST) und thermolabile (ALT) (Figueras und Baez-Hidalgo, 2014), die in Vero-Zellen zytotonische Schäden verursachen können; eine andere Möglichkeit besteht darin, dass die Aeromonas-Stämme mehr als einen Bakteriophagen in ihr Genom eingefügt haben, da nachgewiesen wurde, dass STEC-Stämme mit doppelter Lysogenie Bakteriophagen regulieren können, um die Kapazität der lytischen Zyklusinduktion zu hemmen, was zu einer Abnahme der Stx-Produktion führt, ohne jedoch das Gen zu verlieren (García-Aljaro et al., 2004; Imamovic und Muniesa, 2011). Daher ist es notwendig festzustellen, wie viele Bakteriophagen Aeromonas-Stämme enthalten, einschließlich in der vorliegenden Studie, um das Vorhandensein von Stx-Bakteriophagen und die produzierte Menge an Stx korrelieren zu können.
Andererseits stellt das Vorhandensein von Stx-Bakteriophagen in induzierbaren Aeromonas einen horizontalen Transfermechanismus des stx-Gens dar, ist jedoch nicht der einzige. In neueren Studien wurde festgestellt, dass Aeromonas OMVs produzieren können (Guerrero-Mandujano et al., 2015a) und diese OMVs sind in der Lage, integrierte DNA zu transportieren (Guerrero-Mandujano et al., 2015b). In der vorliegenden Studie amplifizierten wir das stx1-Gen aus der DNA, die aus den OMVs eines A. hydrophila-Stammes klinischen Ursprungs extrahiert wurde und zytotoxische Schäden in Vero-Zellen induzierte, und diese Schäden wurden mit Anti-Stx-Antikörpern gehemmt. Dies deutet darauf hin, dass der Stx-Bakteriophage der Transportmechanismus des stx-Gens ist; Darüber hinaus sind die OMVs und das kürzlich als Transportsystem Typ 0 bezeichnete Transportsystem in der Lage, das stx-Gen interspezies oder Intraspezies zu verbreiten. Dennoch muss bestätigt werden, ob das im OMVs enthaltene Gen vollständig ist. Die in dieser Studie erzielten Ergebnisse stützen die Hypothese, dass das stx-Gen ein weiterer mutmaßlicher Virulenzfaktor von Aeromonas ist, der durch OMVs übertragen werden könnte. Es könnte einen weiteren Mechanismus für den horizontalen Transport des stx-Gens zu anderen Aeromonas-Stämmen und/oder anderen Bakteriengattungen darstellen.
Aus diesem Grund sollte diese Gattung als möglicher Erreger der Gastroenteritis aufgenommen werden, wenn versucht wird, ursächliche Erreger zu identifizieren, und sollte im Rahmen von Standard-Gesundheitsüberwachungsverfahren gemeldet werden.
Autorenbeiträge
IP-M und AG-M führten die Experimente durch und MR-R führte die bioinformatischen Analysen durch und entwarf das Manuskript; CH-C entwarf den Primer; VB-G und JM-L kommentierten und überarbeiteten das Manuskript kritisch; GC-E konzipierte die Studie, beteiligte sich an deren Design und Koordination, bewertete die Daten und entwarf das Manuskript. Alle Autoren haben das endgültige Manuskript gelesen und genehmigt. Wir danken Sofia Marteli Mulia für die freundliche Korrektur des Stils des Manuskripts.
Finanzierung
GC-E und VB-G wurden von Estímulos al Desempeño en Investigación und Comisión y Fomento de Actividades Académicas (Instituto Politécnico Nacional) und Sistema Nacional de Investigadores (SNI, CONACyT) unterstützt. Diese Studie wurde vom Sekretariat für Forschung und Postgraduate des National Polytechnic Institute (SIP 20160609) finanziert. Das SIP-IPN war weder an der Entwicklung des Studiendesigns, der Sammlung, Analyse und Interpretation der Daten, an der Erstellung des Berichts noch an der Entscheidung, das Papier zur Veröffentlichung einzureichen, beteiligt. IP-M und AG-M waren Stipendiaten von CONACyT und BEIFI.
Erklärung zum Interessenkonflikt
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagung
Wir danken Dr. Patricia Arzate Barbosa für die Bereitstellung von Stamm-Isolaten und Dr. Armando Navarro für die Bereitstellung der monoklonalen Antikörper.
Abkürzungen
Ab, Antikörper; HUS, hämolytisch-urämisches Syndrom; INP, Instituto Nacional de Pediatria Mexico; LD50, mittlere letale Dosis; OMVs, Outer membrane vesicles; PCR, Polymerase chain reaction; STEC, Shiga toxin-producing E. coli; Stx, Shiga-like toxin; TTP, Thrombotic thrombocytopenic purpura.
Acheson, D. W., Reidl, J., Zhang, X., Keusch, G. T., Mekalanos, J. J., and Waldor, M. K. (1998). In vivo transduction with shiga toxin 1-encoding phage. Infect. Immun. 66, 4496–4498.
Google Scholar
Alperi, A., and Figueras, M. J. (2010). Humane Isolate von Aeromonas besitzen Shiga-Toxin-Gene (stx1 und stx2), die den virulenten Brückengenvarianten von Escherichia coli sehr ähnlich sind. Clin. Microbiol. Infizieren. 16, 1563-1567. doi: 10.1111/j.1469-0691.2010.03203.x
CrossRef Full Text / Google Scholar
Bogdanovic, R., Čobeljić, M., Markovic, M., Nikolic, V., Ognjanović, M., Sarjanović, L., et al. (1991). Hämolytisch-urämisches Syndrom im Zusammenhang mit Aeromonas hydrophila Enterokolitis. Pädiatrie. Nephrol. 5, 293-295. doi: 10.1007
CrossRef Volltext | Google Scholar
Castro-Escarpulli, G., Aguilera-Arreola, M. G., Giono-Cerezo, S., Hernández-Rodríguez, C. H., Rodriguez-Chacon, M., Soler, F. L., et al. (2002). Die Gattung Aeromonas > Ein wichtiger Erreger in Mexiko? Enf. Infektion. Mike. 22, 206–216.
Google Scholar
Castro-Escarpulli, G., Figueras, M. J., Aguilera-Arreola, M. G., Soler, L., Fernández-Rendón, E., Aparicio, G. O., et al. (2003). Charakterisierung von Aeromonas spp. isoliert aus gefrorenem Fisch, der in Mexiko für den menschlichen Verzehr bestimmt ist. Int. J. Lebensmittel Microbiol. 84, 41–49. doi: 10.1016/S0168-1605(02)00393-8
CrossRef Volltext | Google Scholar
Fang, JS, Chen, JB, Chen, WJ und Hsu, KT (1999). Hämolytisch-harnstoffämisches Syndrom bei einem erwachsenen Mann mit Aeromonas hydrophila Enterokolitis. Nephrol. Zifferblatt. Transplantation. 14, 439–440. doi: 10.1093/ndt/14.2.439
CrossRef Volltext / Google Scholar
Figueras, MJ und Baez-Hidalgo, R. (2014). „Aeromonas“ in Encyclopedia of Food Microbiology, Hrsg. C. A. Batt und M. L. Tortorello (Cambridge, MA: Academic Press), 24-30.
Gamage, S. D., Strasser, J. E., Chalk, C. L. und Weiss, A. A. (2003). Nichtpathogene Escherichia coli können zur Produktion von Shiga-Toxin beitragen. Infizieren. Immun. 71, 3107–3115. doi: 10.1128/IAI.71.6.3107-3115.2003
CrossRef Volltext / Google Scholar
García-Aljaro, C., Muniesa, M., Jofre, J. und Blanch, A. R. (2004). Prävalenz des stx2-Gens in coliformen Populationen aus aquatischen Umgebungen. Appl. ENVIRON. Microbiol. 70, 3535–3540. modell: 10.1128/AEM.70.6.3535-3540.2004
CrossRef Volltext / Google Scholar
García-Aljaro, C., Muniesa, M., Jofre, J. und Blanch, A. R. (2009). Genotypische und phänotypische Diversität unter induzierten, stx2-tragenden Bakteriophagen aus Umwelt-Escherichia coli-Stämmen. Appl. ENVIRON. Microbiol. 75, 329–336. modell: 10.1128/AEM.01367-08
CrossRef Volltext / Google Scholar
Giono-Cerezo, S., Rodríguez-Ángeles, M. G., Rodríguez-Cadena, M. J. und Valdespino-Gómez, J. L. (1994). Identifizierung von Enterotoxinen und Cytotoxinen von Escherichia coli durch Vero-Zellkultur und Festphasenhybridisierung (Colony Blot). Rev. Latinoam. Microbiol. 36, 231–241.
Google Scholar
Guerrero-Mandujano, A., López-Villegas, E. O., Longa-Briseño, A. und Castro-Escarpulli, G. (2015a). Produktion von äußeren Membranvesikeln in einem klinischen Stamm von Aeromonas hydrophila. EC Microbiol. 1, 113–117.
Google Scholar
Guerrero-Mandujano, A., Palma-Martínez, I. und Castro-Escarpulli, G. (2015b). Transport von DNA durch äußere Membranvesikel von Aeromonas hydrophila. EC Microbiol. 2, 354–357.
Google Scholar
Haque, Q. M., Sugiyama, A., Iwade, Y., Midorikawa, Y. und Yamauchi, T. (1996). Durchfall- und Umweltisolate von Aeromonas spp. produzieren Sie ein Toxin ähnlich dem Shiga-ähnlichen Toxin 1. Curr. Microbiol. 32, 239–245. doi: 10.1007/s002849900043
CrossRef Volltext | Google Scholar
Hernández-Cortez, C., Aguilera-Arreola, M. G., Chávez-Méndez, Y., Arzate-Barbosa, P., Lara-Hernandez, A., und Castro-Escarpulli, G. (2011). Genetische Identifizierung von Stämmen von Aeromonas spp. isoliert am nationalen Institut für Pädiatrie. Reverend Enfer. Infecc. Diatrischen. 24, 157–165.
Google Scholar
Hernández-Cortez, C., Méndez-Tenorio, A., Aguilera-Arreola, M. G. und Castro-Escarpulli, G. (2013). Design und Standardisierung von vier Multiplex-Polymerase-Kettenreaktionen zum Nachweis von Bakterien, die Magen-Darm-Erkrankungen verursachen. Afr. In: J. Microbiol. 7, 2673-2681. doi: 10.5897/AJMR2013.5452
CrossRef Volltext | Google Scholar
Imamovic, L. und Muniesa, M. (2011). Quantifizierung und Bewertung der Infektiosität von Shiga-Toxin-kodierenden Bakteriophagen in Rindfleisch und Salat. Appl. ENVIRON. Microbiol. 77, 3536–3540. modell: 10.1128/AEM.02703-10
CrossRef Volltext / Google Scholar
Marques, L. R. M., Moore, MA, Wells, JG, Wachsmuth, IK und O’Brien, AD (1986). Produktion von Shiga-ähnlichem Toxin durch Escherichia coli. J. Infizieren. Dis. 154, 338–341. doi: 10.1093/infdis/154.2.338
CrossRef Volltext / Google Scholar
Mauro, S. A. und Koudelka, G. B. (2011). Shiga-Toxin: Expression, Verteilung und seine Rolle in der Umwelt. Kapitel 3, 608-625. doi: 10.3390/toxins3060608
CrossRef Volltext / Google Scholar
Monforte-Cirac, M. L., Palacian-Ruiz, M. P., Aisa-Iriarte, M. L., und Espuelas-Monge, M. (2010). Hämolytisch-urämisches Syndrom durch Aeromonas: über einen klinischen Fall. Rev. Clin. Geist. 210, 206–207. Ursprungsbezeichnung: 10.1016 / j.cer.2009.08.002
CrossRef Full Text/Google Scholar
Robson, W. L. M., Leung, A. K. C. und Trevenen, C. L. (1992). Hämolytisch-urämisches Syndrom im Zusammenhang mit Aeromonas hydrophila Enterokolitis. Diatrischen. Nephrol. 6, 221–222. doi: 10.1007
CrossRef Volltext / Google Scholar
San Joaquin, V. H. und Pickett, D. A. (1988). Aeromonas-assoziierte Gastroenteritis bei Kindern. Pädiatrie. Infizieren. Dis. J. 7, 53-57. doi: 10.1097/00006454-198801000-00013
CrossRef Volltext / Google Scholar
Schmidt, H., Bielaszewska, M. und Karch, H. (1999). Transduktion von enterischen Escherichia coli-Isolaten mit einem Derivat des Shiga-Toxins 2-kodierenden Bakteriophagen f3538, isoliert aus Escherichia coli O157: H7. Appl. ENVIRON. Microbiol. 65, 3855–3861.
Google Scholar