Der normale Zellstoffwechsel hängt von der Aufrechterhaltung des Blut-pH-Wertes innerhalb sehr enger Grenzen ab (7,35-7,45).
Selbst relativ milde Exkursionen außerhalb dieses normalen pH-Bereichs können schädliche Auswirkungen haben, einschließlich verminderter Sauerstoffzufuhr zu Geweben, Elektrolytstörungen und Veränderungen der Herzmuskelkontraktilität; Das Überleben ist selten, wenn der Blut-pH-Wert unter 6,8 fällt oder über 7,8 steigt.
Das Problemfür den Körper ist, dass der normale Stoffwechsel mit verbunden istkontinuierliche Produktion von Wasserstoffionen (H +) und Kohlendioxid(CO2), die beide dazu neigen, den pH-Wert zu senken. Der Mechanismus, der dieses Problem überwindet und dazu dient, den normalen pH-Wert des Blutes aufrechtzuerhalten(d. H. Die Säure-Basen-Homöostase zu erhalten), ist eine komplexe Synergie vonAktionen mit chemischen Puffern im Blut, den roten Blutkörperchen(Erythrozyten), die im Blut zirkulieren, und der Funktion von dreiorganen: Lunge, Nieren und Gehirn.
Bevor erklärt wird, wie diese fünf Elemente zur allgemeinen Aufrechterhaltung des Blut-pH-Werts beitragen, wäre es hilfreich, einige grundlegende Konzepte schnell zu überprüfen.
- Was ist eine Säure, was ist eine Base und was ist der pH-Wert?
- Was ist ein Puffer? – das Bicarbonat-Puffersystem
- Lungenfunktion, Transport von CO2 und Säure-Basen-Gleichgewicht
- Nieren und Säure-Basen-Gleichgewicht
- STÖRUNGEN DES SÄURE-BASEN-GLEICHGEWICHTS
- Ursachen von Säure-Basen-Störungen
- Respiratorische Azidose – (erhöhter pCO2(a),reduzierter pH-Wert)
- Respiratorische Alkalose – (reduziertpco2(a), erhöhter pH-Wert)
- Metabolische Azidose – (verringerthco3-, verringerter pH-Wert)
- Metabolische Alkalose – (erhöhthco3- , erhöhter pH-Wert)
- Kompensation – eine Folge von Säure-Basen-Störungen
- Gemischte Säure-Basen-Störungen
- Zusammenfassung
- Einige schlugen weiteres Lesen vor
Was ist eine Säure, was ist eine Base und was ist der pH-Wert?
Eine Säure ist eine Substanz, die freisetztwasserstoffionen (H+) bei Dissoziation in Lösung.
Zum Beispiel: Salzsäure (HCl) dissoziiert zu Hydrogenionen und Chloridionen
HCl ![]() H+ + Cl-
H+ + Cl-
Kohlensäure (H2CO3)dissoziiert zuwasserstoff–Ionen und Bicarbonat-Ionen
H2CO3 ![]() H+ + HCO3-
H+ + HCO3-
Wir unterscheiden zwischen starken Säuren wie Salzsäure undschwachen Säuren wie Kohlensäure. Der Unterschied ist, dass starke Säurendissoziieren mehr als schwache Säuren. Folglich ist die Wasserstoffionenkonzentration einer starken Säure viel höher als die einer schwachen Säure.
Eine Base ist eine Substanz, die in Lösung akzeptiertwasserstoffionen.
Zum Beispiel akzeptiert das basische Bicarbonat (HCO3–)Wasserstoffionen, um Kohlensäure zu bilden:
HCO3– + H+ ![]() H2CO3
H2CO3
pH ist eine Skala von 0-14 von Säure und Alkalität. Reines Wasser hat einen pH-Wert von 7 und ist neutral (weder sauer noch alkalisch). pH über 7ist alkalisch und unter 7 sauer. So ist der pH-Wert von Blut (7,35-7,45) istleicht alkalisch, obwohl in der klinischen Medizin der Begriff Alkaloseist, vielleicht verwirrend, reserviert für Blut pH größer als 7.45und der Begriff Azidose ist für einen Blut-pH-Wert von weniger als 7,35 reserviert.
Der pH-Wert ist ein Maß für die Wasserstoffionenkonzentration (H+).Die beiden sind nach folgendem Verwandtgleichung:
pH = – log10
wo ist die Konzentration von Wasserstoffionen inmol pro Liter (mol/ L)
Aus dieser Gleichung
pH 7,4 = H+ Konzentration von 40 nmol / L
pH 7,0 = H+ Konzentration von 100 nmol/L
pH 6,0 = H+ Konzentration von 1000 nmol/L
Es ist klar, dass:
- die beiden Parameter ändern sich umgekehrt; wenn die wasserstoffionenkonzentration zunimmt, fällt der pH-Wert
- Aufgrund der logarithmischen Beziehung ist eine große Änderung der wasserstoffionenkonzentration tatsächlich eine kleine Änderung des pH-Wertes. Wenn Sie beispielsweise die wasserstoffionenkonzentration verdoppeln, sinkt der pH-Wert nur um 0,3
Was ist ein Puffer? – das Bicarbonat-Puffersystem
Puffer sind Chemikalien in Lösung, die die Änderung des pH-Werts minimieren, die auftritt, wenn Säuren durch Aufwippen von Wasserstoffionen hinzugefügt werden. Ein Puffer ist eine Lösung einer schwachen Säure und seinekonjugatbase. Im Blut ist das Hauptpuffersystem das schwachesäure, Kohlensäure (H2CO3) und seine Konjugatbase, Bicarbonat (HCO3–). Um zu erklären, wie dieses System Änderungen des pH-Werts minimiert, nehmen wir an, wir fügen dem Bicarbonatpuffer eine starke Säure, z. B. HCl, hinzu:
Die Säure dissoziiert und setzt Wasserstoffionen frei:
HCl ![]() H+ + Cl-
H+ + Cl-
Der Bicarbonatpuffer „absorbiert“ dann die Wasserstoffionen und bildetkohlensäure im Prozess:
HCO3– + H+ ![]() H2CO3 (Kohlensäure)
H2CO3 (Kohlensäure)
Der wichtige Punkt ist, dass, weil die Wasserstoffionen aus HCl in die schwache Kohlensäure eingebaut wurden, die sich nicht so leicht auflöst, die Gesamtzahl der Wasserstoffionen in der Lösungund damit der pH-Wert ändern sich nicht so stark, wie es in Abwesenheit des Puffers der Fall gewesen wäre.
Obwohl ein Puffer die PH-Änderung stark minimiert, beseitigt er sie nicht, da selbst eine schwache Säure (wie Kohlensäure) bis zu einem gewissen Grad dissoziiert. Der pH-Wert einer Pufferlösung ist eine Funktion der relativen Konzentrationen der Schwachsäure und ihrer konjugierten Base.
pH = 6.1 + log ( /)
Where = Konzentration vonbicarbonat
= Konzentration von Kohlensäure
Diese Beziehung, bekannt als die Henderson-Hasselbalch–Gleichung,zeigt, dass der pH-Wert durch das Verhältnis der Basen-(HCO3-) Konzentration zur Säure-(H2CO3) Konzentration bestimmt wird.
Da Wasserstoffionen dem Bicarbonatpuffer zugesetzt werden:
H+ +HCO3– ![]() H2CO3
H2CO3
Bicarbonat (Base) wird verbraucht (Konzentration nimmt ab) undkohlensäure wird produziert (Konzentration steigt). Wenn Hydrogenionen weiterhin hinzugefügt werden, würde das gesamte Bicarbonat schließlich verbraucht (in Kohlensäure umgewandelt) und es gäbe keinen Puffereffekt – der pH-Wert würde dann stark sinken, wenn mehr Säure hinzugefügt würde.
Wenn jedoch Kohlensäure kontinuierlich aus dem System entfernt und Bicarbonat ständig regeneriert werden könnte, könnte die Pufferkapazität und damit der pH-Wert trotz kontinuierlicher Zugabe von Wasserstoffionen aufrechterhalten werden.
Wie mit mehr Details der Physiologie von klar wirdsäure-Basen-Gleichgewicht, das heißt, was im Körper passiert. Im Wesentlichen sorgen die Lungen für die Entfernung von Kohlensäure (als Kohlendioxid) und die Nieren für eine kontinuierliche Regeneration vonbicarbonat.
Diese Rolle der Lunge hängt von einer einzigen Eigenschaft des Bicarbonat-Puffersystems ab, nämlich der Fähigkeit der Kohlensäure, in Kohlendioxid und Wasser umgewandelt zu werden.
Die folgende Gleichung umreißt die Beziehung aller Elemente des Bicarbonat–Puffersystems, wie es im Körper arbeitet
H+ +HCO3- ![]() H2CO3
H2CO3 ![]() H2O + CO2
H2O + CO2
Es ist wichtig zu beachten, dass die Reaktionen reversibel.Die Richtung ist abhängig von der relativen Konzentration von jedemelement. So zwingt beispielsweise ein Anstieg der Kohlendioxidkonzentration die Reaktion nach links mit erhöhter Bildung von Kohlensäure und letztlich Wasserstoffionen.
Dies erklärt das saure Potential von Kohlendioxid und bringt uns zu dem wichtigen Beitrag, den die Lunge und die roten Blutkörperchen zum allgemeinen Säure-Basen-Gleichgewicht leisten.
Lungenfunktion, Transport von CO2 und Säure-Basen-Gleichgewicht
Eine konstante Menge an CO2 im Blut, die für das normale Säure-Basen-Gleichgewicht essentiell ist, spiegelt ein Gleichgewicht zwischen dem als Ergebnis des Gewebezellstoffwechsels erzeugten und dem von der Lunge ausgeschiedenen wider verbrauchte Luft.
Durch Variation der Geschwindigkeit, mit der Kohlendioxidausscheidet, regulieren die Lungen den Kohlendioxidgehalt des Blutes.Der Ablauf von der Kohlendioxidproduktion in den Geweben bis zur Elimination in der Ausatemluft ist in Fig. 1.Kohlendioxid diffundiert aus Gewebezellen in die Umgebungkapillarblut (Abb. 1a). Ein kleiner Teil löst sich im Blutplasma auf und wird unverändert in die Lunge transportiert.
Aber das meiste diffundiert in rote Zellen, wo es sich mit Wasser verbindet, um Kohlensäure zu bilden.Die Säure dissoziiert mit der Produktion von Wasserstoffionen undbicarbonat. Wasserstoffionen verbinden sich mit desoxygeniertem Hämoglobin(Hämoglobin wirkt hier als Puffer), wodurch ein gefährlicher Abfall des zellulären pH-Werts verhindert wird, und Bicarbonat diffundiert entlang eines Konzentrationsradienten von roten Blutkörperchen zu Plasma.
Somit wird der größte Teil des in den Geweben produzierten Kohlendioxids als Bicarbonat im Blutplasma in die Lunge transportiert.
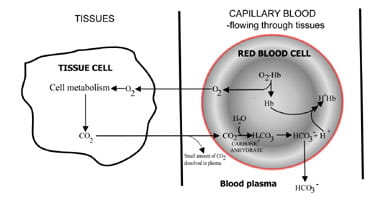
Abb. 1a. In Geweben erzeugtes CO2, das für den Transport in die Lunge in Bicarbonat umgewandelt wird.
|
|
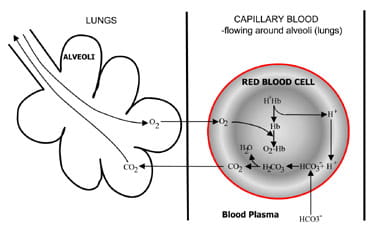
Fig. 1b. At the lungs bicarbonate convertedback to CO2 and eliminated by the lungs.
An den Alveolen in der Lunge ist der Prozess umgekehrt (Abb. 1b).Wasserstoffionen werden aus Hämoglobin verdrängt, da es Sauerstoff aufnehmtaus der eingeatmeten Luft. Die Wasserstoffionen werden nun durch Bicarbonat gepuffert, das aus dem Plasma zurück in die Erythrozyten diffundiert, und es wird Carbonsäure gebildet. Wenn die Konzentration davon ansteigt, ist esumwandelt in Wasser und Kohlendioxid. Schließlich diffundiert Kohlendioxid einen Konzentrationsgradienten von roten Blutkörperchen zu Alveolen forexcretion in der Ausatemluft.
Respiratorische Chemorezeptoren im Hirnstamm reagieren auf Veränderungen der Kohlendioxidkonzentration im Blut, was zu einer erhöhten Belüftung (Atmung) führt, wenn die Kohlendioxidkonzentration ansteigt undabgenommen Belüftung, wenn Kohlendioxid fällt.
Nieren und Säure-Basen-Gleichgewicht
Normaler Zellstoffwechsel führt zu kontinuierlichenproduktion von Wasserstoffionen. Wir haben gesehen, dass durch die kombination mitdiese wasserstoff ionen, die bikarbonat puffer in blut minimizestheir wirkung. Die Pufferung ist jedoch nur kurzfristig sinnvoll,und letztendlich müssen Wasserstoffionen aus dem Körper entfernt werden.Darüber hinaus ist es wichtig, dass das Bicarbonat, das verwendet wirdpuffer Wasserstoffionen wird kontinuierlich ersetzt.
Diese beiden Aufgaben,die Beseitigung von Wasserstoffionen und die Regeneration von Bicarbonat, werden von den Nieren erledigt. Nierentubuluszellen sind reich an derenzym Carboanhydrase, die die Bildung von Carbonsäuresäure aus Kohlendioxid und Wasser erleichtert. Kohlensäure dissoziiert zubicarbonat und Wasserstoffionen. Das Bicarbonat wird resorbiertblut und die Wasserstoffionen gelangen in das Lumen des Tubulus undwerden im Urin aus dem Körper ausgeschieden.
Diese Urinausscheidung istabhängig von der Anwesenheit von Puffern im Urin, hauptsächlich Phosphat- und Ammoniakionen.
STÖRUNGEN DES SÄURE-BASEN-GLEICHGEWICHTS
Die meisten Säure-Basen-Störungen resultieren aus
- Erkrankungen oder Schädigungen von Organen (Niere, Lunge, Gehirn), deren normale Funktion für die Säure-Basen-Homöostase notwendig ist,
- Erkrankungen, die eine abnormal erhöhte Produktion von Stoffwechselsäuren verursachen, so dass homöostatische Mechanismen überfordert sind
- medizinische Eingriffe (z. mechanische Beatmung, einige Medikamente)
Arterielle Blutgase sind der Bluttest zur Identifizierung undÜberwachung von Säure-Base-Störungen. Drei während der Blutgasanalyse gemessene Parameter, der pH-Wert des arteriellen Blutes (pH), der Partialdruck des Kohlendioxids im arteriellen Blut (pCO2(a)) und die Konzentration von Bikarbonat (HCO3–), sind von besonderer Bedeutung (Referenzbereich siehe Tabelle I).Die Ergebnisse dieser drei erlauben die Klassifizierung von Säurebasisstörungen zu einer von vier ätiologischen Kategorien:
- Respiratory acidosis
- Respiratory alkalosis
- Metabolic acidosis
- Metabolic alkalosis
|
Adults |
Neonates |
|
|
pH |
7.35-7.45 |
7.30-7.40 |
|
pCO2 (kPa) |
4.7-6.0 |
3.5-5.4 |
|
Bicarbonate |
22-28 |
15-25 |
TABLE I. Um zu verstehen, wie die Ergebnisse von pH, pCO2(a)und Bicarbonat verwendet werden, um Säure-Base-Störungen auf diese Weise zu klassifizieren, müssen wir zur Henderson-Hasselbalch-Gleichung zurückkehren
pH = 6,1 + log (/ )
Wir messen pH und Bicarbonat, aber nicht Kohlensäure(H2CO3). Es besteht jedoch eine Beziehung zwischen pCO2(a) und h2co3, die eine Neuformulierung der Henderson-Hasselbalch-Gleichung zwischen den drei während der Blutgasanalyse gemessenen Parametern (pH, pCO2 (a) Undbicarbonat) ermöglicht:
pH = 6,1 + log ( /( pCO2(a) × 0.23))
Durch Entfernen aller Konstanten aus dieser Gleichung kann die Beziehung zwischen den drei gemessenen Parametern einfacher erklärt werden:
pH ∝ / pCO2(a)
Diese Beziehung, die für das Verständnis all dessen, was sich aus Säure-Base-Störungen ergibt, entscheidend ist, besagt, dass der arterielle Blut-pH-Wert proportional zum Verhältnis von Bicarbonatkonzentration zu pCO2(a) ist. Es ermöglicht die folgendendeduktionen:
- pH bleibt normal, solange das Verhältnis: pCO2(a) bleibt normal
- pH erhöht (dh Alkalose auftritt), wenn entweder erhöht oder pCO2 (a) abnimmt.
- Der pH-Wert nimmt ab (d.h. Azidose auftritt), wenn entweder abnimmt oder pCO2(a) zunimmt
- Wenn sowohl pCO2(a) als auch um relativ die gleiche Menge erhöht werden, sind das Verhältnis und damit der pH-Wert normal
- Wenn sowohl pCO2(a) als auch um relativ die gleiche Menge verringert werden, sind das Verhältnis und damit der pH-Wert normal.
Säure-Basen-Störungen betreffen in erster Linie beiderpCO2(a), in diesem Fall wird es als Bezeichnetatmungsstörung, oder in diesem Fall heißt es anon-respiratorische oder metabolische Störung:
- Wenn die primäre Störung ein erhöhtes pCO2(a) ist (was Azidose verursacht – siehe oben), wird der Zustand respiratorische Azidose genannt
- Wenn die primäre Störung ein reduziertes pCO2(a) ist (was Alkalose verursacht – siehe oben), wird der Zustand respiratorische Alkalose genannt
- Wenn die primäre Störung mit reduziertem Bicarbonat assoziiert ist (was zu Azidose führt – siehe oben), wird der Zustand metabolische Azidose verbunden mit erhöhtem Bikarbonat (was zu Alkalose führt – siehe oben), wird der Zustand genannt metabolische Alkalose
Ursachen von Säure-Basen-Störungen
Respiratorische Azidose – (erhöhter pCO2(a),reduzierter pH-Wert)
Die respiratorische Azidose ist gekennzeichnet durch ERHÖHTPCO2(a) aufgrund unzureichender Alveolarventilation(Hypoventilation) und folglich verminderter Elimination vonCo2 aus dem Blut. Atemwegserkrankungen wie Bronchopneumonie, Emphysem, Asthma und chronisch obstruktive Atemwegserkrankungen können alle mit einer Hypoventilation einhergehen, die ausreicht, um eine respiratorische Azidose zu verursachen.
Einige Medikamente (z. b. Morphin und Carbiturate) können eine respiratorische Azidose verursachen, indem sie das Atmungszentrum im Gehirn unterdrücken. Schäden oder Traumata an der Brustwand und der an der Atmungsmechanik beteiligten Muskulatur können die Beatmungsrate verringern. Dies erklärt die respiratorische Azidosedas kann den Verlauf von Krankheiten wie Poliomyelitis,Guillain-Barre-Syndrom und Erholung von schweren Brusttrauma erschweren.
Respiratorische Alkalose – (reduziertpco2(a), erhöhter pH-Wert)
Im Gegensatz dazu ist die respiratorische Alkalose durch verminderte gekennzeichnetpco2(a) aufgrund übermäßiger Alveolarventilationund daraus resultierende übermäßige Ausscheidung von CO2 aus dem Blut.Krankheit, in der, wegen des reduzierten Sauerstoffs im Blut (Hypoxämie), therespiratory Zentrum angeregt wird, kann respiratoryalkalosis ergeben.
Beispiele hierfür sind schwere Anämie, Lungenembolismusund erwachsenes respiratorisches Syndrom. Hyperventilation, die ausreicht, um Atemalkalose zu verursachen, kann ein Merkmal von Angstattacken seinantwort auf starke Schmerzen. Eine der weniger willkommenen Eigenschaften vonsalicylat (Aspirin) ist seine stimulierende Wirkung auf die Atemwegezentrum. Dieser Effekt erklärt die respiratorische Alkalosetritt nach Salicylat-Überdosierung auf. Schließlich überbegeistertmechanische Beatmung kann Atemalkalose verursachen.
Metabolische Azidose – (verringerthco3-, verringerter pH-Wert)
Reduziertes Bicarbonat ist immer ein Merkmal des metabolischenazidose. Dies geschieht aus einem von zwei Gründen: erhöhte Verwendung Vonbicarbonat bei der Pufferung einer abnormalen Säurebelastung oder erhöhter Verlust Vonbicarbonat aus dem Körper. Diabetische Ketoazidose und Laktikazidose sind zwei Zustände, die durch Überproduktion vonmetabolische Säuren und daraus resultierende Erschöpfung von Bicarbonat.
Im ersten Fall spiegeln abnormal hohe Blutkonzentrationen von Ketosäuren(b-Hydroxybuttersäure und Acetessigsäure) die schweren metabolischen Störungen wider, die sich aus Insulindefizienz ergeben. Alle Zellen produzieren Milchsäure, wenn ihnen Sauerstoff fehlt, so dass eine erhöhte Milchsäure-Produktion und die daraus resultierende metabolische Azidose in jedem Zustand auftreten, in dem die Sauerstoffzufuhr zu dengewebe ist stark beeinträchtigt.
Beispiele sind Herzstillstand und jeder Zustand, der mit einem hypovolämischen Schock verbunden ist (z. B. massiver Flüssigkeitsverlust). Die Leber spielt eine wichtige Rolle bei der Entfernung der kleinen Menge an Milchsäure, die während des normalen Zellstoffwechsels produziert wird, so dass Laktatazidose ein Merkmal von Leberversagen sein kann.
Abnormaler Verlust von Bicarbonat aus dem Körper kann während auftretenschwerer Durchfall. Wenn dies nicht aktiviert ist, kann dies zu einer metabolischen Azidose führen.Versagen, Bicarbonat zu regenerieren und Wasserstoffionen auszuscheidenerklärt die metabolische Azidose, die bei Nierenerkrankungen auftrittversagen.
Metabolische Alkalose – (erhöhthco3- , erhöhter pH-Wert)
Bicarbonat wird bei metabolischer Alkalose immer erhöht. In seltenen Fällen kann eine übermäßige Verabreichung von Bicarbonat oder die Einnahme von Bicarbonatein Antazida-Präparat metabolische Alkalose verursachen, aber das istnormalerweise vorübergehend. Abnormaler Verlust von Wasserstoffionen aus dem Körper kanndas Hauptproblem sein. Bicarbonat, das sonst bei der Pufferung dieser verlorenen Wasserstoffionen verbraucht würde, sammelt sich folglich im Blut an. Magensaft ist sauer und gastricaspiration oder irgendein Krankheitsprozess, bei dem Mageninhalt istaus dem Körper verloren stellt einen Verlust von Wasserstoffionen dar.
Dieprojektives Erbrechen von Magensaft erklärt zum Beispiel diemetabolische Alkalose, die bei Patienten mit Pyloricstenose auftreten kann. Schwerer Kaliummangel kann metabolische Alkalose verursachenaufgrund der wechselseitigen Beziehung zwischen Wasserstoff und Kaliumionen.
Kompensation – eine Folge von Säure-Basen-Störungen
Es ist lebensnotwendig, dass der pH-Wert nicht zu weit vom Normalwert abweicht, und der Körper wird immer versuchen, einen abnormalen pH-Wert zurückzugebennormal, wenn das Säure-Basen-Gleichgewicht gestört ist. Dieser lebenserhaltende Prozess wird dann nicht kompensiert. Zu verstehenkompensation, es ist wichtig zu erinnern, dass pH ist geregelt durch theratio: pCO2 (ein). Solange das verhältnis ist normal, pH wird normal sein.
Betrachten Sie den Patienten mit metabolischer Azidose, deren pH-Wert niedrig istweil Bicarbonat niedrig ist. Um das Niedrige zu kompensieren und das alles entscheidende Verhältnis zum Normalwert wiederherzustellen, muss der Patient hispCO2 (a) senken. Chemorezeptoren im respiratorischen Zentrum des Gehirns reagieren auf eine steigende Wasserstoffionenkonzentration (niedriger pH-Wert), was zu einer erhöhten Belüftung (Hyperventilation) und einer erhöhten Ausscheidung von Kohlendioxid führt; thepCO2 (a) fällt und das Verhältnis : pCO2 (a) kehrt in den Normalzustand zurück.
Kompensation für metabolische Alkalose, bei der hoch ist, im Gegensatz dazu beinhaltetdepression der Atmung und dadurch Retention von Kohlendioxid, so dass die pCO2(a) steigt entsprechend der Zunahme . Eine Atemdepression hat jedoch die unerwünschte Nebenwirkung, eine angemessene Sauerstoffversorgung der Gewebe zu bedrohen. Aus diesem Grund Atemkompensation vonmetabolische Alkalose ist begrenzt.
Primäre Störungen von pCO2(a) (respiratorische Azidose und Alkalose) werden durch renale Anpassungen der Wasserstoffionenausscheidung kompensiert, die zu Veränderungen führen, die die primäre Veränderung von pCO2(a) angemessen kompensieren. So beinhaltet die renale Kompensation für respiratorische Azidose (erhöhtpCO2 (a)) eine erhöhte Reabsorption von Bicarbonat und die renale Kompensation für respiratorische Alkalose (reduziertpco2 (a)) eine verringerte Bicarbonatabsorption.
Das Konzept des Säure-Basen-Gleichgewichts während der Kompensationwird visuell in Abb. 2. Tabelle II fasst die Blutgasergebnisse zusammen, die alle vier Säure-Basen-Störungen vor und nach der Kompensation charakterisieren.
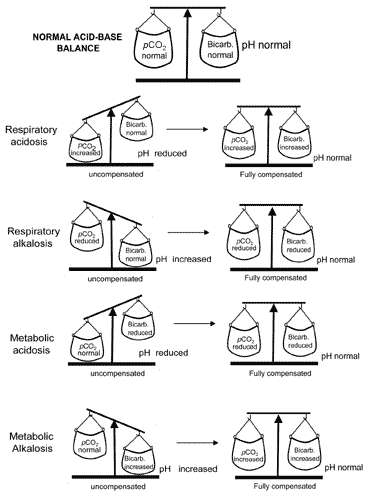
Abb. 2. Das „Säure-Basen-Gleichgewicht“ : compensationrestores normal pH
|
Primary disturbance |
||||
|
Respiratory |
Repiratory |
Metabolic |
Metabolic |
|
|
Some |
Emphysema |
Hyper- |
Renal failure |
Bicarbonate Potassium |
|
Compen- |
RENAL |
RENAL |
RESPIRA- |
RESPIRA- |
|
Initial blood |
pH |
pH |
pH |
pH |
|
Blood gas |
pH pCO2 |
pH pCO2 |
pH pCO2 |
Begrenzte |
|
Blood gas |
pH normal |
pH normal |
pH normal |
Limited |
Druckfreundliche Version der Tabelle, pdf.
TABELLE II. Blutgas führt zu Störungen des Säure-Basen-Gleichgewichts
Atemkompensation bei einer primären Stoffwechselstörungtritt viel schneller auf als metabolische (renale) Kompensation bei einer primären Atemstörung. Im zweiten Fall Kompensationtritt eher über Tage als über Stunden auf.
Wenn die Kompensation dazu führt, dass der pH-Wert wieder normalisiert wird, gilt der Patient als vollständig kompensiert. In vielen Fällen kehrt die Kompensation jedoch zur Normalität zurück, ohne tatsächlich Normalität zu erreichen; in solchen FällenDer Patient soll teilweise kompensiert sein.
Aus den oben beschriebenen Gründen ist die metabolische Alkalose sehr selten vollständigkompensiert.
Gemischte Säure-Basen-Störungen
Aus der obigen Diskussion könnte angenommen werden, dass alle Patienten mit Säure-Basen-Störungen nur an einer der vier Kategorien des Säure-Basen-Gleichgewichts leiden. Dies kann durchaus der Fall sein,aber unter bestimmten Umständen können Patienten mehr als eine Störung aufweisen.
Betrachten Sie zum Beispiel den Patienten mit einer chronischen Krankheit wie Emphysem, der eine langjährige teilweise hatkompensierte respiratorische Azidose. Wenn dieser Patient auch adiabatisch war, der seine normale Insulindosis nicht eingenommen hatte und infolgedessen in einem Zustand der diabetischen Ketoazidose war, würden die Blutgasergebnisse die kombinierte Wirkung sowohl der respiratorischen Azidose als auch der metabolischen Azidose widerspiegeln.
Solche gemischten Säure-Base-Störungen sind nicht selten und können allein auf der Grundlage der arteriellen Blutgasergebnisse schwer zu enträtseln sein.
Zusammenfassung
Die Aufrechterhaltung eines normalen Blut-pH-Wertes umfasst mehrere Organsystemeund hängt von der Kreislaufintegrität ab. Es ist nicht verwunderlich, thenthat Störung des Säure-Basen-Haushaltes kann den Verlauf ofwidely verschiedenen Krankheiten sowie Trauma zu vielen Teilen derbody erschweren. Der Körper hat beträchtliche Energie, Blut pH beizubehalten, anddisturbances bedeutet normalerweise entweder schwere chronische Krankheit oder acutecritic Krankheit.
Die Ergebnisse der arteriellen Blutgasanalyse könnenidentifizieren Sie Säure–Base-Störungen und liefern Sie wertvolle Informationen zu ihrer Ursache.
Einige schlugen weiteres Lesen vor
- Thomson WST, Adams JF, Cowan RA. Klinisches Säure-Basen-Gleichgewicht. Oxford: Oxford Medical Publications 1997
- Harrison RA. Säure-Basen-Gleichgewicht. Respir Care Clin N. America 1995; 1,1: 7-21
- Woodrow P. Arterielle Blutgasanalyse. Pflege Standard 2004; 18,21: 45-52
- Sirker AA, Rhodes A, Gounds RM, Bennet ED. Säure-Basen-Physiologie: der ‚traditionelle‘ und der ‚moderne‘ Ansatz. Anästhesie 2002; 57: 348-56