Die Bestimmung bestimmter Parameter wie Größe, Länge und Winkel im atomaren Maßstab ist nicht einfach. Aufgrund der Bedeutung dieser Parameter haben Wissenschaftler Methoden entwickelt, um die Parameter auf atomarer Ebene abzuleiten oder zu berechnen. Bindungsreihenfolge und Bindungslänge sind zwei so wichtige Parameter, die die Art und Stärke der Bindungen zwischen einem Atompaar angeben.
Dieser Artikel erklärt,
1. Was sind Bindungsreihenfolge und Bindungslänge
2. So berechnen Sie die Bindungsreihenfolge und die Bindungslänge
– So berechnen Sie die Bindungsreihenfolge
– So berechnen Sie die Bindungslänge
Was sind Bindungsreihenfolge und Bindungslänge
Bindungslänge und Bindungsreihenfolge sind zwei Parameter, die kovalenten Bindungen zugeordnet sind. Die Bindungsreihenfolge ist die Anzahl der chemischen Bindungen zwischen zwei Atomen und die Bindungslänge ist der Abstand zwischen zwei Atomkernen, die kovalent miteinander verbunden sind. In diesem Artikel wird erläutert, wie die Bindungsreihenfolge und die Bindungslänge auf atomarer Ebene berechnet werden.
Berechnung der Bindungsreihenfolge
Die Bindungsreihenfolge ist die Anzahl der chemischen Bindungen zwischen zwei Atomen. Es zeigt die Stabilität einer Bindung an. In kovalenten Bindungen ist die Bindungsreihenfolge die Anzahl der gemeinsamen Elektronen. Beispielsweise ist die Bindungsreihenfolge eines durch eine Einfachbindung gebundenen Atompaares eins, während die Bindungsreihenfolge eines durch eine Doppelbindung gebundenen Atompaares zwei ist. Die Nullbindungsreihenfolge zeigt an, dass keine Bindung zwischen Atomen besteht. Die Stabilität eines Moleküls nimmt mit zunehmender Bindungsordnung zu. Die Moleküle mit Resonanzbindung müssen keine ganze Zahl sein. In kovalenten Verbindungen mit zwei Atomen wird die Bindungsreihenfolge zwischen einem Atompaar bestimmt, indem zuerst die Lewis–Struktur gezeichnet und dann die Art der Bindungen zwischen den Atomen bestimmt wird – Nullbindung, Einfach-, Doppel- oder Dreifachbindung. Beispielsweise wird die Bindungsreihenfolge von Wasserstoffgas wie folgt bestimmt.
- Zeichnen Sie die Lewis-Struktur
H: H
- Bestimmen Sie die Anzahl der Bindungen / Paar Valenzelektronen
Ein Elektronenpaar, daher ist die Bindungsreihenfolge 1.
Wenn mehr als zwei Atome vorhanden sind, wird die Bindungsreihenfolge wie folgt bestimmt. Siehe das Beispiel: Nitrationion.
- Zeichnen Sie die Lewis-Struktur
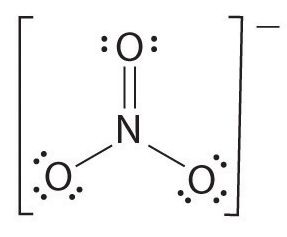
- Zählen Sie die Gesamtzahl der Bindungen (nach Nitrationion, seine 4)
- Die Anzahl der Bindungsgruppen zwischen einzelnen atome (nach Ammoniak, seine 3)
- Daher ist die Bindungsreihenfolge = Gesamtzahl der Bindungen / Anzahl der Bindungsgruppen
= 4/3
= 1,33
Daher ist die Bindungsreihenfolge des Nitrationens 1.33
Berechnung der Bindungslänge
Die Bindungslänge ist der Abstand zwischen zwei Atomkernen, die kovalent miteinander verbunden sind. Die Bindungslänge liegt üblicherweise im Bereich von 0,1 bis 0,2 nm. Wenn zwei ähnliche Atome miteinander verbunden sind, wird die Hälfte der Bindungslänge als kovalenter Radius bezeichnet. Die Bindungslänge hängt von der Anzahl der gebundenen Elektronen zweier Atome oder der Bindungsreihenfolge ab. Je höher die Bindungsreihenfolge ist, desto kürzer ist die Bindungslänge aufgrund starker Zugkräfte positiv geladener Kerne. Die Einheit der Bindungslänge ist Picometer. In Einfach-, Doppel- und Dreifachbindungen erhöht sich die Bindungslänge in der Größenordnung von
Dreifachbindung<Doppelbindung<Einfachbindung
Die Elektronegativität kann verwendet werden, um die Bindungslänge zwischen zwei Atomen mit unterschiedlichen Elektronegativitäten zu berechnen. Die folgende empirische Formel wurde von Shoemaker und Stevenson vorgeschlagen, um die Bindungslänge zu berechnen.
dA-B = rA + rB – 0.09 (xA – xB)
dA-B ist der Bindungsabstand zwischen zwei Atomen A und B, rA und rB sind kovalente Radien von A und B und
(xA – xB) ist der Elektronegativitätsunterschied zwischen A und B.
Eine andere Methode wird verwendet, um die ungefähre Bindungslänge zu berechnen. Bei diesem Verfahren wird zunächst eine Lewis-Struktur gezeichnet, um den kovalenten Bindungstyp zu bestimmen. Verwenden Sie dann ein Diagramm *, das auf den Studien von Cordero et al., und Pyykkö und Atsumi werden die entsprechenden Radien der von jedem Atom gebildeten Bindungen bestimmt. Dann wird die Bindungslänge bestimmt, indem die Summe der beiden Radien genommen wird. Bei der Bestimmung der Bindungslänge von Kohlendioxid wird beispielsweise eine Lewis-Struktur gezeichnet.
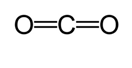
Gemäß der Tabelle beträgt der kovalente Radius der Kohlenstoffdoppelbindung 67 Pikometer und der der Sauerstoffdoppelbindung 57 Pikometer. Daher beträgt die Bindungslänge von Kohlendioxid ungefähr 124 Pikometer (57 pm + 67 pm).
*Kovalente Tabelle finden Sie hier
Referenz:
Cordero, Beatriz, et al. „Kovalente Radien überarbeitet.“ Dalton Transactions 21 (2008): 2832-2838.
Libretexte. „Bond Ordnung und Längen.“ Chemie LibreTexte. Librettexte, 05 Dez. 2016. Web. 10. Januar. 2017.
Lister, Ted und Janet Renshaw. Chemie für Fortgeschrittene verstehen. N.p.: Heinrich von Kleist, 2000. Druck.In:Pratiyogita Darpan. „Eigenschaften von Elementen in Bezug auf ihre elektronische Struktur .“ Wettbewerb Science Vision Aug. 1998: n. pag. Druck.
Pyykkö, Pekka und Michiko Atsumi. „Molekulare doppelbindungskovalente Radien für Elemente Li-E112.“ Chemie-Eine europäische Zeitschrift 15.46 (2009): 12770-12779.
![]()