Zu Beginn des XIX Jahrhunderts beobachtete von Reckinghausen, dass Blutgefäße von einem Zellblatt bedeckt waren. Diese einzellige dicke Schicht besteht aus Endothelzellen, die die innere Oberfläche von Blut- und Lymphgefäßen auskleiden. Beim Menschen wird geschätzt, dass die gesamte Oberfläche der Endothelschicht etwa 35 m2 beträgt und dass es etwa 1 bis 1,6 103 Endothelzellen gibt. Die Gesamtlänge der Arterien, Venen und Kapillaren beträgt etwa 90000 km (mehr als zweimal um die Welt). Endothelzellen sind flach und durch Zellübergänge miteinander verbunden. Ihre Hauptfunktion ist als Vermittler zwischen dem Blut und den anderen Geweben, und dazu beitragen, Bluteigenschaften, sowohl in normalen und pathologischen Geweben. Sie sind auch wichtig für den Austausch von Immunzellen zwischen Blut und Gewebe.
1. Morphologie
Endothelzellen sind sehr abgeflachte Zellen, so dass ihr Kern die größere Struktur der Zelle ist, auch wenn der Kern ebenfalls abgeflacht ist. Die Zellform ist an den Kanal angepasst, den die Endothelzelle auskleidet (Abbildung 1, 2 und 3). In den engeren Kapillaren können Endothelzellen ihr Zytoplasma über den gesamten Umfang des Blutgefäßes erstrecken, so dass der Kanal eine Reihe von Endothelzellen ist. In größeren Kanälen, wie Arterien und Venen, werden viele Endothelzellen benötigt, um den gesamten Umfang des Kanals abzudecken.
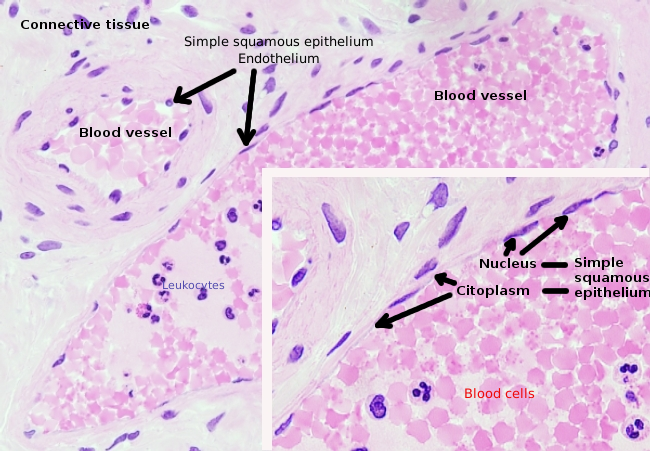
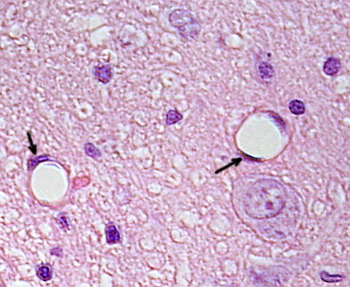
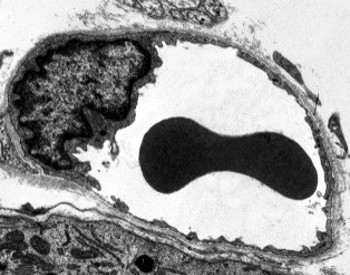
Das perinukleäre Zytoplasma enthält die meisten Mitochondrien und andere Organellen wie den Golgi-Apparat, während das periphere Zytoplasma dünner ist und nur wenige Organellen aufweist, obwohl sich das endoplasmatische Retikulum in der Nähe der Plasmamembran befindet. Endothelzellen haben viele Vesikel, die meisten von ihnen sind endozytäre Vesikel.
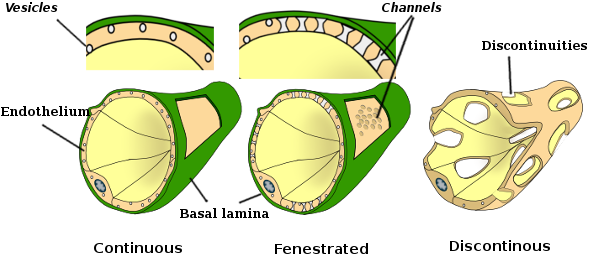
In einigen Regionen, wie Leber, Nierenrinde und endokrinen Drüsen, zeigen Endothelzellen von Kapillaren Poren oder kleine Passagen, die als Fenestratrionen bekannt sind. Sie sind Wege von etwa 60 bis 70 nm Durchmesser mit einem engen Durchgang von etwa 5 nm, die das Blut und die Lymphe direkt mit den anderen Geweben kommunizieren. Kapillaren mit diesen Arten von Endothelzellen werden als fenestrierte Kapillaren bezeichnet. Poren sind in Gruppen verteilt und ihre Dichte hängt von der Art des Endothels ab.
Endothelzellen sind durch eine Schicht extrazellulärer Matrix, die Basallamina genannt wird, vom umgebenden Gewebe getrennt. Endothelzellen tragen mit den Proteinen Laminin, Fibronektin und Kollagen Typ II, IV und V zu dieser Schicht bei.
Quelle und Proliferation
Vaskulogenese ist die Bildung neuer Endothelzellen in Geweben ohne vorbestehende Blutgefäße. Es passiert im Embryo. Bei Erwachsenen und auch bei Embryonen werden aus bereits vorhandenen Blutgefäßen neue Blutgefäße und damit neue Endothelzellen erzeugt. Dieser Prozess wird als Angiogenese bezeichnet. Neue Endothelzellen werden durch Verzweigung oder Teilung von Blut- und Lymphgefäßen produziert. Angiogenese ist häufig in wachsenden Geweben oder solchen unter starkem Umbau, wie der Gebärmutter bei Säugetierweibchen, oder in Pathologien wie Tumoren, Entzündungen und Wunden.
Vaskulogenese
Erste Endothelzellen von Säugetieren werden nach der Gastrulation während der Embryonalentwicklung erzeugt. Sie unterscheiden sich von Zellen, die Angioblasten genannt werden, bilden Gruppen und organisieren sich in kurzen Blutgefäßen. Dieser Prozess findet zuerst im Vitelinsack des Embryos statt. Diese anfänglichen Blutgefäße wachsen und verbinden sich miteinander, um ein Netzwerk zu bilden. Später rekrutieren sie Fibroblasten und Muskelzellen. Dieses anfängliche Netzwerk durchläuft in den nächsten Entwicklungsstadien einen kontinuierlichen Umbauprozess. In Embryonen sind alle Endothelzellen anfangs ähnlich, aber sie werden später in Venen-, Arterien-, Kapillar- und Lymphgefäßendothel differenziert. Mehrere Moleküle wie FGF2, BMP4, IHH und VEGF induzieren getrennte Differenzierungswege. Der Notch-Induktor scheint sehr wichtig zu sein, da er zum Arterienendothel führt, während seine Hemmung zum Venenendothel führt. Das lymphatische Endothel wird aus dem Kardinalvenenendothel gebildet und benötigt die Expression von IGF-II und SOX18. Darüber hinaus wird das Endothel entsprechend dem Organ differenziert, in dem es sich befindet. Zum Beispiel bildet das Endothel eine dicht verschlossene Schicht im Gehirn, um die Blut-Hirn-Schranke zu bilden, während es in der Leber locker organisiert ist, um den Austausch von Molekülen mit dem Blut zu begünstigen.Da sich Endothelzellen in Arterien- und Venengängen organisieren, entstehen aus einigen Endothelzellen hämatopoetische Zellen durch einen Differenzierungsprozess, der als endothel-hämatopoetischer Übergang (EHT) bekannt ist. Dieser Prozess geschieht auch in einigen erwachsenen Geweben wie während der Bildung von Plazenta und anderen Geweben während der Schwangerschaft.
Angiogenese
Angiogenese ist die Bildung neuer Blutgefäße und Endothel durch Verzweigung oder Teilung bereits bestehender Blutgefäße. Bei Erwachsenen ist die Proliferationsrate von Endothelzellen sehr gering. Beispielsweise kann sich bei Säugetieren eine Endothelzelle einmal im Monat teilen oder mehrere Jahre warten. Es bedeutet, dass Angiogenese in Geweben unter normaler Physiologie selten ist, mit Ausnahme der weiblichen Fortpflanzungsorgane. Es kann jedoch bei pathologischen Prozessen wie Gewebeschäden und Tumoren aktiviert werden. Einige Substanzen induzieren Angiogenese, wie endothelialer Wachstumsfaktor (EGF), saurer EGF, Fibroblastenwachstumsfaktor (FGF), transformierender Wachstumsfaktor (TGF) und Prostaglandine. Die Angiogenese beginnt, wenn angiogene Substanzen aus dem umgebenden Gewebe freigesetzt werden. Die Endothelzelle eines nahen Blutgefäßes, normalerweise aus einer Venule, beginnt zur angiogenen Signalquelle zu wandern und die anderen Endothelzellen zu ziehen, die sich zu vermehren beginnen und ein neues Gefäß bilden. Diese Endothelzellen verlieren vorübergehend ihre engen Verbindungen, was zur Freilegung der Basalmembran führt, die durch Enzyme, die aus den Endothelzellen freigesetzt werden, schnell verdaut wird. Einige Endothelzellen gehen durch die verdaute Basalmembran, während die Proliferation weitergeht. All dieser Prozess ermöglicht die Verlängerung und Verzweigung des neuen Blutgefäßes, bis Vaskulogenese Signal verschwindet. Die Spitzen der Blutgefäße verschmelzen mit anderen Blutgefäßen, um geschlossene Kreisläufe zu bilden und den Blutfluss ohne tote Enden zu ermöglichen.
Regionen mit Endothelzellvorläufern wurden in der dorsalen Aorta und im Endokard gefunden. Mesenchymzellen können von Endokardendothelzellen unterschieden werden und bilden die Trikuspidalklappe und einige Fibroblasten des Herzens, jedoch keine Kardiomiozyten. Endothelzellen reagieren so empfindlich auf externe Signale, dass die Aufrechterhaltung der Integrität des Endothels ein aktiver Prozess ist, der durch andere Signale wie FGF vermittelt wird. Der aktive Prozess dient nicht nur der Integrität, sondern auch der Erhaltung des zellulären Phänotyps. Wenn Endothelzellen keine richtigen Signale erhalten, sterben sie durch Apoptose oder werden zu Mesenchymzellen, die reichlich extrazelluläre Matrix synthetisieren können. Der Übergang von der Endothel- zur Mesenchymzelle steht hinter einigen Krankheiten wie Arteriosklerose und fibröser Miokarditis.
Funktion
Die Idee, dass das Endothel nur eine passive Auskleidung von Lymph- und Blutgefäßen ist, muss geändert werden. Endothelfunktionen sind vielfältig und für den Organismus essentiell. In der Tat ist es eine physikalische Struktur von Herz-Kreislauf- und Lymphbahnen, aber es reguliert auch den Austausch von Molekülen zwischen dem Lumen des Gefäßes und dem umgebenden Gewebe und beeinflusst die physiologischen Eigenschaften des Blutes. Neben einer physischen Barriere entwickeln Endothelzellen sekretorische, metabolische und Immunfunktionen. Sie verändern ihr physiologisches Verhalten, beeinflusst von Molekülen wie Wachstumsfaktoren, Gerinnungs- und Antikoagulanzien, Lipoproteinen niedriger Dichte, Stickoxid, Serotonin, Enkephalin und vielen anderen. Endothelzellen haben Rezeptoren für all diese Substanzen.
Barriere
Endothelzellen bilden eine Schicht, die normalerweise als Barriere zwischen dem Blut und dem umgebenden Gewebe wirkt. Die Kohäsion zwischen Endothelzellen wird durch Zellübergänge wie Tight Junctions und Adhärent Junctions erfüllt. Gap Junctions wurden ebenfalls beobachtet, obwohl ihre Hauptfunktion die Kommunikation zwischen benachbarten Zellen ist. Endothelzellen können diese Adhäsionen modulieren und die Permeabilität der Barriere verändern, was sich nicht nur auf Moleküle, sondern auch auf Zellen auswirken kann, die das Endothel überqueren. In einigen Organen wie der Leber sind Endothelzellen jedoch viel lockerer verpackt und lassen viel freien Raum, so dass Endothel kaum als Barriere angesehen werden kann.
Transmissionselektronenmikroskopische Aufnahmen zeigen viele Vesikel im Zytoplasma von Endothelzellen. Es wird angenommen, dass sie am intrazellulären Transport zwischen der apikalen (dem Blut zugewandten) und der basolateralen Membran (der Basallamina zugewandten) beteiligt sind. Diese Art des Transports wird als Transzytose bezeichnet. Es ist interessant, dass Transzytose-Vesikel in den Endothelzellen von Kapillaren häufiger vorkommen als in denen größerer Blutgefäße. Es zeigt an, dass die Endothelzellen in Kapillaren einen intensiveren Austausch von Molekülen zwischen Blut und Geweben haben, während sie in Gefäßen mit großem Durchmesser hauptsächlich an der Leitung des Blutes beteiligt sind. Einige Endothelzellen, bekannt als fenestriert, haben Poren oder sehr kleine Kanäle, die das Blut direkt mit dem umgebenden Gewebe verbinden, so dass einige kleine Moleküle das Endothel durchqueren können, ohne in das Zytoplasma von Endothelzellen einzudringen (Abbildung 4). Schließlich gibt es Organe mit sehr durchlässigem Endothel. In der Leber sind Sinusoide Blutgefäße, in denen Endothelzellen freien Raum zwischen sich lassen und eine Funktion als Barriere kaum vorhanden ist.
Viele Zelltypen wandern im Blut zu ihren Zielorganen im Körper. Dort kreuzen sie das Endothel der Blutgefäße, häufig in Höhe der postkapillaren Venen. Dies bedeutet, dass Endothelzellen die Zellübergänge modifizieren müssen, damit Zellen die Endothelschicht passieren können. Leukozyten verlassen das Blutgefäß, indem sie bestimmte Moleküle der apikalen Membran der Endothelzellen erkennen und an ihnen verankern. Selektine, Integrine und Immunglobuline sind für die Erkennung und Adhäsion von Leukozyten an die Endothelschicht verantwortlich. Selektine beginnen mit der Verankerung von Leukozyten, die über die Endotheloberfläche rollen. Diese anfängliche Adhäsion ist schwach und reversibel.
Viele Leukozyten verlassen das Blut während entzündlicher Prozesse, um sich in die betroffenen Gewebe zu bewegen. Chemokine sind leukozytenattraktive Moleküle, die von geschädigtem Gewebe freigesetzt und mit dem Glykokalix von Endothelzellen verbunden werden. Leukozyten, die mit Chemokinen über die Endotheloberfläche rollen, werden aktiviert, die Zell-Zell-Adhäsion wird stärker und Leukozyten verbleiben an Ort und Stelle. Die Aktivierung des Leukozyten führt zur Aktivierung seiner Integrine, die die Immunglobuline der Endothelzelle erkennen. Diese Immunglobuline werden nach der Aktivierung der Zelle durch Chemokine in den Endothelzellmembranen exprimiert. Die Zell-Zell-Adhäsion erhöht die Calciumkonzentration in Endothelzellen und führt zu einer Desorganisation der Zellübergänge und zum Rückzug des Zytoplasmas. Auf diese Weise können sich Leukozyten an die Grenze der Endothelzellen bewegen und das Endothel überqueren. Adhäsionsmoleküle sind auch an dieser Bewegung von Leukozyten beteiligt.
Bluteigenschaften
Die Endothelfunktionen sind komplexer als nur die Kontrolle der Moleküle und Zellen, die durch das Endothel gehen. Endothelzellen sind auch an Blutdruck, Gerinnung und einigen anderen beteiligt Bluteigenschaften. Es wird angenommen, dass das primitive Kreislaufsystem vor 600 Millionen Jahren bei wirbellosen Tieren entstanden ist, aber es fehlte Endothel. Endothelzellen erschienen vor 100 Millionen Jahren und versorgten das Blut mit einem laminareren Fluss (nicht turbulent) und damit einem effizienteren Gasaustausch.
Endothelzellen modulieren den Blutdruck, indem sie Substanzen freisetzen, die auf die glatte Muskulatur der Blutgefäße wirken. Sie setzen Stickoxid (NO) und Prostacyclin frei, die die glatte Gefäßmuskulatur entspannen. Sie setzen auch Endothelin und den Thrombozytenaktivatorfaktor frei, die beide den Blutgefäßdurchmesser verringern. Stickstoffmonoxid wird konstitutiv freigesetzt und sorgt für einen ordnungsgemäßen Muskeltonus, hemmt die Thrombozytenaggregation und die Leukozytenadhäsion. Endothelin ist ein starker Vasokonstriktor. Wie Endothelzellen entscheiden, welches Molekül freigesetzt werden muss, ist noch nicht klar, aber Mechanorezeptoren in ihren apikalen Membranen, die die Flusseigenschaften des Blutes spüren können, können plausibel sein.
Unter normalen Bedingungen setzen Endothelzellen Moleküle in das Blut frei, die helfen, eine angemessene Fließfähigkeit aufrechtzuerhalten. Sie wirken auf zwei Ebenen: Fluidität (Antikoagulanzien) und Verhinderung der Thrombozytenaggregation (Antithrombotika). Die Proteine C und S sind wichtige Moleküle, die die Blutfluidität beeinflussen. C-Protein, das einen Komplex mit S-Protein bildet, inaktiviert die Gerinnungsfaktoren VIIIa und Va. S-Protein wird von Endothelzellen synthetisiert. Darüber hinaus enthält der endotheliale Glycocalix ein heparinähnliches Glykosaminoglycan, das Thrombin inaktivieren kann. Im Zusammenhang mit ihrer gerinnungshemmenden Funktion setzen Endothelzellen Stickoxid und Prostacyclin frei, die beide das zyklische AMP in Blutplättchen erhöhen und die Blutplättchenaggregation erschweren. Diese beiden Moleküle werden kontinuierlich in das Blut freigesetzt. Endothelzellen haben Ektonukleasen in ihren apikalen Membranen, die ATP und ADP entfernen, beide starke Promotoren der Thrombozytenaggregation. Darüber hinaus setzen Endothelzellen ein Aktivatormolekül frei, das Plaminogen in Plasmin umwandelt, was die Entfernung von Thromben begünstigt.
All diese molekularen Signalwege können sich ändern, wenn Endothelzellen Signale empfangen oder Gewebe geschädigt wird, was zu Blutgerinnung und Thrombozytenaggregation führt. Unter diesen Umständen werden Endothelzellen dann aktive Teilnehmer der Gerinnung und Thrombose.
Immunabwehr
Endothelzellen spielen eine wichtige Rolle bei der Immunabwehr und sind an zwei Mechanismen beteiligt: der Antigenpräsentation an T-Lymphozyten und der Rekrutierung von Immunzellen. Zusammen mit Makrophagen können Endothelzellen T-Lymphozyten Antigene präsentieren, da sie MHC-I (Haupthistokompatibilitätskomplex) konstitutiv exprimieren und zur Expression von MHC-II induziert werden können, die beide für die Antigenpräsentation notwendig sind. Endothelzellen können das Immungedächtnis aktivieren, aber keine neuen T-Lymphozyten. Es gibt eine bidirektionale Aktivierung zwischen Endothelzellen und T-Lymphozyten, so dass Endothelzellen Moleküle zur Anziehung von Entzündungszellen freisetzen und Adhäsionsmoleküle zur Verankerung von Blutleukozyten exprimieren.
Bibliographie
Cines BD, Pollak ES, Buck CA, Loscalzo J, Zimmerman GA, McEver RP, Pober JS, Wick TM, Konkle BA, Schwartz BS, Barnathan ES, McCrae KR, Umarmung BA, Schmidt A-M, Stern DM 1998. Endothelzellen in der Physiologie und in der Pathophysiologievon Gefäßerkrankungen. Das Journal der American Society of Hematology. 91:3527-3561
Fajardo LF. 1988. Die Komplexität der Endothelzellen. In: American journal of clinical pathology. 92:241-250.
Michiels C. 2003. Endothelzellfunktionen. Zeitschrift für zelluläre Physiologie. 196:430-443