eftersom de flesta av de nya hydroxidjonerna avlägsnas ökar pH inte så mycket.
avlägsnande av hydroxidjonerna genom att reagera med vätejoner
Kom ihåg att det finns några vätejoner närvarande från joniseringen av etansyra.
![]()
![]()
hydroxidjoner kan kombinera med dessa för att göra vatten. Så snart detta händer, jämviktstips för att ersätta dem. Detta fortsätter att hända tills de flesta hydroxidjonerna avlägsnas.
![]()
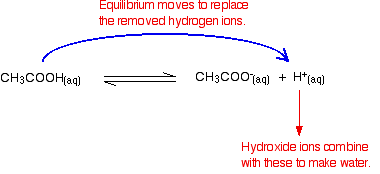
igen, eftersom du har jämvikt inblandade, inte alla hydroxidjoner tas bort – bara de flesta av dem. Det bildade vattnet joniserar i mycket liten utsträckning för att ge några vätejoner och hydroxidjoner.
Alkaliska buffertlösningar
Vi tar en blandning av ammoniak och ammoniumkloridlösningar som typiska.
ammoniak är en svag bas, och positionen för denna jämvikt kommer att vara väl till vänster:
![]()
![]()
tillsats av ammoniumklorid till detta lägger till massor av extra ammoniumjoner. Enligt Le Chateliers princip kommer det att tippa jämviktspositionen ännu längre till vänster.
lösningen kommer därför att innehålla dessa viktiga saker:
-
massor av oreagerad ammoniak;
-
massor av ammoniumjoner från ammoniumkloriden;
-
tillräckligt med hydroxidjoner för att göra lösningen alkalisk.
andra saker (som vatten och kloridjoner) som är närvarande är inte viktiga för argumentet.
lägga till en syra till denna buffertlösning
det finns två processer som kan ta bort vätejonerna som du lägger till.
avlägsnande genom att reagera med ammoniak
den mest sannolika basiska substansen som en vätejon kommer att kollidera med är en ammoniakmolekyl. De kommer att reagera för att bilda ammoniumjoner.
![]()
![]()
de flesta, men inte alla, av vätejonerna kommer att tas bort. Ammoniumjonen är svagt sur, och så kommer några av vätejonerna att släppas igen.
avlägsnande av vätejonerna genom att reagera med hydroxidjoner
Kom ihåg att det finns några hydroxidjoner närvarande från reaktionen mellan ammoniak och vattnet.
![]()
![]()
vätejoner kan kombineras med dessa hydroxidjoner för att göra vatten. Så snart detta händer, jämviktstips för att ersätta hydroxidjonerna. Detta fortsätter att hända tills de flesta vätejonerna avlägsnas.
![]()
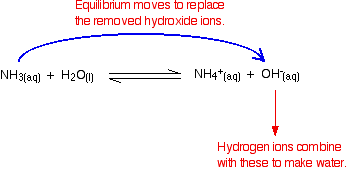
igen, eftersom du har jämvikt inblandade, inte alla vätejoner tas bort – bara de flesta av dem.
tillsats av en alkali till denna buffertlösning
hydroxidjonerna från alkali avlägsnas genom en enkel reaktion med ammoniumjoner.
![]()
![]()
eftersom den bildade ammoniaken är en svag bas kan den reagera med vattnet – och så är reaktionen något reversibel. Det betyder att återigen de flesta (men inte alla) av hydroxidjonerna avlägsnas från lösningen.
beräkningar som involverar buffertlösningar
detta är bara en kort introduktion. Det finns fler exempel, inklusive flera variationer, över 10 sidor i min kemiberäkningsbok.
Sura buffertlösningar
detta är lättare att se med ett specifikt exempel. Kom ihåg att en syrabuffert kan tillverkas av en svag syra och ett av dess salter.
låt oss anta att du hade en buffertlösning innehållande 0,10 mol dm-3 etansyra och 0.20 mol dm-3 natriumetanoat. Hur beräknar du dess pH?
i vilken lösning som helst som innehåller en svag syra finns det en jämvikt mellan den ojoniserade syran och dess joner. Så för etansyra har du jämvikten:
![]()
![]()
närvaron av etanoatjonerna från natriumetanoatet kommer att ha flyttat jämvikten till vänster, men jämvikten finns fortfarande.
det betyder att du kan skriva jämviktskonstanten, Ka, för den:
![]()
![]()
där du har gjort beräkningar med denna ekvation tidigare med en svag syra, har du antagit att koncentrationerna av vätejonerna och etanoatjonerna var desamma. Varje molekyl av etansyra som delas upp ger en av varje slags Jon.
det är inte längre sant för en buffertlösning:
![]()
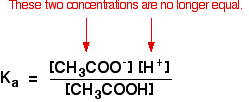
om jämvikten har skjutits ännu längre till vänster kommer antalet etanoatjoner som kommer från etansyra att vara helt försumbar jämfört med de från natriumetanoat.
vi antar därför att etanoatjonkoncentrationen är densamma som koncentrationen av natriumetanoat – i detta fall 0,20 mol dm-3.
i en svag syraberäkning antar vi normalt att så lite av syran har joniserat att koncentrationen av syran vid jämvikt är densamma som koncentrationen av syran vi använde. Det är ännu mer sant nu när jämvikten har flyttats ännu längre till vänster.så antagandena vi gör för en buffertlösning är:
![]()
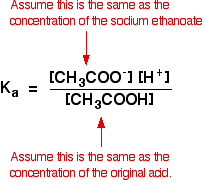
Nu, om vi vet värdet för Ka, kan vi beräkna vätejonkoncentrationen och därmed pH.
Ka för etansyra är 1,74 x 10-5 mol dm-3.
Kom ihåg att vi vill beräkna pH för en buffertlösning innehållande 0,10 mol dm-3 etansyra och 0,20 mol dm-3 natriumetanoat.
![]()
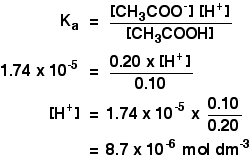
då behöver du bara hitta pH med uttrycket
pH = -log10
Du har fortfarande värdet för vätejonkoncentrationen på din räknare, så tryck på log-knappen och ignorera det negativa tecknet (för att tillåta minustecknet i pH-uttrycket).
Du bör få ett svar på 5,1 till två signifikanta siffror. Du kan inte vara mer exakt än detta, eftersom dina koncentrationer endast gavs till två siffror.