9.5 överträdelser av oktettregeln
lärande mål
- erkänna de tre huvudtyperna av överträdelser av oktettregeln.
lika viktigt och användbart som oktettregeln är i kemisk bindning finns det några välkända överträdelser. Detta betyder inte att oktettregeln är värdelös—tvärtom. Som med många regler finns det undantag eller överträdelser.
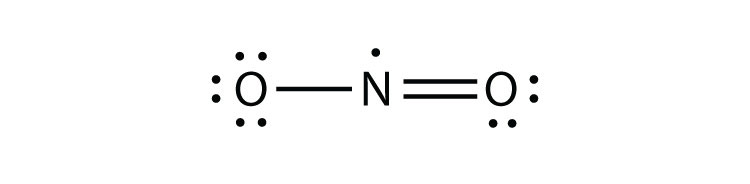
det finns tre brott mot oktettregeln. Odd-elektronmolekyleren molekyl med ett udda antal elektroner i en atoms valensskal. representera den första överträdelsen till oktettregeln. Även om de är få, har vissa stabila föreningar ett udda antal elektroner i sina valensskal. Med ett udda antal elektroner måste minst en atom i molekylen bryta mot oktettregeln. Exempel på stabila odd-elektronmolekyler är NO, NO2 och ClO2. Lewis-elektronpunktdiagrammet för NO är som följer:
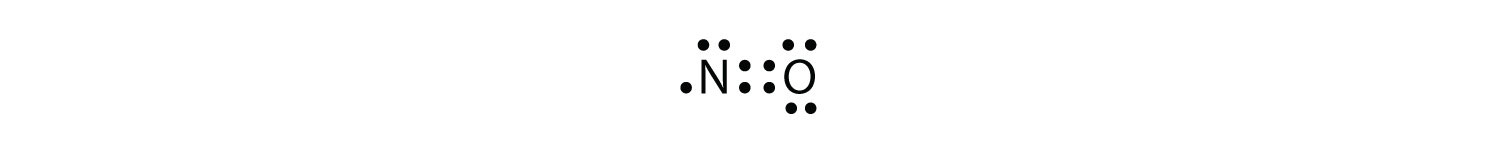
Även om O-atomen har en oktett av elektroner, har n-atomen bara sju elektroner i sitt valensskal. Även om NO är en stabil förening är den mycket kemiskt reaktiv, liksom de flesta andra udda elektronföreningar.
Elektronbristiga molekyleren molekyl med mindre än åtta elektroner i valensskalet hos en atom. representera den andra överträdelsen till oktettregeln. Dessa stabila föreningar har mindre än åtta elektroner runt en atom i molekylen. De vanligaste exemplen är de kovalenta föreningarna av beryllium och bor. Till exempel kan beryllium bilda två kovalenta bindningar, vilket resulterar i endast fyra elektroner i sitt valensskal:
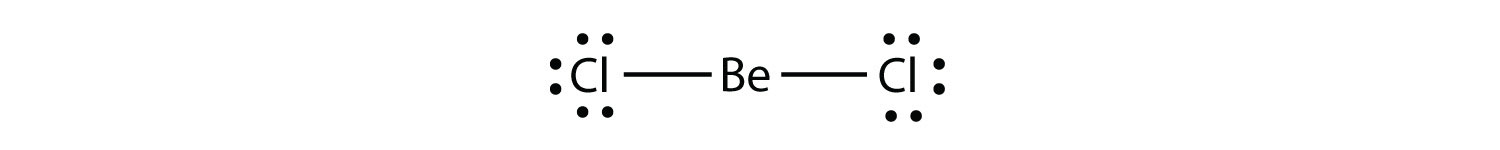
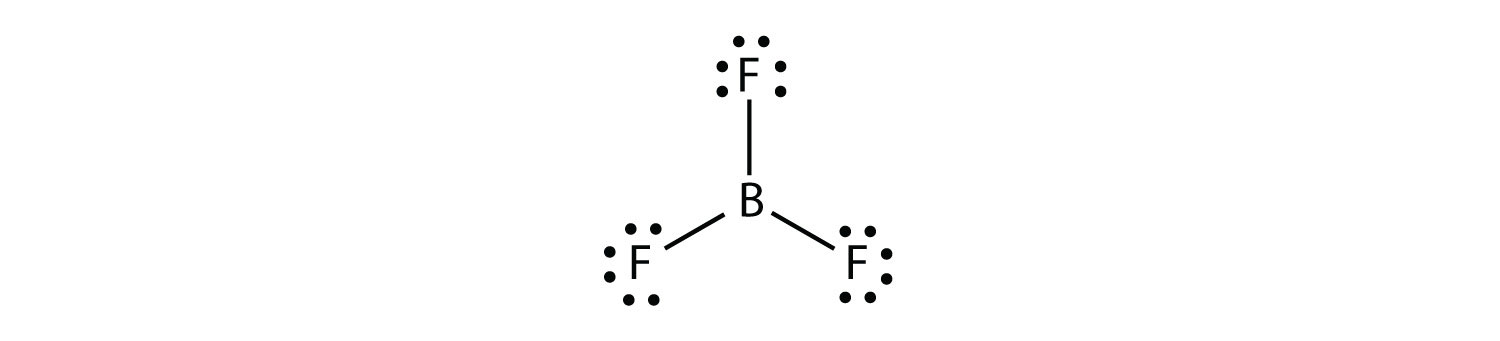
bor gör vanligtvis bara tre kovalenta bindningar, vilket resulterar i endast sex valenselektroner runt b-atomen. Ett välkänt exempel är BF3:
den tredje överträdelsen till oktettregeln finns i de föreningar med mer än åtta elektroner tilldelade deras valensskal. Dessa kallas expanderade valensskalmolekyleren molekyl med mer än åtta elektroner i valensskalet hos en atom.. Sådana föreningar bildas endast av centrala atomer i den tredje raden i det periodiska systemet eller bortom som har tomma d-orbitaler i sina valensskal som kan delta i kovalent bindning. En sådan förening är PF5. Det enda rimliga Lewis-elektronpunktdiagrammet för denna förening har P-atomen som gör fem kovalenta bindningar:
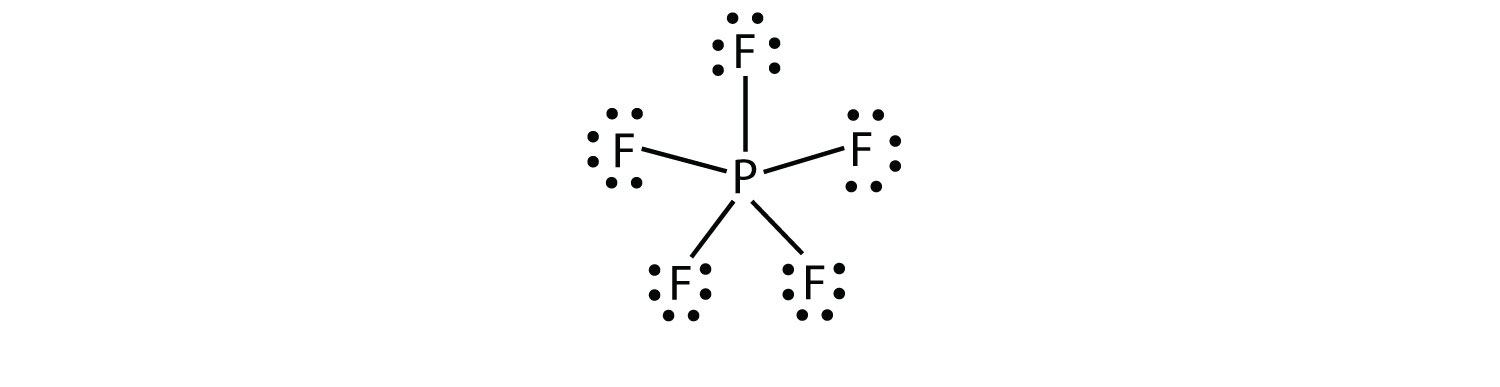
formellt har P-atomen 10 elektroner i sitt valensskal.
exempel 9
identifiera varje överträdelse av oktettregeln genom att rita ett Lewis electron dot-diagram.
- ClO
- SF6
lösning
-
med en Cl-atom och en o-atom har denna molekyl 6 + 7 = 13 valenselektroner, så det är en udda elektronmolekyl. Ett Lewis-elektronpunktdiagram för denna molekyl är som följer:

-
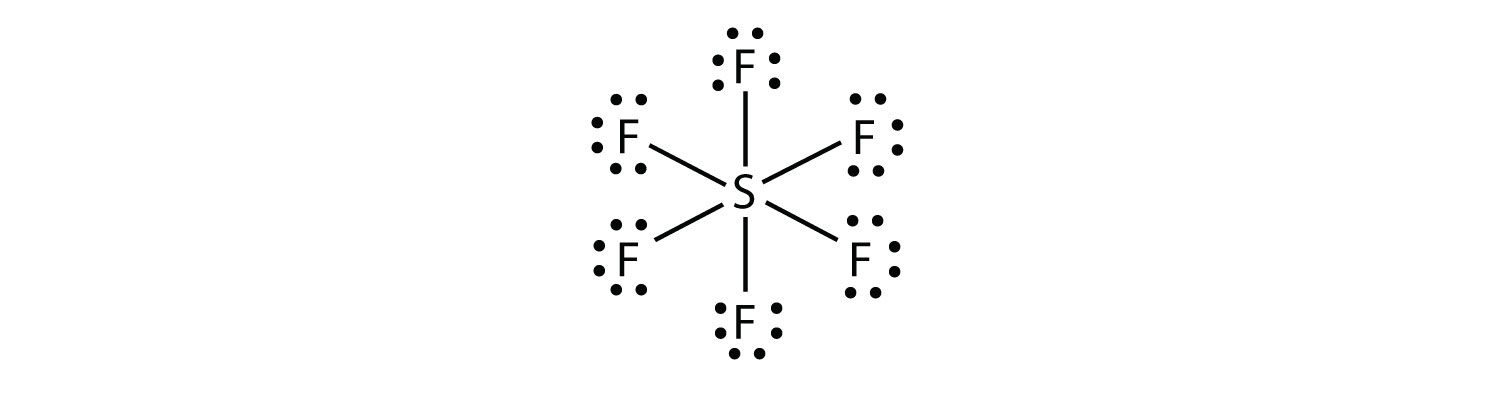
i SF6 gör den centrala s-atomen sex kovalenta bindningar till de sex omgivande F-atomerna, så det är en expanderad valensskalmolekyl. Dess Lewis electron dot diagram är som följer:
Testa dig själv
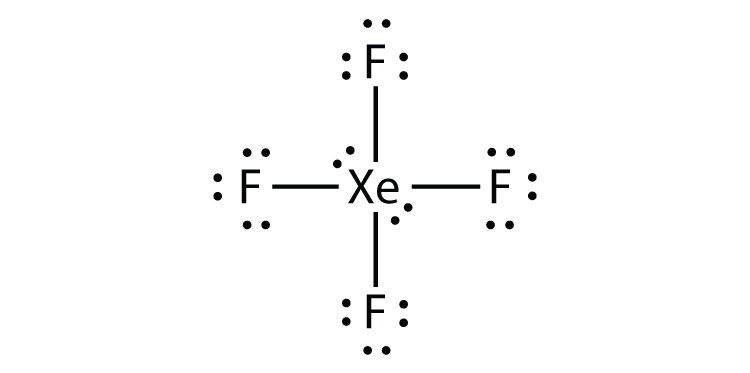
identifiera överträdelsen till oktettregeln i XeF2 genom att rita ett Lewis electron dot-diagram.
svar
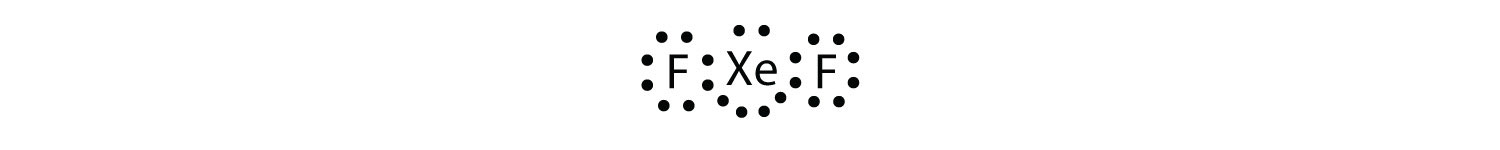
Xe-atomen har ett expanderat valensskal med mer än åtta elektroner runt den.
Key Takeaway
- Det finns tre brott mot oktettregeln: odd-elektronmolekyler, elektronbristiga molekyler och expanderade valensskalmolekyler.
övningar
-
varför kan en udda elektronmolekyl inte uppfylla oktettregeln?
-
varför kan en atom i den andra raden i det periodiska systemet inte bilda expanderade valensskalmolekyler?
-
rita ett acceptabelt Lewis-elektronpunktdiagram för dessa molekyler som bryter mot oktettregeln.
- NO2
- XeF4
-
rita ett acceptabelt Lewis-elektronpunktdiagram för dessa molekyler som bryter mot oktettregeln.
- BCl3
- ClO2
-
rita ett acceptabelt Lewis-elektronpunktdiagram för dessa molekyler som bryter mot oktettregeln.
- POF3
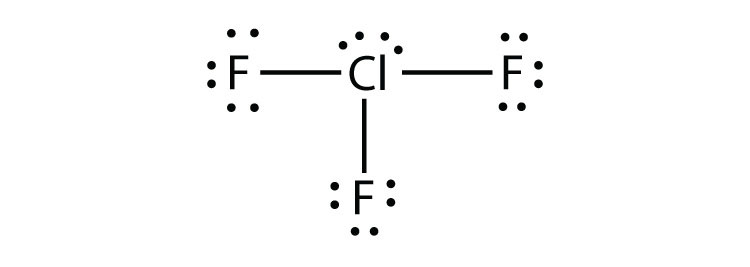
- ClF3
-
rita ett acceptabelt Lewis-elektronpunktdiagram för dessa molekyler som bryter mot oktettregeln.
- SF4
- BeH2
svar
-
det finns inget sätt att alla elektroner kan paras ihop om det finns ett udda antal av dem.
-
-