structura primară a unei proteine este definită ca secvența de aminoacizi din care este compusă. Această secvență determină în cele din urmă forma pe care o adoptă proteina, în funcție de limitările spațiale ale aranjamentului atomilor din proteină, de proprietățile chimice ale resturilor de aminoacizi componente și de mediul proteinei.
legăturile peptidice care leagă reziduurile de aminoacizi într-o polipeptidă se formează într-o reacție de condensare între gruparea carboxil acidă a unui aminoacid și gruparea amino bazică a unui alt aminoacid. În contextul unei peptide, grupul amidic (CO–NH) este denumit grupul peptidic.
Crucial pentru înțelegerea structurii proteinelor este cunoașterea structurii legăturii peptidice. Linus Pauling, în anii 1930, a folosit difracția cu raze X pentru a examina natura legăturii peptidice formate între doi aminoacizi. El a raportat că grupul peptidic (CO–NH) are o structură plană rigidă. Această structură se datorează interacțiunilor dintre electronii dublei legături a grupării carbonil și cei ai legăturii C-N (Figura 2), astfel încât acesta din urmă dobândește proprietăți parțiale (aproximativ 40%) de dublă legătură.

acest efect este un exemplu de rezonanță care poate fi gândit ca o împărțire a electronilor între legături. Deoarece legăturile simple dintre doi atomi sunt mai lungi decât legăturile duble dintre aceiași doi atomi, lungimile legăturilor C–N și C=o din grupul peptidic diferă de cele observate pentru aceste legături în alte contexte în care nu apare rezonanța. Astfel, caracterul de legătură dublă parțială a C–N în grupul peptidic înseamnă că această legătură este mai scurtă decât s-ar prezice pentru o legătură unică C-N, în timp ce legătura C=o, având un caracter parțial de legătură unică datorită rezonanței, este mai lungă decât s-ar prezice pentru o legătură dublă C=O. Lungimile legăturii din grupul peptidic sunt indicate în Figura 3. Comparați legătura C-N a grupării peptidice cu cea dintre N și Ca (atomul C la care sunt atașate gruparea amino și gruparea carboxil).

există două conformații posibile ale legăturii peptidice plane: în grupul peptidic trans, atomii de ca se află pe laturile opuse ale legăturii peptidice (figura 3a), iar în grupul peptidic cis, atomii de ca se află pe aceeași parte a legăturii peptidice (figura 3b).
-
având în vedere dispunerea spațială și proximitatea atomilor în conformațiile cis și trans ale legăturii peptidice, care Conformație credeți că ar fi favorizată?
-
conformația trans ar fi mai favorabilă din punct de vedere energetic decât conformația cis, deoarece minimizează obstacolele sterice.
În general, legăturile peptidice sunt în conformația trans. Cu toate acestea, formele cis pot apărea în legături peptidice care preced un reziduu de prolină. În astfel de cazuri, forma cis este mai stabilă decât de obicei, deoarece lanțul lateral prolină oferă mai puțin o piedică. Cu toate acestea, legăturile peptidice cis apar numai în aproximativ 10% din cazurile de legături peptidice care preced reziduurile de prolină.
ținând cont de natura plană a grupului peptidic, se poate observa că un lanț polipeptidic are o coloană vertebrală care constă dintr-o serie de grupări peptidice plane rigide legate de atomii de Ca. Figura 4 prezintă o parte a unei polipeptide cu două grupări peptidice plane în conformația trans. Rețineți că, deși rotația nu este permisă în legătură cu legăturile peptidice, există potențial de rotație în jurul legăturilor Ca–N și ca–C. Unghiurile de rotație, denumite unghiuri de torsiune , despre aceste legături specifică conformația unei coloane vertebrale polipeptidice. Unghiurile de torsiune ale legaturilor Ca-N si ca-C sunt denumite in continuare ca fiind de la Ca-N la CA-C si de la Ca-N la Ca-N si de la ca-C. (psi), respectiv, și sunt definite ca 180 inqut atunci când polipeptida se află în conformația plană extinsă, așa cum este ilustrat în Figura 4.
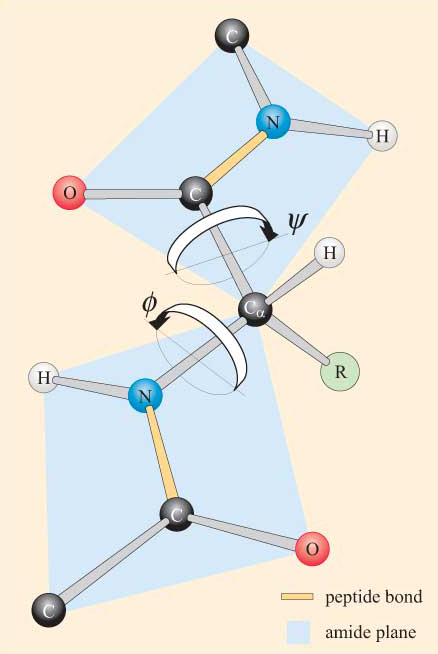
nu veți fi surprinși să aflați că constrângerile sterice se aplică și în cazul produselor din clasa a VIII-a.
ca urmare a acestor constrângeri sterice, sunt permise numai anumite valori ale lui hectolixt și, prin urmare, conformațiile peptidei, în timp ce altele nu.
este posibil să se calculeze aceste valori permise pentru un anumit reziduu în contextul unei polipeptide. Acest calcul se realizează prin determinarea mai întâi a distanțelor dintre toți atomii care nu se leagă în două grupări peptidice învecinate (cum ar fi cele din Figura 4) la toate valorile posibile ale lui ecuent și ale lui ecuent. Este cel mai ușor de făcut pentru o polipeptidă care conține doar un singur tip de aminoacid. O parcelă conformațională a lui hectolix împotriva lui hectolix pentru un anumit reziduu este cunoscută sub numele de parcelă Ramachandran (după inventatorul său, G. N. Ramachandran). Un astfel de grafic ne permite să identificăm acele conformații (adică pentru o anumită valoare a lui hectolixt și a lui hectolixt) care sunt steric favorabile sau nefavorabile (ca în Figura 5), conform următoarelor criterii:
-
În cazul în care nu există niciun conflict între razele van der Waals ale atomilor care nu se leagă, o conformație este ‘permisă’. Aceste conformații se află în zonele albastre din Figura 5.
-
Conformațiile care necesită distanțe interatomice la limita admisibilă sunt definite ca conformații limită exterioare. Ele se află în zonele verzi din Figura 5.
-
conformațiile teoretice care necesită ca oricare doi atomi care nu se leagă să fie mai apropiați unul de celălalt decât permit razele van der Waals sunt ‘interzise’steric. Acestea se află în zonele albe din Figura 5.
se observă că valorile pentru valorile de la −180 la-180 la-180 la -. Întoarcerea grupei peptidice prin 360 hectolitru îl va readuce, desigur, la poziția sa de pornire, iar −180 October și +180 October corespund aceleiași poziții. Astfel, banda verde din colțul din stânga jos al parcelei din Figura 5 este contiguă cu câmpul din colțul din stânga sus.

-
Utilizare Figura 5 pentru a determina dacă următoarele valori de ɸ și ψ sunt sterically favorabile sau nefavorabile: (a) ɸ = 90º și ψ = 90º; (b) ɸ = −90º și ψ = 90º.
-
(a) nefavorabil; B) favorabil.
parcelele Ramachandran pot fi construite pentru polimeri ai fiecăruia dintre cei 20 de aminoacizi. Este semnificativ de remarcat faptul că parcelele Ramachandran pentru multe reziduuri de aminoacizi sunt în general foarte asemănătoare, având doar trei regiuni cu conformații favorabile sau tolerate (etichetate 1-3 în parcela pentru poli-L-alanină în Figura 5). Cu toate acestea, apar diferențe. De exemplu, unde lanțul lateral (R în Figura 4) este ramificat lângă Ca, ca în cazul treoninei, ocupă mai mult spațiu aproape de coloana vertebrală a peptidei și restricționează apropierea atomilor din grupele peptidice vecine. Ca urmare, conformațiile permise (unghiurile XV și XV) sunt mai restrânse pentru polipeptidele aminoacizilor ramificați.
-
Prolina este, de asemenea, destul de diferită de alți aminoacizi în ceea ce privește conformațiile permise, iar pentru poliprolină sunt tolerate numai valori de la −85 la −35. Gândindu-ne la structura prolinei, cum puteți explica această gamă relativ îngustă de Valori permise de la cents?
-
lanțul lateral al prolinei este legat covalent de N al grupării amino, deci în poliprolină, va exista mai puțină libertate de rotație în legătură cu ca-n decât cu alți aminoacizi. Prin urmare, a permis ɸ valori vor fi relativ limitate în comparație cu alți aminoacizi.
-
Figura 6 prezintă graficul Ramachandran pentru reziduurile de glicină într-un lanț polipeptidic. Regiunile sunt codificate în culori ca în Figura 5. Ce puteți spune despre conformațiile pe care le adoptă glicina? Luați în considerare structura glicinei. De ce diferă glicina de celelalte reziduuri în ceea ce privește conformațiile sale?
-
Glicina are o libertate conformațională mult mai mare decât alte reziduuri de aminoacizi, deoarece este mai puțin împiedicată steric.

parcelele Ramachandran din figurile 5 și 6 au fost generate pentru, respectiv, l-alanină și l-glicină pe baza distanțelor limită permise și exterioare pentru contactele interatomice, determinate din valorile cunoscute pentru razele van der Waals ale atomilor (Tabelul 1).
Tabelul 1 distanțele Van der Waals pentru contactele interatomice.
| tip de Contact | permis în mod normal / | limita exterioară / | |
|---|---|---|---|
| H···H | 2.0 | 1.9 |
3.0 |
sunt, prin urmare, mai degrabă predictive decât comploturi conformaționale reale. Putem, desigur, să folosim difracția de raze X pentru a determina experimental valorile reale ale lui xixt și xixt pentru reziduurile dintr-o polipeptidă. În Figura 7, valorile pentru toate reziduurile (cu excepția glicinei și prolinei) din mai multe structuri diferite au fost determinate prin difracție de raze X de înaltă rezoluție și reprezentate grafic pe un grafic Ramachandran. Putem vedea că există o corespondență izbitoare între conformațiile prezise și cele reale. Observați, totuși, că există unele reziduuri ale căror conformații se mapează la zonele interzise. Cele mai multe dintre aceste reziduuri se situează în regiunea dintre regiunile permise 2 și 3, în jurul valorii de 0%.

-
uitați-vă din nou la figura 4 și imaginați-vă că puteți răsuci grupul peptidic cel mai de sus prin 180 de la 0 la 0. Ce grupuri sunt susceptibile de a intra în conflict în această conformație?
-
grupurile n–H ale grupurilor peptidice adiacente vor intra în conflict între ele, fiind forțate în imediata apropiere.
conflictul asociat cu aceste conformații poate fi acomodat printr-un grad mic de răsucire a legăturii peptidice. Astfel, în astfel de conformații, grupul peptidic este răsucite din conformația sa plană obișnuită.
un număr limitat de conformații interzise ale anumitor reziduuri pot fi tolerate într-o polipeptidă dacă conformația adoptată, în ansamblu, este favorabilă din punct de vedere energetic. O polipeptidă va tinde să se plieze astfel încât să adopte cea mai stabilă Conformație. În această conformație, polipeptida își minimizează energia liberă. În secțiunile următoare, vom analiza acest nivel mai ridicat al structurii proteinelor.