Jak wiesz, Dmitrij Mendelejew jest ojcem układu okresowego. Ale czy wiesz, że nowoczesny układ okresowy, którego używamy, został opracowany przez naukowca o nazwisku Henry Moseley? Poznajmy fascynującą historię układu okresowego.
Suggested Videos
nowoczesny układ okresowy
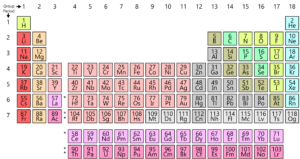
jak wiecie, wszystkie pierwiastki znajdujące się na ziemi są ułożone w siatkę lub matrycę zwaną współczesnym układem okresowym. Układ tych elementów jest zgodny ze wzorem. Układ okresowy został faktycznie opracowany i przez Mendelejewa na początku 1800 roku. Jednak w rzeczywistości został udoskonalony przez Henry 'ego Moseley’ a, angielskiego fizyka w 1913 roku. Dokonując korekt prawa okresowego, poprawił wszystkie wady tabeli Mendelejewa. Przyjrzyjmy się temu rozwojowi.
Browse more Topics under Periodic Classification of Elements
- wcześniejsze próby klasyfikacji pierwiastków
- pozycja pierwiastków we współczesnym układzie okresowym
- trendy we współczesnym układzie okresowym
wykorzystanie liczby atomowej
najpierw przyjrzyjmy się strukturze atomu. Każdy atom składa się z jądra, które składa się z protonów i neutronów. Tutaj protony mają ładunek dodatni, a neutron nie ma ładunku. Teraz elektrony (niosące ładunek ujemny) otaczają jądro. Teraz masa atomowa jest całkowitą liczbą protonów i neutronów w atomie. Liczba atomowa jest liczbą protonów w atomie. Ta liczba atomowa jest całkowicie unikalna dla każdego pierwiastka, co oznacza, że każdy pierwiastek na planecie ma swoją unikalną liczbę atomową.
To Henry Moseley zaproponował lepszą aranżację niż Mendelejew. Uporządkował pierwiastki według ich liczby atomowej, a nie masy atomowej. W ten sposób poprawił poprzedni stół i usunął niektóre z jego trudności i anomalii.
pozycja wodoru
Mendelejew nigdy nie mógł ustalić prawidłowej pozycji wodoru w swojej tabeli. Ponieważ wodór może zyskać lub stracić elektron, może znaleźć miejsce w Grupie 1 lub 17. Jego elektroniczna konfiguracja przypomina metal alkaliczny. Chociaż może również łączyć się z metalami i niemetalami tworząc wiązania kowalencyjne, takie jak Halogeny.
ale we współczesnym układzie okresowym nie ma dylematu. Ponieważ liczba atomowa wodoru wynosi 1, to tam znajduje odpowiednie miejsce na początku tabeli.
izotopy
izotopy to różne Atomy pierwiastka, z których każdy ma taką samą liczbę protonów, ale inną liczbę neutronów w jądrach. Oznacza to, że chociaż ich masa atomowa jest różna, ich liczba atomowa jest taka sama. Jak na przykład, węgiel-14 jest radioaktywnym izotopem atomu węgla, który ma osiem neutronów.
choć stanowiło to problem dla Mendelejewa, ponieważ tabela zależała od masy atomowej, nie jest to problem ze współczesnym układem okresowym. Wszystkie izotopy pierwiastków nie mają oddzielnych miejsc na stole.
kolejność pewnych elementów
Mendelejew używając masy atomowej do układania elementów napotkał inny problem. Zdarzały się przypadki łamania tego układu, więc elementy o podobnych właściwościach były w grupie razem. Weźmy na przykład jod i Tellur. Masa atomowa jodu jest mniejsza niż tellur. Mendelejew umieścił go po tellurze, więc może należeć do tej samej grupy co fluor i chlor.
we współczesnym układzie okresowym masa atomowa staje się nieistotna, a pierwiastki są grupowane z podobnymi pierwiastkami na podstawie ich liczby atomowej.
pierwiastki ziem rzadkich
nowoczesny układ okresowy rozwiązał kolejny problem, umieszczając pierwiastki ziem rzadkich, takie jak Cer, Lantan, ERB itp.w oddzielnej tabeli na dole układu okresowego, aby nie zakłócać prawa okresowego.
rozwiązany przykład dla ciebie
Q: Ze wszystkich 118 znanych nam pierwiastków, ile pierwiastków występuje naturalnie?