
objętość molowa (symbol Vm) substancji jest objętością zajmowaną przez jeden mol substancji w danym temperatura i ciśnienie. Jest równa masie cząsteczkowej (m) substancji podzielonej przez jej gęstość (ρ) w danej temperaturze i ciśnieniu:
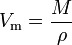
ma jednostkę SI metrów sześciennych na mol (m3/mol). Jednak objętość molowa jest często wyrażana jako metry sześcienne na 1000 moli (m3/kmol) lub decymetry sześcienne na mol (dm3/mol) dla gazów i jako centymetry na mol (cm3 / mol) dla cieczy i ciał stałych.
jeśli substancja jest mieszaniną zawierającą N składników, objętość molową oblicza się za pomocą:
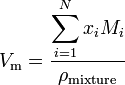
gdzie x i jest ułamkiem molowym i-tego składnika, M i jest masą cząsteczkową i-tego składnika, a pmixture jest gęstością mieszaniny w podanej temperaturze i ciśnieniu.
przy podawaniu wartości liczbowych objętości molowej ważne jest również podanie danych warunków temperatury i ciśnienia. W przeciwnym razie wartości liczbowe są bez znaczenia.
gazy idealne
równanie prawa gazu idealnego można zmienić tak, aby dać to wyrażenie dla objętości molowej gazu idealnego:
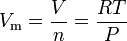
gdzie w jednostkach SI:
= ciśnienie bezwzględne gazu, w Pa
= liczba moli, w Mol
= objętość molowa gazu, w M3/mol
= temperatura bezwzględna gazu, w k
= uniwersalna stała prawa gazu 8,314472 m3·Pa·mol-1·K-1
gdzie w USA:
= ciśnienie bezwzględne gazu, w psia
= liczba moli, w lb-mol
= objętość molowa gazu, w ft3/lb-mol
= temperatura bezwzględna gazu, w stopniach Rankine (°R)
= uniwersalna stała prawa gazowego 10,7316 ft3·psia·lb-mol-L·°R-1
przykładowe obliczenia idealnych objętości molowych gazu:
- w jednostkach metrycznych si:
vm = 8,314472 × 273,15 / 101,325 = 0,022414 m3/mol przy 0 °C i 101,325 pa ciśnienie bezwzględne = 22,414 m3/kmol przy 0 °C (273,15 K) i 101.325 kPa Ciśnienie bezwzględne vm = 8,314472 × 273,15 / 100 000 = 0,022711 M3/kmol przy 0 °C i 100 000 Pa ciśnienie bezwzględne = 22,711 M3/kmol przy 0 °C (273,15 K) i 100 kPa Ciśnienie bezwzględne
- w zwyczajowych jednostkach USA:
Vm = 10,7316 × 519.67 / 14.696 = 379.48 ft3/lb-mol przy 60 °f (519.67 °r) i 14.696 Psia
uwagi:
- lb-mol to skrót od Pound-mol
- °R to stopnie rankine (Skala temperatury bezwzględnej), A °F to stopnie Fahrenheita (Skala temperatury).
- °R = °F + 459.67
- literatura techniczna może być myląca, ponieważ niektórzy autorzy często nie wyjaśniają, czy używają uniwersalnej stałej prawa gazu R, która ma zastosowanie do każdego gazu idealnego, czy też używają specyficznej stałej prawa gazu Rs, która ma zastosowanie tylko do konkretnego gazu. Zależność między tymi dwoma stałymi wynosi Rs = R / M, gdzie M jest masą cząsteczkową gazu.
gazy rzeczywiste
gazy rzeczywiste to te gazy, które nie wykazują zachowania gazu idealnego. Dla takich gazów najprostszą metodą wyznaczania objętości molowych jest użycie współczynników ściśliwości, jak w następującym wyrażeniu:
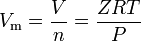
gdzie Z jest współczynnikiem ściśliwości gazu, który jest użyteczną właściwością termodynamiczną do modyfikowania prawa gazu idealnego w celu uwzględnienia zachowania gazów rzeczywistych. Powyższe równanie jest w zasadzie prostym równaniem stanu (EOS). Głównym ograniczeniem tego równania stanu jest to, że współczynnik ściśliwości gazu, Z, nie jest stałą, ale zmienia się w zależności od gazu, jak również od temperatury i ciśnienia gazu pod uwagę.
dokładniejsze wartości rzeczywistych objętości molowych gazu można uzyskać za pomocą równań stanu, takich jak równanie van der Waalsa opracowane w 1873, równanie Redlicha-Kwonga opracowane w 1949, równanie Soave ’ a-Redlicha-Kwonga opracowane w 1972 i równanie Penga-Robinsona opracowane w 1976.
- 1.0 1.1 International Union of Pure and Applied chemistry (IUPAC): Quantities, Units and Symbols in Physical Chemistry 2nd Edition, 1993
- 2.0 2.1 NIST Guide to SI poz. 8.6.3 in Section 8
- 3.0 3.1 Determination of gas compressibility values Information on how to determine gas compressibility factors and molar volumes.
| |
niektóre treści na tej stronie mogły wcześniej pojawić się na Citizendium. |