kluczowe terminy
upewnij się, że możesz zdefiniować i użyć w kontekście kluczowych terminów poniżej.
- katalizator Adamsa
- uwodornienie
uwagi do badania
reakcje chemiczne, które są heterogeniczne, mają reagenty, które są w co najmniej dwóch różnych fazach (np. gaz z ciałem stałym), podczas gdy reakcje homogeniczne zachodzą w jednej fazie (np. gaz z innym gazem).
pewne zamieszanie może wynikać z opisu katalizatora stosowanego w reakcji między alkenami a Wodorem. Trzy metale—nikiel, platyna i pallad—są powszechnie stosowane, ale chemik nie może po prostu umieścić kawałek jednego z tych metali w mieszaninie alkenu i wodoru i uzyskać reakcję. Każdy metalowy katalizator musi być przygotowany w specjalny sposób:
- nikiel jest zwykle używany w drobno podzielonej formie zwanej ” Raney nickel.”Wytwarza się go przez reakcję stopu Ni-Al z NaOH.
- pallad otrzymuje się komercyjnie „wspierany” na substancji obojętnej, takiej jak węgiel drzewny (PD/C). Alken jest zwykle rozpuszczany w etanolu, gdy jako katalizator stosuje się Pd / C.
- platyna jest używana jako katalizator PtO2, chociaż w rzeczywistości katalizatorem jest platynowy metal. Wodór stosowany do dodania do wiązania podwójnego węgiel-węgiel redukuje również tlenek platyny (IV) do drobno podzielonego metalu platyny. Jako rozpuszczalnik dla alkenu stosuje się etanol lub kwas octowy.
Inne rodzaje związków zawierających wiązania wielokrotne, takie jak ketony, estry i nitryle, nie reagują z wodorem w warunkach stosowanych do uwodorniania alkenów. Poniższe przykłady pokazują redukcję alkenu, ale obecne grupy ketonowe i nitrylowe pozostają nienaruszone i nie są redukowane.

pierścienie aromatyczne nie są również redukowane w warunkach stosowanych do redukcji alkenów, chociaż wydaje się, że pierścienie te zawierają trzy podwójne wiązania węgiel-węgiel. Jak zobaczymy później, pierścienie aromatyczne tak naprawdę nie zawierają wiązań podwójnych, a wielu chemików woli reprezentować pierścień benzenowy jako sześciokąt z okręgiem wewnątrz niego

niż jako sześciokąt z trzema naprzemiennymi wiązaniami podwójnymi.
reprezentacja pierścienia benzenowego zostanie omówiona w punkcie 15.2.
reakcja między wiązaniami podwójnymi węgiel-węgiel a Wodorem zapewnia sposób określania liczby podwójnych wiązań obecnych w związku. Na przykład jeden mol cykloheksenu reaguje z jednym molem wodoru, tworząc jeden mol cykloheksanu:

ale jeden mol 1,4-cykloheksadienu reaguje z dwoma mol wodoru, tworząc jeden mol cykloheksanu:
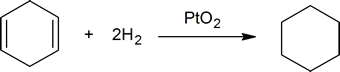
chemik powiedziałby, że cykloheksen reaguje z jednym odpowiednikiem wodoru, a 1,4-cykloheksadien reaguje z dwoma odpowiednikami wodoru. Jeśli weźmiesz znaną ilość nieznanego, nienasyconego węglowodoru i określisz, ile wodoru wchłonie, możesz łatwo określić liczbę podwójnych wiązań obecnych w węglowodorze (patrz pytanie 2, poniżej).
dodanie wodoru do wiązania podwójnego węgiel-węgiel nazywa się uwodornieniem. Ogólnym efektem takiego dodawania jest redukcyjne usunięcie grupy funkcyjnej wiązania podwójnego. Regioselektywność nie jest problemem, ponieważ ta sama grupa (atom wodoru)jest związana z każdym z atomów węgla o podwójnym wiązaniu. Najprostszym źródłem dwóch atomów wodoru jest wodór cząsteczkowy (H2), ale mieszanie alkenów z wodorem nie powoduje żadnej dostrzegalnej reakcji. Chociaż ogólna reakcja uwodornienia jest egzotermiczna, wysoka energia aktywacji uniemożliwia jej zajście w normalnych warunkach. Ograniczenie to można obejść poprzez zastosowanie katalizatora, jak pokazano na poniższym schemacie.
przykładem reakcji addycji alkenów jest proces zwany hydrogenation.In w reakcji uwodornienia dwa atomy wodoru są dodawane przez podwójne wiązanie alkenu, w wyniku czego powstaje nasycony Alkan. Uwodornienie wiązania podwójnego jest reakcją termodynamicznie korzystną, ponieważ tworzy produkt bardziej stabilny (o niższej energii). Innymi słowy, energia produktu jest niższa niż energia reagenta, a zatem jest egzotermiczna (ciepło jest uwalniane). Uwalniane ciepło nazywane jest ciepłem uwodornienia, które jest wskaźnikiem stabilności cząsteczki.


katalizatory są substancjami, które zmieniają szybkość (prędkość) reakcji chemicznej, nie będąc zużywanymi lub pojawiającymi się jako część produktu. Katalizatory działają poprzez obniżenie energii aktywacji reakcji, ale nie zmieniają względnej energii potencjalnej reagentów i produktów. Drobno podzielone metale, takie jak platyna, pallad i nikiel, należą do najczęściej stosowanych katalizatorów uwodornienia. Katalityczne uwodornienie odbywa się w co najmniej dwóch etapach, jak przedstawiono na schemacie. Po pierwsze, Alken musi być adsorbowany na powierzchni katalizatora wraz z częścią wodoru. Następnie dwa wodory przechodzą z powierzchni metalu do węgli wiązania podwójnego, a powstały nasycony węglowodór, który jest słabiej adsorbowany, opuszcza powierzchnię katalizatora. Dokładny charakter i czas ostatnich wydarzeń nie jest dobrze poznany.

jak pokazano na wykresie energetycznym, uwodornienie alkenów jest egzotermiczne, a ciepło jest uwalniane zgodnie z ΔE (kolor zielony) na wykresie. To ciepło reakcji można wykorzystać do oceny stabilności termodynamicznej alkenów posiadających różną liczbę podstawników alkilowych na wiązaniu podwójnym. Na przykład w poniższej tabeli wymieniono nagrzewanie uwodornienia dla trzech alkenów C5H10, które dają ten sam produkt alkanowy (2-metylobutan). Ponieważ duże ciepło reakcji wskazuje na wysoką energię reagenta, te ciepło jest odwrotnie proporcjonalne do stabilności izomerów alkenów. Z przybliżeniem widzimy, że każdy podstawnik alkilowy na podwójnym wiązaniu stabilizuje tę grupę funkcyjną o nieco więcej niż 1 kcal / mol.
| Alkene Isomer | (CH3)2CHCH=CH2 3-methyl-1-butene |
CH2=C(CH3)CH2CH3 2-methyl-1-butene |
(CH3)2C=CHCH3 2-methyl-2-butene |
|---|---|---|---|
| Heat of Reaction ( ΔHº ) |
–30.3 kcal/mole | –28.5 kcal/mole | –26.9 kcal/mole |

z pokazanego tutaj mechanizmu spodziewalibyśmy się, że dodanie wodoru nastąpi z syn-stereoselektywnością. Często jest to prawdą, ale katalizatory uwodornienia mogą również powodować izomeryzację wiązania podwójnego przed dodaniem wodoru, w którym to przypadku stereoselektywność może być niepewna.

ćwiczenia
- w reakcji
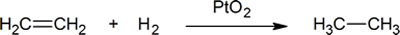
- 0,500 mola etenu reaguje z molem wodoru. Tak więc chemik może powiedzieć, że Eten reaguje z wodorem.
- Eten jest _______; podczas gdy _______ jest utleniany.
- liczba utleniania węgla w etenie wynosi _______; w etanie jest to______.
- gdy 1000 g określonego triglicerydu (tłuszczu) jest potraktowane gazem wodorowym w obecności katalizatora Adamsa, okazuje się, że objętość gazu wodorowego zużytego przy 99,8 kPa i 25,0°C wynosi 162 mL. Osobny eksperyment wskazuje, że Masa molowa tłuszczu wynosi 914 g mol−1. Ile podwójnych wiązań węgiel-węgiel zawiera związek?
odpowiedzi:
-
-
Pokaż odpowiedź
-
Pokaż odpowiedź
-
Pokaż odpowiedź
-
-
Pokaż odpowiedź
Examples
Question
Predict the products if the following alkenes were reacted with catalytic hydrogen.

Solution

Contributors
- Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
- Prof. Steven Farmer (Sonoma State University)
- Chemia organiczna z biologicznym naciskiem Tima Soderberga (University of Minnesota, Morris)