Generieke naam: Terbutalinesulfaat
doseringsvorm: injectie, oplossing
medisch beoordeeld door Drugs.com. laatst bijgewerkt op 1 Sep 2020.
- overzicht
- bijwerkingen
- dosering
- professionele
- interacties
- meer
een steriele waterige oplossing voor subcutane injectie
Rx alleen
waarschuwing: langdurige tocolyse
Terbutalinesulfaat is niet goedgekeurd en mag niet worden gebruikt voor langdurige tocolyse (langer dan 48-72 uur). In het bijzonder mag Terbutalinesulfaat niet worden gebruikt voor het onderhoud van tocolyse in de poliklinische of thuisomgeving. Ernstige bijwerkingen, waaronder overlijden, zijn gemeld na toediening van Terbutalinesulfaat aan zwangere vrouwen. Bij de moeder omvatten deze bijwerkingen verhoogde hartslag, voorbijgaande hyperglycemie, hypokaliëmie, hartritmestoornissen, longoedeem en myocardiale ischemie. Verhoogde foetale hartslag en neonatale hypoglykemie kunnen optreden als gevolg van maternale toediening (zie contra-indicaties: verlengde tocolyse).
- terbutaline beschrijving
- terbutaline-Klinische Farmacologie
- preklinisch
- farmacokinetiek
- indicaties en gebruik voor Terbutaline
- contra-indicaties
- waarschuwingen
- verslechtering van astma
- gebruik van ontstekingsremmers
- cardiovasculaire effecten
- convulsies
- voorzorgsmaatregelen
- Algemeen
- geneesmiddelinteracties
- carcinogenese, mutagenese, verminderde vruchtbaarheid
- zwangerschap-teratogene effecten
- gebruik tijdens de bevalling
- moeders die borstvoeding geven
- pediatrisch gebruik
- geriatrisch gebruik
- bijwerkingen
- overdosering
- Terbutaline dosering en toediening
- Hoe wordt Terbutaline geleverd
- PRINCIPAL DISPLAY PANEEL
- PRINCIPAL DISPLAY PANEEL
- SERIALIZATION IMAGE
- meer over terbutaline
- Consument hulpbronnen
- Professionele hulpbronnen
- behandeling in Verband met gidsen
terbutaline beschrijving
TERBUTALINESULFAAT, USP, het werkzame bestanddeel van Terbutalinesulfaat injectie, USP, is een beta-adrenerge agonist bronchodilator verkrijgbaar als een steriele, niet -yrogene, waterige oplossing in injectieflacons, voor subcutane toediening. Elke milliliter oplossing bevat 1 mg Terbutalinesulfaat, USP (0,82 mg van de vrije base), natriumchloride voor isotoniciteit, 0,055% edetaatdinatriumdihydraat als stabilisator en zoutzuur voor aanpassing aan een doel pH van 4. Terbutalinesulfaat is (±) – a — 3,5-dihydroxybenzyI alcoholsulfaat (2:1) (zout). De molecuulformule is (C12H19N03)2•H2SO4 en de structuurformule is:
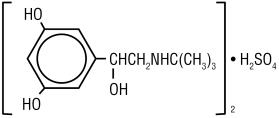
Terbutalinesulfaat, USP is een wit tot grijswit kristallijn poeder. Het is geurloos of heeft een zwakke geur van azijnzuur. Het is oplosbaar in water en in zoutzuur 0.1 N, lichtjes oplosbaar in methanol, en onoplosbaar in chloroform. Het molecuulgewicht is 548,65.
terbutaline-Klinische Farmacologie
Terbutalinesulfaat injectie is een bèta-adrenerge receptoragonist. In vitro en in vivo farmacologische studies hebben aangetoond dat Terbutaline een preferentieel effect heeft op bèta‑2-adrenerge receptoren. Hoewel bekend is dat bèta-2-adrenerge receptoren de overheersende receptoren zijn in bronchiale gladde spieren, wijzen gegevens erop dat er een populatie bèta-2-receptoren in het menselijk hart bestaat in een concentratie tussen 10% en 50%. De precieze functie van deze receptoren is niet vastgesteld (zie waarschuwingen). Gecontroleerde klinische onderzoeken bij patiënten die terbutaline subcutaan kregen, hebben geen preferentieel bèta-2-adrenerge effect aangetoond.
de farmacologische effecten van bèta-adrenerge agonisten, waaronder Terbutaline, zijn ten minste gedeeltelijk toe te schrijven aan stimulatie via bèta-adrenerge receptoren van intracellulair adenylcyclase, het enzym dat de omzetting van adenosinetrifosfaat (ATP) in cyclisch 3′,5′-adenosinemonofosfaat (cAMP) katalyseert. Verhoogde cAMP-niveaus worden geassocieerd met ontspanning van bronchiale gladde spieren en remming van de afgifte van mediatoren van onmiddellijke overgevoeligheid van cellen, vooral van mestcellen.
gecontroleerde klinische studies hebben aangetoond dat Terbutalinesulfaatinjectie bronchospasme verlicht bij acute en chronische obstructieve longziekte door een significante verhoging van de pulmonale stroomsnelheden (bijv. een toename van 15% of meer in FEV1). Na subcutane toediening van 0,25 mg terbutalinesulfaat injectie, treedt een meetbare verandering in de uitademingsdebiet gewoonlijk binnen 5 minuten op, en een klinisch significante toename van FEV1 treedt binnen 15 minuten op. Het maximale effect treedt gewoonlijk binnen 30 tot 60 minuten op en klinisch significante bronchusverwijdende activiteit kan 1,5 tot 4 uur aanhouden. De duur van de klinisch significante verbetering is vergelijkbaar met die waargenomen met equimilligram doses van adrenaline.
preklinisch
onderzoek bij proefdieren (minipigs, knaagdieren en honden) heeft het optreden van hartritmestoornissen en plotselinge dood (met histologische aanwijzingen voor myocardiale necrose) aangetoond wanneer bèta-agonisten en methylxanthinen gelijktijdig worden toegediend. De klinische significantie van deze bevindingen is onbekend.
farmacokinetiek
subcutane toediening van 0,5 mg Terbutalinesulfaat aan 17 gezonde, volwassen, mannelijke proefpersonen resulteerde in een gemiddelde (SD) piekplasmaconcentratie van 9,6 (3,6) ng / mL, die werd waargenomen op een mediane (bereik) tijd van 0,5 (0,08 tot 1,0) uur na toediening. De gemiddelde (SD) AUC (0 tot 48) en totale lichaamsklaringswaarden waren respectievelijk 29,4 (14,2) uur•ng/mL en 311 (112) mL/min. De terminale halfwaardetijd werd bepaald bij 9 van de 17 proefpersonen en had een gemiddelde (SD) van 5,7 (2,0) uur.
na subcutane toediening van 0,25 mg Terbutalinesulfaat aan twee mannelijke proefpersonen werden piek Terbutalineserumconcentraties van 5,2 en 5,3 ng/mL waargenomen ongeveer 20 minuten na toediening.de eliminatiehalfwaardetijd van het geneesmiddel bij 10 van de 14 patiënten was ongeveer 2,9 uur na subcutane toediening, maar langere eliminatiehalfwaardetijden (tussen 6 en 14 uur) werden gevonden bij de andere 4 patiënten. Ongeveer 90% van het geneesmiddel werd uitgescheiden in de urine 96 uur na subcutane toediening, met ongeveer 60% van dit onveranderd geneesmiddel. Het lijkt erop dat het sulfaatconjugaat een belangrijke metaboliet van Terbutaline is en dat uitscheiding via de urine de primaire eliminatieroute is.
indicaties en gebruik voor Terbutaline
Terbutalinesulfaat injectie is USP geïndiceerd voor de preventie en omkering van bronchospasme bij patiënten van 12 jaar en ouder met astma en reversibel bronchospasme geassocieerd met bronchitis en emfyseem.
contra-indicaties
1. Langdurige tocolyse
Terbutalinesulfaat is niet goedgekeurd en mag niet worden gebruikt voor langdurige tocolyse (langer dan 48-72 uur). In het bijzonder dient Terbutalinesulfaat niet te worden gebruikt voor het onderhoud van tocolyse in de poliklinische of thuisomgeving (zie waarschuwing in doos: langdurige tocolyse).
2. Overgevoeligheid
Terbutalinesulfaat injectie is gecontra-indiceerd bij patiënten waarvan bekend is dat ze overgevoelig zijn voor sympathicomimetische aminen of voor een onderdeel van dit geneesmiddel.
waarschuwingen
verslechtering van astma
astma kan acuut verslechteren over een periode van uren of chronisch over meerdere dagen of langer. Als de patiënt meer doses Terbutalinesulfaat dan normaal nodig heeft, kan dit een marker van destabilisatie van astma zijn en vereist herevaluatie van de patiënt en het behandelingsregime, waarbij speciale aandacht wordt besteed aan de mogelijke behoefte aan ontstekingsremmende behandeling, bijv. corticosteroïden.
gebruik van ontstekingsremmers
het gebruik van bèta-adrenerge agonistische bronchodilatatoren alleen is mogelijk niet voldoende om astma onder controle te houden bij veel patiënten. Het toevoegen van ontstekingsremmende middelen, bijvoorbeeld corticosteroïden, moet in een vroeg stadium worden overwogen.
cardiovasculaire effecten
Terbutalinesulfaat kan, net als alle andere bèta-adrenerge agonisten, bij sommige patiënten een klinisch significant cardiovasculair effect veroorzaken, gemeten aan de hand van polsslag, bloeddruk en/of symptomen. Hoewel dergelijke effecten soms optreden na toediening van Terbutalinesulfaat in aanbevolen doses, kan het nodig zijn om het geneesmiddel te stoppen als ze optreden. Bovendien is gemeld dat bèta‑agonisten veranderingen in het elektrocardiogram (ECG) veroorzaken, zoals afvlakking van de T-golf, verlenging van het QTc-interval en St-segmentdepressie. De klinische significantie van deze bevindingen is onbekend. Daarom moet Terbutalinesulfaat, zoals alle sympathicomimetische aminen, met voorzichtigheid worden gebruikt bij patiënten met cardiovasculaire aandoeningen, in het bijzonder coronaire insufficiëntie, hartritmestoornissen en hypertensie.convulsies
convulsies
Er zijn zeldzame meldingen geweest van convulsies bij patiënten die Terbutaline kregen; convulsies kwamen niet meer voor bij deze patiënten nadat het gebruik van het geneesmiddel was gestaakt.
voorzorgsmaatregelen
Algemeen
Terbutaline moet, zoals bij alle sympathicomimetische aminen, met voorzichtigheid worden gebruikt bij patiënten met cardiovasculaire aandoeningen, waaronder ischemische hartziekten, hypertensie en hartritmestoornissen; bij patiënten met hyperthyreoïdie of diabetes mellitus; en bij patiënten die ongewoon reageren op sympathicomimetische aminen of die convulsieve stoornissen hebben. Significante veranderingen in systolische en diastolische bloeddruk zijn waargenomen en kunnen naar verwachting optreden bij sommige patiënten na gebruik van een bèta-adrenerge bronchodilatator.
onmiddellijke overgevoeligheidsreacties en exacerbaties van bronchospasme zijn gemeld na toediening van Terbutaline.
bèta-adrenerge agonisten kunnen bij sommige patiënten significante hypokaliëmie veroorzaken, mogelijk door intracellulair rangeren, wat mogelijk nadelige cardiovasculaire effecten kan veroorzaken. De daling is meestal van voorbijgaande aard en vereist geen suppletie.
hoge doses intraveneus Terbutaline verergeren reeds bestaande diabetes mellitus en ketoacidose.
geneesmiddelinteracties
gelijktijdig gebruik van terbutalinesulfaat injectie met andere sympathicomimetica wordt niet aanbevolen, omdat het gecombineerde effect op het cardiovasculaire systeem schadelijk kan zijn voor de patiënt.
monoamineoxidaseremmers of tricyclische antidepressiva: Terbutaline dient met uiterste voorzichtigheid te worden toegediend aan patiënten die worden behandeld met monoamineoxidaseremmers of tricyclische antidepressiva, of binnen 2 weken na stopzetting van dergelijke middelen, omdat de werking van Terbutaline op het vasculaire systeem kan worden versterkt.
bètablokkers: Bètablokkers blokkeren niet alleen het pulmonale effect van bèta-agonisten, zoals terbutalinesulfaatinjectie, maar kunnen ook ernstige bronchospasmen veroorzaken bij astmatische patiënten. Daarom dienen astmapatiënten normaal gesproken niet met bètablokkers te worden behandeld. Onder bepaalde omstandigheden, bijvoorbeeld als profylaxe na een myocardinfarct, kunnen er echter geen aanvaardbare alternatieven zijn voor het gebruik van bèta-adrenerge blokkers bij patiënten met astma. In deze omgeving kunnen cardioselectieve bètablokkers worden overwogen, hoewel deze met voorzichtigheid dienen te worden toegediend.
diuretica: de ECG-veranderingen en/of hypokaliëmie die het gevolg kunnen zijn van de toediening van niet-kaliumsparende diuretica (zoals lus-of thiazidediuretica) kunnen acuut verergeren door bèta-agonisten, vooral wanneer de aanbevolen dosis van de bèta-agonist wordt overschreden. Hoewel de klinische significantie van deze effecten niet bekend is, is voorzichtigheid geboden bij gelijktijdige toediening van bèta-agonisten met niet-kaliumsparende diuretica.
carcinogenese, mutagenese, verminderde vruchtbaarheid
in een 2 jaar durend onderzoek bij Sprague-Dawley ratten veroorzaakte Terbutalinesulfaat een significante en dosisgerelateerde toename in de incidentie van benigne leiomyomen van het mesovarium bij voedingsdoses van 50 mg/kg en hoger (ongeveer 810 keer de maximale aanbevolen dagelijkse subcutane (sc) dosis voor volwassenen op basis van mg / m2). In een 21 maanden durend onderzoek bij CD-1 muizen toonde Terbutalinesulfaat geen bewijs van tumorgeniciteit bij voedingsdoses tot 200 mg/kg (ongeveer 1600 keer de maximale aanbevolen dagelijkse sc dosis voor volwassenen op basis van mg/m2). Het mutageniteitspotentieel van Terbutalinesulfaat is niet vastgesteld.
reproductiestudies bij ratten waarbij Terbutalinesulfaat werd gebruikt, toonden geen verslechtering van de vruchtbaarheid aan bij orale doses tot 50 mg/kg (ongeveer 810 keer de maximale aanbevolen dagelijkse sc dosis voor volwassenen op basis van mg/m2).
zwangerschap-teratogene effecten
zwangerschap categorie C
Er zijn geen adequate en goed gecontroleerde studies met Terbutalinesulfaat bij zwangere vrouwen uitgevoerd. Gepubliceerde dierstudies tonen aan dat nakomelingen van ratten veranderingen vertonen in gedrag en hersenontwikkeling, waaronder verminderde cellulaire proliferatie en differentiatie wanneer moederdieren subcutaan werden behandeld met Terbutaline tijdens de late fase van de dracht en lactatieperiode. De blootstelling aan Terbutaline bij ratten was ongeveer 24 tot 48 maal de gebruikelijke humane dosis bij volwassenen van 2-4 mg/dag, op basis van mg/m2.
Terbutalinesulfaat is niet goedgekeurd en dient niet te worden gebruikt voor langdurige tocolyse (langer dan 48-72 uur). In het bijzonder mag Terbutalinesulfaat niet worden gebruikt voor het onderhoud van tocolyse in de poliklinische of thuisomgeving. Ernstige bijwerkingen, waaronder overlijden, zijn gemeld na toediening van Terbutalinesulfaat aan zwangere vrouwen. Bij de moeder omvatten deze bijwerkingen verhoogde hartslag, voorbijgaande hyperglycemie, hypokaliëmie, hartritmestoornissen, longoedeem en myocardiale ischemie. Verhoogde foetale hartslag en neonatale hypoglykemie kunnen optreden als gevolg van maternale toediening (zie waarschuwing in doos: verlengde tocolyse en contra-indicaties: verlengde tocolyse).
in dierstudies naar de embryofoetale ontwikkeling werden geen teratogene effecten waargenomen bij nakomelingen wanneer drachtige ratten en konijnen terbutalinesulfaat kregen in orale doses tot 50 mg/kg/dag, respectievelijk ongeveer 810 en 1600 maal de maximale aanbevolen dagelijkse subcutane dosis voor volwassenen, op basis van mg/m2.
Terbutalinesulfaat mag tijdens de zwangerschap alleen worden gebruikt als de mogelijke voordelen het potentiële risico voor de foetus rechtvaardigen.
gebruik tijdens de bevalling
vanwege de mogelijkheid van bèta-agonistische interferentie met uteriene contractiliteit, moet het gebruik van terbutalinesulfaatinjectie ter verlichting van bronchospasme tijdens de bevalling worden beperkt tot patiënten bij wie de voordelen duidelijk opwegen tegen het risico.
Terbutaline passeert de placenta. Na een enkelvoudige intraveneuze toediening van Terbutaline aan 22 vrouwen in de late zwangerschap die om klinische redenen door middel van een keizersnede werden bevallen, bleken de terbutaline-spiegels in het navelstrengbloed te variëren van 11% tot 48% van de maternale bloedspiegels.
moeders die borstvoeding geven
Het is niet bekend of dit geneesmiddel wordt uitgescheiden in de moedermelk. Daarom mag Terbutalinesulfaatinjectie alleen tijdens het geven van borstvoeding worden gebruikt als het potentiële voordeel opweegt tegen het mogelijke risico voor de pasgeborene.
pediatrisch gebruik
Terbutalinesulfaat injectie wordt niet aanbevolen voor patiënten jonger dan 12 jaar vanwege onvoldoende klinische gegevens om de veiligheid en werkzaamheid vast te stellen.
geriatrisch gebruik
klinische studies met terbutalinesulfaatinjectie omvatten niet voldoende personen van 65 jaar en ouder om te bepalen of zij anders reageren dan jongere personen. In andere gerapporteerde klinische ervaring zijn geen verschillen in respons vastgesteld tussen oudere en jongere patiënten. In het algemeen dient de dosiskeuze voor een oudere patiënt voorzichtig te zijn, gewoonlijk beginnend bij de lage kant van het doseringsbereik, hetgeen de hogere frequentie van een verminderde lever -, nier-of hartfunctie en van bijkomende ziekten of andere medicamenteuze therapie weerspiegelt.
bijwerkingen
bijwerkingen waargenomen bij injectie met Terbutalinesulfaat zijn vergelijkbaar met de bijwerkingen die vaak worden gezien bij andere sympathicomimetica. Al deze reacties zijn van voorbijgaande aard en vereisen gewoonlijk geen behandeling.
de volgende tabel vergelijkt de bijwerkingen die werden gezien bij patiënten die werden behandeld met terbutalinesulfaat injectie (0,25 mg en 0,5 mg), met de bijwerkingen die werden gezien bij patiënten die werden behandeld met epinefrine injectie (0,25 mg en 0,5 mg), tijdens acht dubbelblinde cross-over studies waarbij in totaal 214 patiënten betrokken waren.
| Incidence (%) of Adverse Reactions | |||||
| Terbutaline (%) | Epinephrine (%) | ||||
|
0.25 mg |
0.5 mg N = 205 |
0.25 mg N = 153 |
0.5 mg N = 61 |
||
| Reaction Central Nervous System |
|||||
| Tremor | 7.8 | 38.0 | 16.3 | 18.0 | |
| Nervousness | 16.9 | 30.7 | 8.5 | 31.1 | |
| Dizziness | 1.3 | 10.2 | 7.8 | 3.3 | |
| Headache | 7.8 | 8.8 | 3.3 | 9.8 | |
| Drowsiness | 11.7 | 9.8 | 14.4 | 8.2 | |
| Cardiovascular | |||||
| Palpitations | 7.8 | 22.9 | 7.8 | 29.5 | |
| Tachycardia | 1.3 | 1.5 | 2.6 | 0.0 | |
| Respiratory | |||||
| Dyspnea | 0.0 | 2.0 | 2.0 | 0.0 | |
| Chest discomfort | 1.3 | 1.5 | 2.6 | 0.0 | |
| Gastrointestinal | |||||
| Nausea/vomiting | 1.3 | 3.9 | 1.3 | 11.5 | |
| Systemic | |||||
| Weakness | 1.3 | 0.5 | 2.6 | 1.6 | |
| Flushed feeling | 0.0 | 2.4 | 1.3 | 0.0 | |
| Sweating | 0.0 | 2.4 | 0.0 | 0.0 | |
| Pain at injection site | 2.6 | 0.5 | 2.6 | 1.6 | |
Opmerking: Sommige patiënten kregen meer dan één dosissterkte van Terbutalinesulfaat en epinefrine. Daarnaast waren er meldingen van angst, spierkrampen en droge mond (< 0,5%). Er zijn zeldzame meldingen geweest van verhogingen van leverenzymen en van overgevoeligheidsvasculitis bij toediening van Terbutaline.
neem contact op met Hikma Pharmaceuticals USA Inc.. op 1-877-233-2001, of de FDA op 1-800-FDA-1088 of www.fda.gov/medwatch
overdosering
de mediane SC letale dosis van Terbutalinesulfaat bij volwassen ratten was ongeveer 165 mg/kg (ongeveer 2.700 keer de maximale aanbevolen dagelijkse sc dosis voor volwassenen op basis van mg / m2). De mediane SC letale dosis Terbutalinesulfaat bij jonge ratten was ongeveer 2000 mg/kg (ongeveer 32.000 maal de maximale aanbevolen dagelijkse sc dosis voor volwassenen op basis van mg / m2).
de verwachte symptomen bij overdosering zijn die van excessieve bèta-adrenerge stimulatie en / of het optreden of overdrijven van een van de symptomen die vermeld staan onder bijwerkingen, bijv. epileptische aanvallen, angina, hypertensie of hypotensie, tachycardie met snelheden tot 200 slagen per minuut, aritmieën, nervositeit, hoofdpijn, tremor, droge mond, hartkloppingen, misselijkheid, duizeligheid, vermoeidheid, malaise en slapeloosheid. Hypokaliëmie kan ook optreden. Er is geen specifiek antidotum. De behandeling bestaat uit het staken van de injectie met Terbutalinesulfaat in combinatie met een geschikte symptomatische behandeling. Het verstandig gebruik van een cardioselectieve bèta-receptorblokker kan worden overwogen, rekening houdend met het feit dat dergelijke medicatie bronchospasme kan veroorzaken. Er is onvoldoende bewijs om te bepalen of dialyse gunstig is voor overdosering met terbutalinesulfaat injectie.
Terbutaline dosering en toediening
injectieflacons dienen alleen gebruikt te worden voor subcutane toediening en niet voor intraveneuze infusie.
steriliteit en nauwkeurige dosering kunnen niet worden gegarandeerd als de injectieflacons niet in overeenstemming met dosering en toediening worden gebruikt.
ongebruikte portie weggooien na eenmalig gebruik.
de gebruikelijke subcutane dosis Terbutalinesulfaat injectie is 0,25 mg geïnjecteerd in de laterale deltoïdeus. Indien binnen 15 tot 30 minuten geen significante klinische verbetering optreedt, kan een tweede dosis van 0,25 mg worden toegediend. Als de patiënt dan niet binnen 15 tot 30 minuten reageert, moeten andere therapeutische maatregelen worden overwogen. De totale dosis binnen 4 uur mag niet hoger zijn dan 0,5 mg.
opmerking: parenterale geneesmiddelen moeten vóór toediening visueel worden geïnspecteerd op deeltjes en verkleuring, wanneer de oplossing en de verpakking dat toelaten.
Hoe wordt Terbutaline geleverd
Terbutalinesulfaat injectie, USP, 1 mg / mL, wordt geleverd in een volume van 1 mL in een amberkleurige glazen injectieflacon van 2 mL. Elke injectieflacon bevat 1 mg Terbutalinesulfaat per 1 mL oplossing; 0,25 mL oplossing levert de gebruikelijke klinische dosis van 0,25 mg op.
NDC 0143-9375-10 doos met 10 injectieflacons.
Bewaren bij 20 ° tot 25 ° C .
beschermen tegen licht door de injectieflacons in de originele doos te bewaren tot ze zijn afgeleverd.
niet gebruiken als de oplossing verkleurd is.
ongebruikte portie weggooien na eenmalig gebruik.
vervaardigd door: Hikma FARMACÊUTICA (PORTUGAL), S. A.. Estrada do Rio da Mó, nº 8, 8A e 8B-Fervença,
2705-906 Terrugem SNT,
PORTUGAL
verdeeld door:
Hikma Pharmaceuticals USA Inc.
Eatontown, NJ 07724 USA
Novaplus is een geregistreerd handelsmerk van Vizient, Inc.
herzien: Oktober 2020
PIN552-NOV/2
PRINCIPAL DISPLAY PANEEL
NDC 0143-9375-01 Rx ALLEEN
Terbutaline
SULFAAT
INJECTIE, USP
1 mg/mL
VOOR SUBCUTANE
GEBRUIK

PRINCIPAL DISPLAY PANEEL
NDC 0143-9375-10 Rx ALLEEN
Terbutaline
SULFAAT
INJECTIE, USP
1 mg/mL
VOOR SUBCUTANE
GEBRUIK
10 X 1 mL Dosis Flacons
STERIELE, PYROGEENVRIJ, WATERIGE
OPLOSSING VOOR SUBCUTANE INJECTIE.
Niet gebruiken als de oplossing verkleurd IS.
opmerking: de gebruikelijke enkelvoudige dosis IS één vierde
van de inhoud van de injectieflacon. SEE PRESCRIBING
INFORMATION.
SERIALIZATION IMAGE
| Terbutaline SULFATE Terbutaline sulfate injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Hikma Pharmaceuticals USA Inc. (001230762)
Registrant – HIKMA FARMACEUTICA (PORTUGAL), S. A. (452742943)
meer over terbutaline
- bijwerkingen
- Tijdens zwangerschap of borstvoeding
- doseringsinformatie
- Geneesmiddelafbeeldingen
- geneesmiddelinteracties
- vergelijk alternatieven
- prijzen & Coupons
- in het Engels
- 11 beoordeling
- drug klasse: adrenerge luchtwegverwijders
- FDA Waarschuwingen (1)
Consument hulpbronnen
- Patiënt Informatie
- Terbutaline (Advanced Lezen)
- Terbutaline Subcutaan (Geavanceerde Lezen)
Professionele hulpbronnen
- Prescribing Information
- Terbutaline (Professionele Patiënt Advies)
- Terbutaline Tabletten (FDA)
behandeling in Verband met gidsen
- vroeggeboorte
- Allergisch Astma
- Astma, Onderhoud
- Astma, acute
Medische Disclaimer