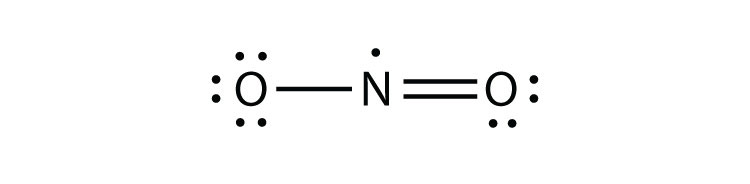
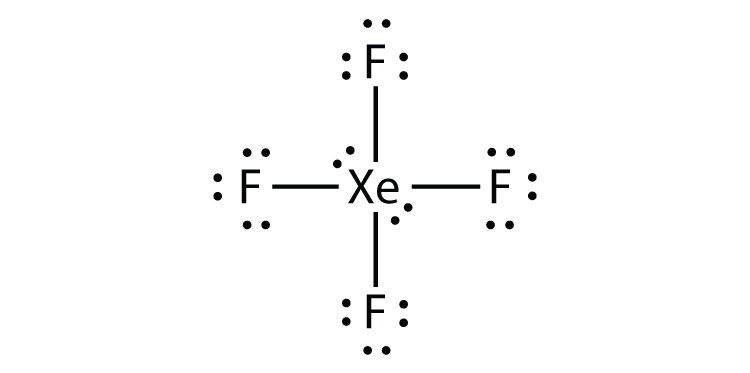
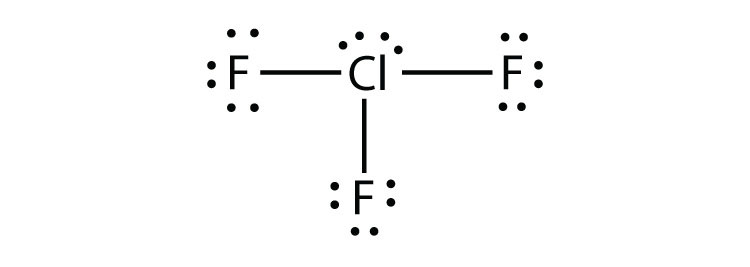
9.5 schendingen van de octetregel
leerdoelstelling
- herkennen de drie belangrijkste soorten schendingen van de octetregel.
zo belangrijk en nuttig als de octetregel is in chemische binding, zijn er enkele bekende schendingen. Dit betekent niet dat de octetregel nutteloos is—integendeel. Zoals met veel regels, zijn er uitzonderingen, of schendingen.
Er zijn drie schendingen van de octetregel. Oneven-elektronenmoleculeneen molecuul met een oneven aantal elektronen in de valentieschil van een atoom. vertegenwoordigen de eerste overtreding van de octet regel. Hoewel ze weinig zijn, hebben sommige stabiele verbindingen een oneven aantal elektronen in hun valentieschelpen. Bij een oneven aantal elektronen moet minstens één atoom in het molecuul de octetregel overtreden. Voorbeelden van stabiele odd-elektronenmoleculen zijn NO, NO2 en ClO2. Het Lewis elektron dot diagram voor NO is als volgt:
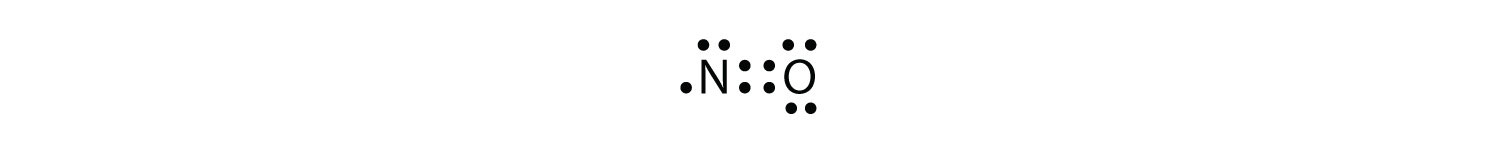
hoewel het O-atoom een octet van elektronen heeft, heeft het n-atoom slechts zeven elektronen in zijn valentieschil. Hoewel NO een stabiele verbinding is, is het zeer chemisch reactief, net als de meeste andere oneven-elektronverbindingen.
Elektronendeficiënte moleculeneen molecuul met minder dan acht elektronen in de valentieschil van een atoom. vertegenwoordigen de tweede overtreding van de octet regel. Deze stabiele verbindingen hebben minder dan acht elektronen rond een atoom in het molecuul. De meest voorkomende voorbeelden zijn de covalente verbindingen van beryllium en borium. Beryllium kan bijvoorbeeld twee covalente bindingen vormen, wat resulteert in slechts vier elektronen in zijn valentieschelp:
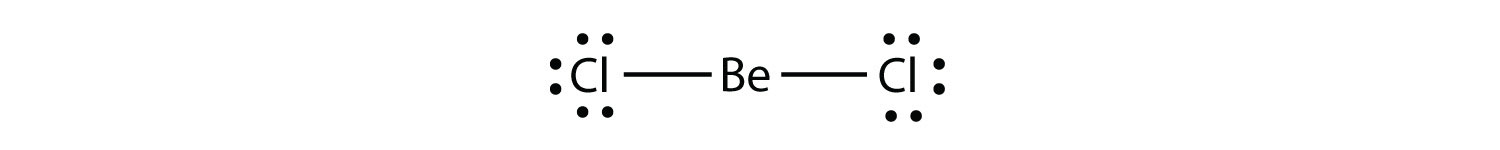
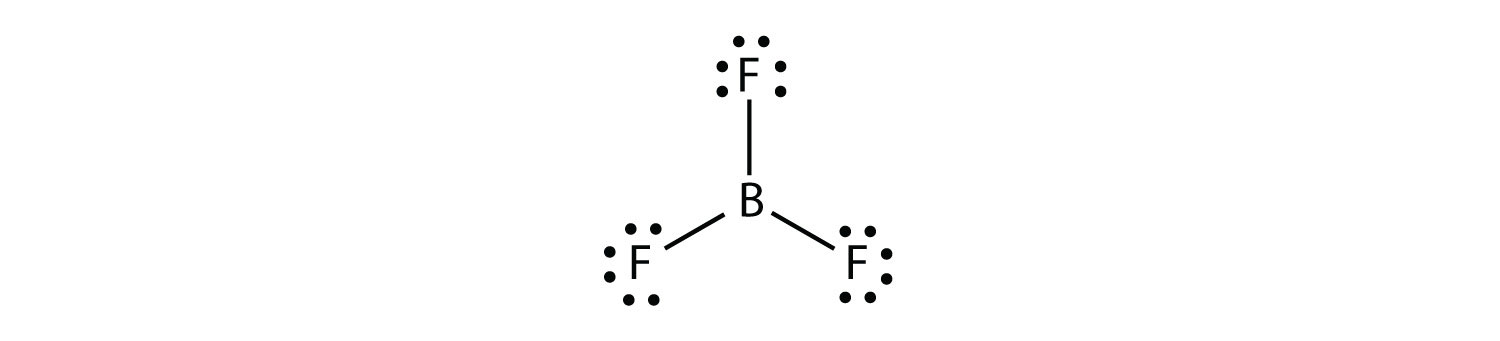
borium maakt gewoonlijk slechts drie covalente bindingen, wat resulteert in slechts zes valentie-elektronen rond het B-atoom. Een bekend voorbeeld is BF3:
de derde overtreding van de octetregel wordt gevonden in verbindingen met meer dan acht elektronen toegewezen aan hun valentieschil. Deze worden genoemd geëxpandeerde moleculen van valentieschelpeenmolecule met meer dan acht elektronen in de valentieschelp van een atoom.. Dergelijke verbindingen worden alleen gevormd door centrale atomen in de derde rij van het periodiek systeem of daarbuiten die lege d-orbitalen in hun valentieschelpen hebben die kunnen deelnemen aan covalente binding. Een van die verbindingen is PF5. Het enige redelijke Lewis-elektronpuntdiagram voor deze verbinding heeft het P-atoom dat vijf covalente bindingen maakt:
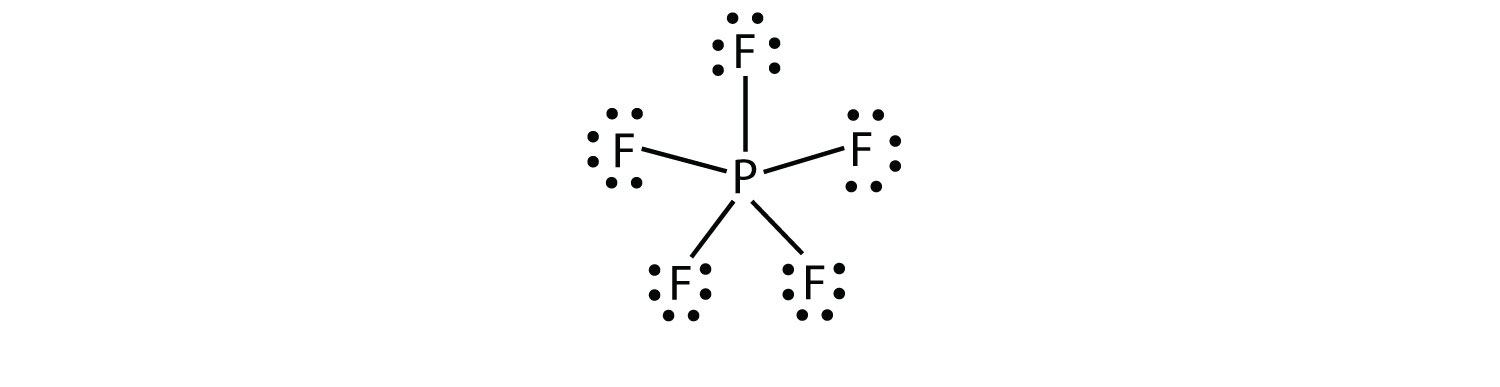
Formeel heeft het P-atoom 10 elektronen in zijn valentieschil.
Voorbeeld 9
Identificeer elke overtreding van de octetregel door een Lewis elektron dot diagram te tekenen.
- ClO
- SF6
oplossing
-
met één Cl-atoom en één O-atoom heeft dit molecuul 6 + 7 = 13 valentie-elektronen, dus het is een oneven-elektronenmolecuul. Een Lewis elektron dot diagram voor dit molecuul is als volgt:

-
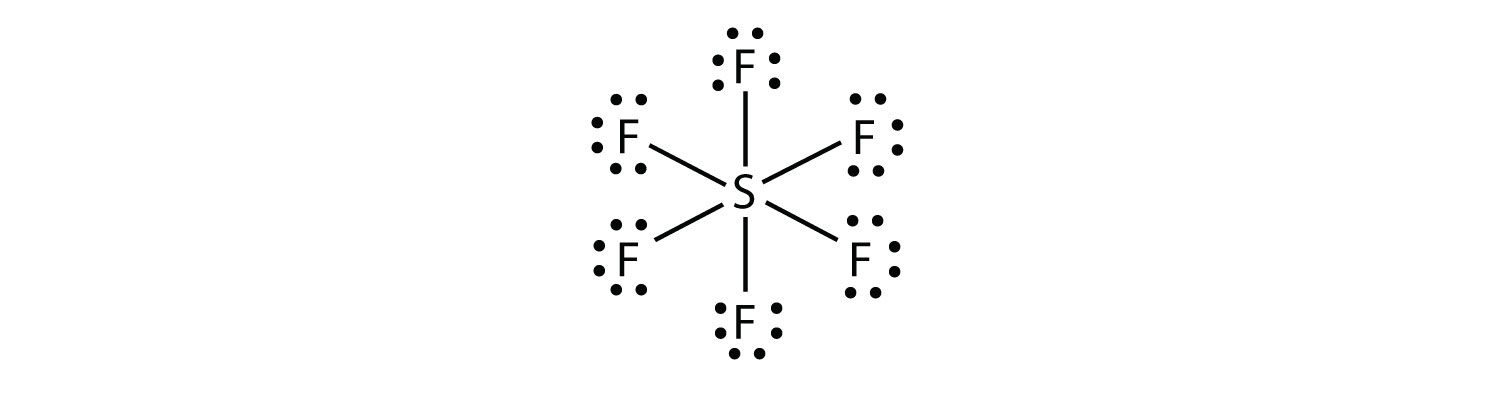
in SF6 maakt het centrale S-atoom zes covalente bindingen met de zes omringende F-atomen, dus is het een geëxpandeerd valentieschelpmolecuul. Zijn Lewis elektron dot diagram is als volgt:
Test uzelf
Identificeer de overtreding van de octetregel in XeF2 door een Lewis elektron dot diagram te tekenen.
antwoord
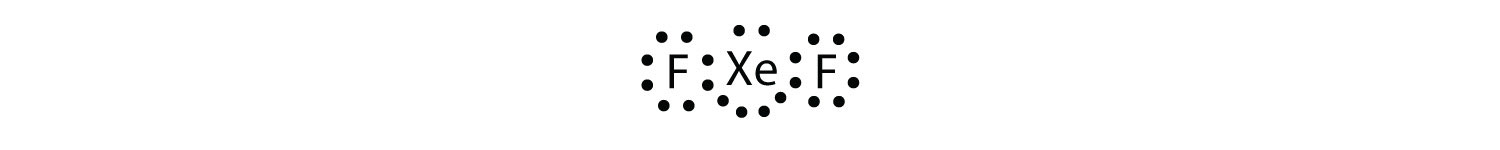
Het XE-atoom heeft een geëxpandeerde valentieschil met meer dan acht elektronen eromheen.
Key Takeaway
- Er zijn drie schendingen van de octetregel: oneven-elektronenmoleculen, elektronendeficiënte moleculen en geëxpandeerde valentieschelpmoleculen.
oefeningen
-
Waarom kan een oneven-elektronenmolecuul niet voldoen aan de octetregel?
-
Waarom kan een atoom in de tweede rij van het periodiek systeem geen geëxpandeerde valentieschelpmoleculen vormen?
-
teken een aanvaardbaar Lewis-elektron-dotdiagram voor deze moleculen die de octetregel overtreden.
- NO2
- XeF4
-
teken een aanvaardbaar Lewis-elektron-dotdiagram voor deze moleculen die de octetregel overtreden.
- BCl3
- ClO2
-
teken een aanvaardbaar Lewis-elektron-dotdiagram voor deze moleculen die de octetregel overtreden.
- POF3
- ClF3
-
teken een aanvaardbaar Lewis-elektron-dotdiagram voor deze moleculen die de octetregel overtreden.
- SF4
- BeH2
antwoorden
-
Er is geen manier om alle elektronen te koppelen als er een oneven aantal van hen.
-
-
-
-