
het molaire volume (symbool Vm) van een stof is het volume dat wordt ingenomen door een mol van de stof bij een bepaalde temperatuur en druk. Het is gelijk aan de molecuulmassa (M) van de stof gedeeld door de dichtheid (ρ) bij de gegeven temperatuur en druk:
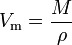
Het heeft een SI-eenheid van kubieke meter per mol (m3/mol). Molaire volumes worden echter vaak uitgedrukt in kubieke meter per 1000 mol (m3/kmol) of kubieke decimeter per mol (dm3/mol) voor gassen en in centimeters per mol (cm3 / mol) voor vloeistoffen en vaste stoffen.
indien een stof een mengsel is dat N-bestanddelen bevat, wordt het molaire volume berekend met behulp van:
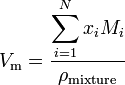
waarbij x i de molfractie van de IDE component is, M i De molecuulmassa van de IDE component en pmixture de mengdichtheid bij de gegeven temperatuur en druk.
bij het bepalen van numerieke waarden voor Molaire volumes is het belangrijk om ook de gegeven temperatuur-en drukomstandigheden te vermelden. Anders zijn de numerieke waarden zinloos.
Ideale gassen
De ideale gaswet vergelijking kan worden herschikt om deze uitdrukking voor het molaire volume van een ideaal gas:
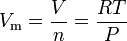
Waar in SI-eenheden:
= het gas absolute druk in Pa
= aantal mol in mol
= het gas molaire volume, in m3/mol
= het gas absolute temperatuur in K
= de universele gaswet constante van 8.314472 m3·Pa·mol-1·K-1
Waar in de VS gebruikelijke eenheden:
= het gas absolute druk in bar
= aantal mol, in een lb-mol
= het gas molaire volume, in ft3/lb-mol
= het gas absolute temperatuur (in graden Rankine (°R)
= de universele gaswet constante van 10.7316 ft3·bar·lb-mol-l·°R-1
Voorbeeld berekeningen van een ideaal gas molaire volume:
- In SI-metrische eenheden:
Vm = 8.314472 × 273.15 / 101,325 = 0.022414 m3/mol bij 0 °C en 101,325 Pa absolute druk = 22.414 m3/kmol bij 0 °C (273.15 K) en 101.325 kPa absolute druk Vm = 8.314472 × 273.15 / 100,000 = 0.022711 m3/kmol bij 0 °C en 100 000 Pa absolute druk = 22.711 m3/kmol bij 0 °C (273.15 K) en 100 kPa absolute druk
- In de gebruikelijke VS-eenheden:
Vm = 10.7316 × 519.67 / 14.696 = 379.48 ft3/lb-mol op 60 °F (519.67 °R) en 14.696 psia
Opmerkingen:
- lb-mol is een afkorting voor pond-mol
- °R graden Rankine (een absolute temperatuurschaal) en °F is graden Fahrenheit (een temperatuur schaal).
- °R = ° F + 459.67
- de technische literatuur kan verwarrend zijn omdat sommige auteurs vaak niet uitleggen of zij de universele gaswet constant R gebruiken, die van toepassing is op elk ideaal gas, dan wel of zij de specifieke gaswet constant Rs gebruiken, die alleen van toepassing is op een specifiek individueel gas. De relatie tussen de twee constanten is Rs = R / M waarbij M De molecuulmassa van het gas is.
reële gassen
reële gassen zijn gassen die geen ideaal gasgedrag vertonen. Voor dergelijke gassen is de eenvoudigste methode om Molaire volumes te bepalen door gebruik te maken van samendrukbaarheidsfactoren zoals in de volgende uitdrukking:
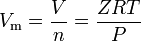
waarbij Z de samendrukbaarheidsfactor is, wat een nuttige thermodynamische eigenschap is voor het aanpassen van de ideale gaswet om rekening te houden met het gedrag van reële gassen. De bovenstaande vergelijking is in principe een eenvoudige vergelijking van de toestand (EOS). De belangrijkste beperking van deze toestandsvergelijking is dat de samendrukbaarheidsfactor Z niet constant is, maar varieert van het ene gas tot het andere, evenals met de temperatuur en druk van het betrokken gas.
nauwkeuriger waarden van reële gasmolaire volumes kunnen worden verkregen met behulp van toestandsvergelijkingen zoals de Van der Waals vergelijking ontwikkeld in 1873, De Redlich-Kwong vergelijking ontwikkeld in 1949, de Soave-Redlich-Kwong vergelijking ontwikkeld in 1972 en de Peng-Robinson vergelijking ontwikkeld in 1976.
- 1,0 1.1 International Union of Pure and Applied chemistry (IUPAC): Quantities, Units and Symbols in Physical Chemistry 2nd Edition, 1993
- 2.0 2.1 NIST Guide to SI Item 8.6.3 in Section 8
- 3.0 3.1 Determination of gas samendrukbaarheid values Information on how to determinate gas samendrukbaarheid factors and molar volumes.
| |
sommige inhoud op deze pagina is mogelijk eerder op Citizendium verschenen. |