sleuteltermen
zorg ervoor dat u de onderstaande sleuteltermen kunt definiëren en in context kunt gebruiken.
- Adams’ katalysator
- hydrogenering
onderzoeksnotities
chemische reacties die heterogeen zijn hebben reactanten die zich in ten minste twee verschillende fasen bevinden (bv. gas met een vaste stof), terwijl homogene reacties in een enkele fase voorkomen (bv. gas met een ander gas).
Er kan enige verwarring ontstaan door de beschrijving van de katalysator die wordt gebruikt bij de reactie tussen alkenen en waterstof. Drie metalen—nikkel, platina en palladium—worden vaak gebruikt, maar een chemicus kan niet zomaar een stuk van een van deze metalen in een mengsel van alkeen en waterstof plaatsen en een reactie krijgen. Elke metaalkatalysator moet op een speciale manier worden bereid:
- nikkel wordt gewoonlijk gebruikt in een fijn verdeelde vorm die “Raney-nikkel” wordt genoemd.”Het wordt bereid door een Ni-Al-legering te reageren met NaOH.
- palladium wordt commercieel “ondersteund” verkregen op een inerte stof, zoals houtskool (PD/C). Het alkeen wordt gewoonlijk opgelost in ethanol wanneer Pd / C als katalysator wordt gebruikt.
- platina wordt gebruikt als Pto2, Adams’ katalysator, hoewel het eigenlijk platina metaal is dat de katalysator is. De waterstof gebruikt om toe te voegen aan de koolstof-koolstof dubbele binding vermindert ook het platina(IV) oxide tot fijn verdeeld platina metaal. Ethanol of azijnzuur wordt gebruikt als oplosmiddel voor het alkeen.
andere soorten verbindingen die meerdere bindingen bevatten, zoals ketonen, esters en nitrillen, reageren niet met waterstof onder de omstandigheden die worden gebruikt om alkenen te hydrogeneren. De onderstaande voorbeelden laten een reductie van een alkeen zien, maar de aanwezige keton-en nitrilgroepen blijven intact en worden niet verminderd.

aromatische ringen worden ook niet verminderd onder de omstandigheden die worden gebruikt om alkenen te verminderen, hoewel deze ringen drie koolstof-koolstof dubbele bindingen lijken te bevatten. Zoals u later zult zien, bevatten aromatische ringen eigenlijk geen dubbele bindingen, en veel chemici geven er de voorkeur aan de benzeenring voor te stellen als een zeshoek met een cirkel erin

in plaats van als een zeshoek met drie afwisselende dubbele bindingen.
de representatie van de benzeenring zal verder worden besproken in Paragraaf 15.2.
de reactie tussen koolstof-koolstof dubbele bindingen en waterstof is een methode om het aantal dubbele bindingen in een verbinding te bepalen. Een mol cyclohexeen reageert bijvoorbeeld met een mol waterstof tot een mol cyclohexaan:

maar een mol 1,4-cyclohexadieen reageert met twee mol waterstof tot een mol cyclohexaan:
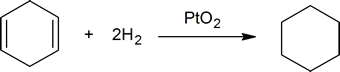
een chemicus zou zeggen dat cyclohexeen reageert met één equivalent waterstof, en 1,4-cyclohexadieen reageert met twee equivalenten waterstof. Als je een bekende hoeveelheid van een onbekende onverzadigde koolwaterstof neemt en bepaalt hoeveel waterstof het zal opnemen, kun je gemakkelijk het aantal dubbele bindingen in de koolwaterstof bepalen (zie vraag 2 hieronder).
toevoeging van waterstof aan een koolstof-koolstof dubbele binding wordt hydrogenering genoemd. Het totale effect van een dergelijke toevoeging is de reductieve verwijdering van de functionele groep met dubbele binding. Regioselectiviteit is geen probleem, aangezien dezelfde groep (een waterstofatoom) is gebonden aan elk van de dubbele bindingen koolstof. De eenvoudigste bron van twee waterstofatomen is moleculaire waterstof (H2), maar het mengen van alkenen met waterstof resulteert niet in een waarneembare reactie. Hoewel de totale hydrogeneringsreactie exotherm is, voorkomt een hoge activeringsenergie dat deze onder normale omstandigheden plaatsvindt. Deze beperking kan worden omzeild door het gebruik van een katalysator, zoals in het volgende diagram is aangegeven.
een voorbeeld van een alkeen-additie is een proces dat hydrogenation.In een hydrogeneringsreactie, twee waterstofatomen worden toegevoegd over de dubbele binding van een alkeen, resulterend in een verzadigd alkaan. Hydrogenering van een dubbele binding is een thermodynamisch gunstige reactie omdat het een stabieler (lagere energie) product vormt. Met andere woorden, de energie van het product is lager dan de energie van de reactant; dus is het exotherm (warmte komt vrij). De vrijgekomen warmte wordt de warmte van hydrogenering genoemd, die een indicator is van de stabiliteit van een molecuul.


katalysatoren zijn stoffen die de snelheid (snelheid) van een chemische reactie veranderen zonder te worden geconsumeerd of als onderdeel van het product te verschijnen. Katalysatoren werken door de activeringsenergie van reacties te verlagen, maar ze veranderen de relatieve potentiële energie van de reactanten en producten niet. Fijn verdeelde metalen, zoals platina, palladium en nikkel, behoren tot de meest gebruikte hydrogeneringskatalysatoren. Katalytische hydrogenering vindt plaats in ten minste twee fasen, zoals weergegeven in het diagram. Eerst moet het alkeen worden geadsorbeerd aan het oppervlak van de katalysator samen met een deel van de waterstof. Vervolgens verschuiven twee waterstofverbindingen van het metaaloppervlak naar de koolstoffen van de dubbele binding, en de resulterende verzadigde koolwaterstof, die zwakker wordt geadsorbeerd, verlaat het katalysatoroppervlak. De exacte aard en timing van de laatste gebeurtenissen is niet goed begrepen.

zoals te zien is in het energiediagram, is de hydrogenering van alkenen exotherm en komt de warmte vrij die overeenkomt met de ΔE (gekleurd groen) in het diagram. Deze reactiewarmte kan worden gebruikt om de thermodynamische stabiliteit van alkenen met verschillende aantallen alkylsubstituenten op de dubbele binding te evalueren. De volgende tabel geeft bijvoorbeeld de hydrogeneringswarmte weer voor drie C5H10-alkenen die hetzelfde alkaanproduct (2-methylbutaan) opleveren. Aangezien een grote reactiewarmte wijst op een hoge energiereactant, zijn deze warmtehaarden omgekeerd evenredig met de stabiliteit van de alkeenisomeren. Bij benadering zien we dat elke alkylsubstituent op een dubbele binding deze functionele groep met iets meer dan 1 kcal/mol stabiliseert.
| Alkene Isomer | (CH3)2CHCH=CH2 3-methyl-1-butene |
CH2=C(CH3)CH2CH3 2-methyl-1-butene |
(CH3)2C=CHCH3 2-methyl-2-butene |
|---|---|---|---|
| Heat of Reaction ( ΔHº ) |
–30.3 kcal/mole | –28.5 kcal/mole | –26.9 kcal/mole |

uit het hier getoonde mechanisme zouden we verwachten dat de toevoeging van waterstof optreedt met syn-stereoselectiviteit. Dit is vaak waar, maar de hydrogeneringskatalysatoren kunnen ook isomerisatie van de dubbele binding veroorzaken voorafgaand aan waterstoftoevoeging, in welk geval de stereoselectiviteit onzeker kan zijn.

oefeningen
- In de reactie
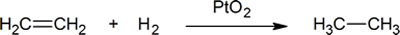
- 0.500 mol etheen reageert met _______ mol waterstof. Zo zou een chemicus kunnen zeggen dat etheen reageert met een _ _ _ _ _ _ _ waterstof.
- etheen wordt ________; terwijl _ _ _ _ _ _ _ _ wordt geoxideerd.
- het oxidatiegetal van koolstof in etheen is _______; in ethaan is het_______.
- wanneer 1.000 g van een bepaald triglyceride (vet) wordt behandeld met waterstofgas in aanwezigheid van de Adams-katalysator, wordt vastgesteld dat het volume waterstofgas dat wordt verbruikt bij 99,8 kPa en 25,0°C 162 mL bedraagt. Een afzonderlijk experiment geeft aan dat de molaire massa van het vet 914 g mol−1 is. Hoeveel koolstof-koolstof dubbele bindingen bevat de verbinding?
antwoorden:
-
-
Toon antwoord
-
Toon antwoord
-
Toon antwoord
-
-
Antwoord
Examples
Question
Predict the products if the following alkenes were reacted with catalytic hydrogen.

Solution

Contributors
- Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
- Prof. Steven Farmer (Sonoma State University)
- organische chemie met een biologische nadruk door Tim Soderberg (University Of Minnesota, Morris)