hoeveel energie komt vrij bij ATP-hydrolyse?
Reader Mode
ATP wordt vaak aangeduid als de energievaluta van de cel. Honderden reacties in de cel van metabolische transformaties aan signalerende gebeurtenissen worden gekoppeld aan de hydrolyse (letterlijk betekenend “water het losmaken”) van ATP door water . De reactie ATP + H2O <> ADP + Pi transformeert adenosinetrifosfaat (ATP) in adenosinedifosfaat (ADP) en anorganisch fosfaat (Pi). De vrije energieverandering verbonden aan deze reactie drijft een grote fractie van cellulaire reacties met het membraanpotentieel en het verminderen van macht die de andere twee dominante energiebronnen zijn. Maar hoeveel is deze energievaluta precies waard en wat onthult het over de chemische transacties die kunnen worden gekocht? Natuurlijk is er geen enkel antwoord op deze vraag omdat de hoeveelheid energie die vrijkomt door deze hydrolysereactie afhangt van de intracellulaire condities, maar het is mogelijk om een gevoel te krijgen voor de geschatte “waarde” van deze valuta door gebruik te maken van enkele eenvoudige schattingen.

figuur 1: het verband tussen de Gibbs vrije energie van ATP-hydrolyse onder standaardomstandigheden en de evenwichtsconstante en het verband tussen de vrije energie van hydrolyse onder fysiologische omstandigheden en de fysiologische concentraties van de reactanten.
De Gibbs-vrije energieverandering (ΔG) als gevolg van ATP-hydrolyse hangt af van de concentraties van de verschillende deelnemers aan de reactie zoals afgebeeld in Figuur 1. Wanneer de concentraties verder van hun evenwichtswaarden verwijderd zijn, is de absolute waarde van ΔG groter. Onder “standaard” voorwaarden (d.w.z. de Gibbs vrije energie van ATP hydrolyse varieert van -28 tot -34 kJ / mol (d.w.z. ≈12 kBT, BNID 101989) afhankelijk van de concentratie van het kation Mg2+. De afhankelijkheid van Mg-ionen treedt op omdat de positief geladen magnesiumionen helpen om het ATP-molecuul te stabiliseren. In de cel liggen de omstandigheden echter nooit eens in de buurt van de standaardstatuswaarden. Bijvoorbeeld, zou een concentratie van 1m ATP betekenen dat de massa van opgeloste stof gelijkaardig aan die van het wateroplosmiddel zelf zou zijn. In figuur 1 Laten we de vaak verwarrende afleiding zien van de fysiologische vrije energie (ΔG) gegeven de verhouding tussen concentraties en de standaardwaarde (ΔGo). De verdeling door termen die nodig zijn om te zorgen voor eenheden als logaritme moet altijd een unitless term bevatten. Het is soms verrassend om te denken dat als de cel bij evenwicht was, de waarde van ΔG nul zou zijn geweest, en er geen energie zou zijn om door ATP hydrolyse te bereiken. Gelukkig is dit nooit het geval bij levende organismen. .
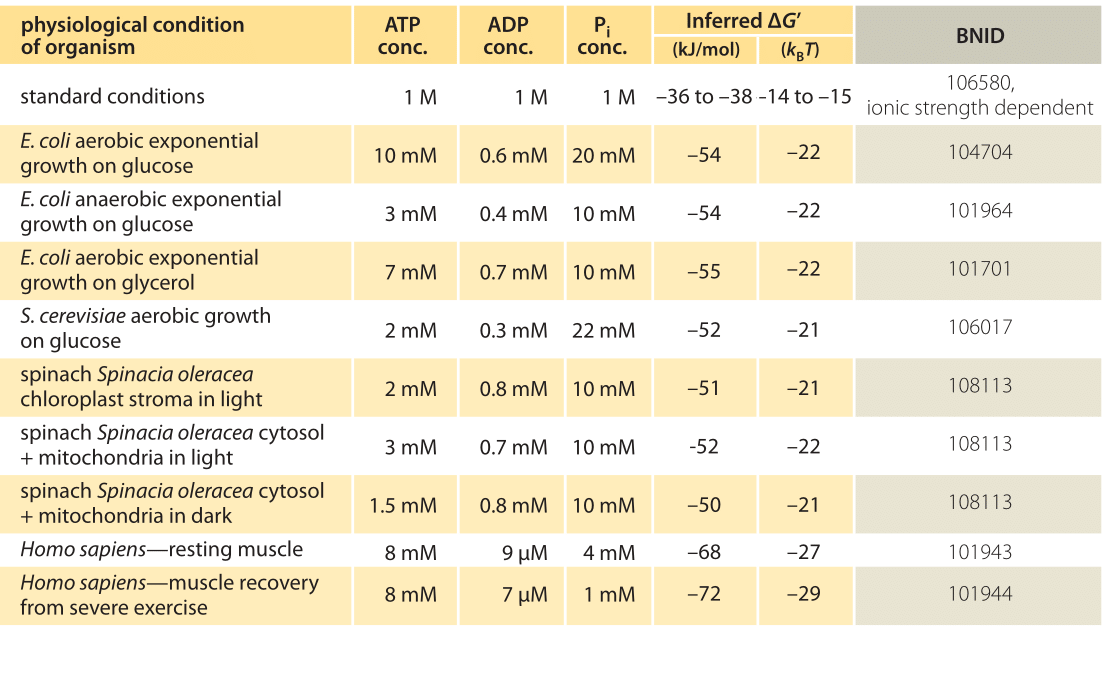
Tabel 1: vrije energie voor ATP-hydrolyse in verschillende organismen en onder verschillende fysiologische omstandigheden. Afgeleide ΔG ‘- berekeningen op basis van een waarde van ΔG’0 van -37,6 kJ/mol. Dit maakt de tabelwaarden onderling consistent, maar leidt tot kleine afwijkingen van de ΔG’ – waarden die in de primaire bronnen worden gerapporteerd. Dergelijke afwijkingen kunnen het gevolg zijn van variaties in Ionische sterkte, pH en meetmethoden vooroordelen. De waarden worden afgerond op één of twee significante cijfers. Bij spinazie, waar de Pi-concentratie niet werd gemeld, werd een karakteristieke waarde van 10 mM gebruikt (BNID 103984, 103983, 111358, 105540).
In de praktijk hangen de fysiologische omstandigheden af van het organisme dat wordt onderzocht, het weefsel of compartiment in de betrokken cel en van de huidige energiebehoefte voor metabole en andere reacties. Bijvoorbeeld, in geperfuseerde rattenlever werd de verhouding ATP aan ADP gevonden om ongeveer 10:1 in cytosol maar 1:10 in mitochondria onder hoge tarieven van glycolyse te zijn, en onder lage tarieven van glycolyse waren beide verhoudingen veel dicht bij 1 (BNID 111357). Daarom wordt een bereik van waarden voor ΔG verwacht. De sleutel tot het begrijpen van dit bereik is om een idee te krijgen van hoeveel Q verschilt van K, dat wil zeggen hoe de concentraties verschillen van standaardomstandigheden. De typische intracellulaire concentraties van alle relevante componenten (ATP, ADP en Pi) liggen in het mM-bereik, veel lager dan standaardomstandigheden. De verhouding / met concentraties in het mM-bereik is veel lager dan één, en de reactie zal energetisch gunstiger zijn dan bij standaardomstandigheden zoals weergegeven in Tabel 1. De hoogste waarde ≈-70 kJ / mol (≈30kBT) werd berekend uit waarden in de menselijke spier van atleten die herstelden na inspanning (BNID 101944). In E. coli cellen die groeien op glucose, werd een waarde van -47 kJ/mol gerapporteerd (≈20kBT, BNID 101964). Om deze getallen in perspectief te plaatsen, een moleculaire motor die een kracht van ongeveer 5 pN (BNID 101832) over een 10 nm (BNID 101857) stapgrootte uitoefent werkt van orde 50 PN nm, die iets meer dan 10 kBT energie, ruim binnen het bereik van wat een enkele ATP kan leveren.
de berekeningen van ΔG vereisen een nauwkeurige meting van de relevante intracellulaire concentraties. Dergelijke concentraties worden in vivo gemeten bij mensen met behulp van nucleaire magnetische resonantie. De natuurlijke vorm van fosfor (31P) heeft magnetische eigenschappen, dus het is niet nodig om externe stoffen toe te voegen. Het weefsel van belang zoals spier wordt geplaatst in een sterk magnetisch veld en de verschuivingen in frequentie van radioimpulsen worden gebruikt om concentratie van ATP en Pi direct uit de pieken in de NMR spectra af te leiden. In E. coli, kunnen de concentraties van ATP directer worden gemeten met een ATP bioluminescentie assay. Een steekproef van groeiende bacteriën die uit de cultuur worden verwijderd kan worden assayed gebruikend luciferase, een proteã ne van bacteriën die in symbiose met pijlinktvissen leven maar die inmiddels de gereedschapskist van biologen als moleculaire reporter heeft aangesloten. Het luciferase-enzym gebruikt ATP in een reactie die licht produceert dat kan worden gemeten met behulp van een luminometer, en de ATP-concentratie kan worden afgeleid uit de signaalsterkte. Zo hebben wij celinhoud als input, luciferase als “apparaat” dat de hoeveelheid ATP in lichtemissie omzet die als gemeten output dient. Met behulp van tools zoals deze vindt men dat in het “echte leven” ATP is de moeite waard ongeveer twee keer zo veel als onder “standaard” voorwaarden vanwege de concentraties gunstiger voor de voorwaartse reactie.
we eindigen met op te merken dat het een permanente vraag is waarom het adeninenucleotide werd uitgekozen om te dienen als de belangrijkste energievaluta met GTP en de andere nucleotiden die veel kleinere rollen dienen. Is het een geval van willekeurige keuze die later “bevroren ongeval” werd of was er een selectief voordeel voor ATP ten opzichte van GTP, CTP, UTP en TTP?




