- introductie
- materialen en methoden
- stammen
- DNA-extractie
- stx1 en stx2 PCR versterkingen
- DNA-Sequencing
- microplaat Verocellenpreparaten
- celvrije bacteriële preparaten
- cytotoxische bepaling en LD50 bepaling
- blokkade-en Toxineneutralisatietest
- OMVs verkrijging en DNA-extractie uit OMVs
- resultaten
- Stx1 en stx2 Gen PCR versterkingen
- DNA Sequencing
- cytotoxische bepaling en LD50 bepaling
- Toxineneutralisatie
- Stx1 Gen PCR-versterkingen van OMVs
- discussie
- Auteursbijdragen
- financiering
- belangenconflict verklaring
- bevestigingen
- Afkortingen
introductie
gedurende enkele jaren, de Betekenis van Aeromonas spp., als een menselijke diarree veroorzakende agent was controversieel; verschillende studies toonden aan dat het pathogene mechanisme van Aeromonas multifactorieel is omdat veel virulentie factoren betrokken zijn, met inbegrip van de productie van cytotoxinen (Castro-Escarpulli et al., 2002, 2003). Deze toxines kunnen diarree of hemorragische colitis veroorzaken, en kunnen een belangrijke rol spelen in het hemolytisch-uremisch syndroom (HUS) en TTP ontwikkeling (Bogdanović et al., 1991; Fang et al., 1999; Monforte-Cirac et al., 2010).
De cytotoxinen die bij deze ziekten betrokken zijn, zijn onder meer Shigatoxine en de nauw verwante Stx. Stx varianten worden uitgedrukt in Shigella, Enterobacter, Citrobacter, Acinetobacter, Campylobacter, en Hamiltonella bacteriële species (Mauro and Koudelka, 2011). Alperi and Figueras (2010) beschreven de aanwezigheid van Stx1 en Stx2 in klinische isolaten van Aeromonas spp., geassocieerd met gastro-enteritis, hemorragische colitis, en HUS. Genen die deze toxines coderen bevinden zich in verschillende lambdoïde bacteriofagen die deze stam lysogeniseren. Daarnaast heeft het geslacht Aeromonas een zero-secretion systeem genaamd OMVs. OMVs zou een middel kunnen zijn waardoor sommige eiwitten, RNA, periplasmische ruimtecomponenten en andere componenten geassocieerd met virulentie, horizontaal naar andere geslachten kunnen worden overgedragen; daarom wordt aangenomen dat OMVs een belangrijke rol spelen in pathogeniteit (Guerrero-Mandujano et al., 2015a, b).
om deze reden was het doel van deze studie om de schade te evalueren veroorzaakt door de productie van Stx door stammen geïsoleerd uit Mexico City kinderen in verocel culturen.
materialen en methoden
stammen
deze studie omvatte 66 klinische isolaten van de INP, 54 verkregen uit intestinale infecties en 12 uit extra-intestinale infecties. Stammen werden geïsoleerd uit monsters die werden verkregen voor routinematige tests in het genoemde ziekenhuis; daarom was geen geïnformeerde toestemming vereist van ouders of wettelijke voogden van kinderen. Alle stammen werden genetisch geïdentificeerd door 16S rDNA-RFLP (Hernández-Cortez et al., 2011). De getypte stam voor Escherichia coli O157: H7 CECT 4076 werd gebruikt als positieve controle en E. coli K12 stam (5512 ENCB) uit de collectie van het medisch bacteriologisch laboratorium (Escuela Nacional de Ciencias Biologicas, IPN) werd gebruikt als negatieve controle voor toxineproductie. De stammen werden gedurende korte perioden bij kamertemperatuur op bloedagar gebaseerde schuine lagen gehandhaafd; voor langere opslag, werden ze ofwel bevroren bij -70°C in 20% (w/v) glycerol-Todd-Hewitt bouillon (Oxoid, Mexico) of gevriesdroogd in 7.5% paarden glucose serum.
DNA-extractie
alle culturen werden geteeld op tryptische sojaagar bij 30°C gedurende 18 uur. het genomische DNA van elke stam werd verkregen door InstaGene Matrix (BioRad®, Mexico) Volgens de instructies van de fabrikant. De zuiverheid en de hoeveelheid van DNA werden bepaald met behulp van de ampli Quant AQ-07 spectrofotometer. DNA werd opgeslagen bij -20°C tot gebruik.
stx1 en stx2 PCR versterkingen
de aanwezigheid van STX1 en stx2 uit DNA van OMVs en genomisch DNA werd gedetecteerd door enkelvoudige PCR reacties met behulp van primers STX1F/STX1R en STXF / STXR met een 144 en 217 BP product, respectievelijk, deze primers werden ontworpen op basis van de sequentie van subeenheid A. de primers, de reactie en amplificatiecondities werden verwerkt zoals eerder beschreven door Hernández-Cortez et al. (2013), met de positieve (E. coli O157:H7) en negatieve (E. coli K12) controles.
DNA-Sequencing
Polymerasekettingreactieproducten werden gezuiverd met behulp van een PureLink Quick Gel Extraction Kit (Invitrogen®, Mexico) Volgens de instructies van de fabrikant. De producten werden direct gesequenced op een ABI-PRISM 310 genetische Analyzer (Applied Biosystems, Foster City, CA, USA) met behulp van de voorwaartse en omgekeerde primers gebruikt voor PCR, volgens de instructies van de fabrikant. Sequencing werd uitgevoerd aan het Instituto de Biología, UNAM (Mexico). Sequentieanalyse werd uitgevoerd met de Basic Local Alignment Search Tool (BLAST) van het National Center for Biotechnology Information (NCBI).
microplaat Verocellenpreparaten
deze procedure werd uitgevoerd in 96-wells microplaten met Vero (ATCC CCL81) celmonolaag met 80% confluentie, waarbij minimaal essentieel medium (mem; Invitro®, Mexico) werd toegevoegd met 10% V/v foetaal runderserum (FBS; Invitro®, Mexico).
De celsuspensie werd gehomogeniseerd en aangepast tot 105-106 cellen/mL met behulp van een Neubauer kamer. Na aanpassing werd de suspensie afgezet in een put van 200-µL. De microplaten werden geïncubeerd bij 37°C Onder 5% CO2 gedurende 24 uur (CO2 Incubator, VWR Scientific, USA) (Giono-Cerezo et al., 1994).
celvrije bacteriële preparaten
vijf kolonies van elke bloedagarplaat werden geïnoculeerd in 3 mL Craig medium (0,4% gistextract, 3% casaminozuren, 0,05% K2HPO4). Deze werden gedurende 24 uur bij 37°C geïncubeerd en de optische dichtheid van de gebruikte bacteriecultuur was 0,25 bij 600 nm. Celvrije preparaten werden gemaakt door centrifugeren van de culturen bij 14.000 g gedurende 10 min bij 4°C, gevolgd door filtratie van de supernatant door een membraanfilter (poriegrootte 0,45 pm, Sartorius Minisart NML). Celvrije supernatanten werden opgeslagen bij -20°C. op deze wijze werden in totaal 66 celvrije bacteriële preparaten verkregen; de positieve controle (E. coli O157:H7) en de negatieve controle (E. coli K12) werden eveneens op dezelfde wijze verkregen (Giono-Cerezo et al., 1994).
cytotoxische bepaling en LD50 bepaling
het celvrije filtraat (20 µL) werd geïnoculeerd in putjes die cellen en het respectieve groeimedium zonder antibiotica bevatten. Geïnoculeerde cellen werden gedurende 96 uur bij 37°C geïncubeerd met 5% CO2 en elke 24 uur waargenomen op de omgekeerde microscoop. Het cytotoxische effect zou naar verwachting optreden als afronding en krimp van cellen met dikke korrelvorming en, ten slotte, progressieve en onomkeerbare vernietiging van de monolaag. Alle testen werden in duplo uitgevoerd; uitvoerbaarheidscontroles met MEM en Craig medium werden ook uitgevoerd (Giono-Cerezo et al., 1994).
de LD50 werd bepaald in Aeromonas stammen die positief bevonden werden voor het veroorzaken van cytotoxische schade in Verocellen. Een standaard 96-wells microplaat met Verocellen werd bereid zoals aangegeven in 2.6, maar het medium werd veranderd in 100 µL MEM met 1% BFS. Dit preparaat werd blootgesteld aan 100 µL celvrije bacteriële voorbereiding, en seriële verdunningen werden gedaan op de hele rij platen. Na 24 uur incubatie bij 37°C met 5% CO2, werd de LD50 bepaald, onder de omgekeerde microscoop. LD50 werd toegewezen aan de put waarin 50% van de Vero-cellen werden beschadigd en 50% niet-beschadigd (Marques et al., 1986).
blokkade-en Toxineneutralisatietest
De toxineneutralisatietest werd uitgevoerd in de stammen die cytotoxische schade in Verocellen induceerden omdat deze schade indicatief is voor Stx. Voor deze test werd een microplaat bereid met Verocellen die tot 90-100% samenvloeien met de LD50 van elk celvrij bacterieel preparaat. Om de neutralisatietest uit te voeren om celbeschadiging als gevolg van STX-werking aan te tonen, werden twee monoklonale antilichamen (Universidad Nacional Autónoma de México) verkregen uit E. coli O157:H7 gebruikt.
voor elke Ab werd een Bradford-eiwitkwantificatie uitgevoerd volgens de instructies van de fabrikant (Biorad), met een resultaat van respectievelijk 78,2 en 74,8 µg/µL anti-Stx1 en anti-Stx2 A. de geconcentreerde Ab werd bewerkt en een dubbele verdunning van de Ab. Vervolgens werd 10 µL van de Ab (anti-STX1 of anti-STX2) geïncubeerd met 190 µL van de celvrije supernatant bij een concentratie van LD50 gedurende 1 uur bij 37°C. Daarna werd 200 µL van de laatste geïnoculeerd in Verocellen bij 90% van de samenvloeiing en geïncubeerd gedurende 24 uur bij 37°C met 5% CO2 (Marques et al., 1986).
OMVs verkrijging en DNA-extractie uit OMVs
buitenmembraanblaasjes werden verkregen uit Aeromonas hydrophila F-0050. Het protocol werd uitgevoerd zoals eerder beschreven door Guerrero-Mandujano et al. (2015a).
Het DNA van de OMVs werd verkregen via de InstaGene Matrix (BioRad®, Mexico) Volgens de instructies van de fabrikant. Vervolgens werd het DNA van de OMVs gezuiverd met de DNA-extractie fenol-chloroform techniek (Guerrero-Mandujano et al., 2015b).
resultaten
Stx1 en stx2 Gen PCR versterkingen
polymerasekettingreactie screening van 66 klinische Aeromonas stammen toonde aan dat 22/66 (33,3%) stammen het stx1-gen bevatten, 42/66 (63,6%) stammen beide genen bevatten, geen stammen alleen het stx2-gen en 2/66 (3%) stammen negatief waren voor beide genen.
DNA Sequencing
BLASTn analyse toonde een 79 tot 99% overeenkomst en een verwachte waarde van 3e-16 / 2e-97 tussen de STX-1/stx-2 genen van E. coli O157:H7 en het amplicon van Aeromonas spp., stam.
cytotoxische bepaling en LD50 bepaling
De cytotoxiciteitstest uitgevoerd in verocelculturen toonde aan dat 17/66 (25,7%) celvrije bacteriële preparaten cytotoxische schade veroorzaakten, hetgeen wijst op de productie van een actieve Stx (figuur 1), hetgeen blijkt uit de kenmerkende schade veroorzaakt door Stx.
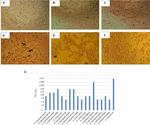
figuur 1. Cytotoxiciteitstest en LD50-bepaling uitgevoerd in verocellen. A) verocelcultuur met minimaal essentieel Medium (Levensvatbaarheidstest). B) verocellcultuur met Craig Medium (Viability test). C) negatieve controle met E. coli K12. D) positieve controle met E. coli O157: H7, cytotoxische schade wordt aangetoond (pijlen) door vernietiging van de celmonolaag en “oude kant” – effect. E) cytotoxische schade van A. hydrophila F-0050 stam. F) cytotoxische schade van A. caviae 421423 stam. G) grafische weergave van de LD50-titer van alle stammen.
de resultaten voor het bepalen van de LD50-titer waren als volgt: 6/17 (35,2%) celvrije bacteriële preparaten gaven een titer van 1:16; 5/17 (29,4%) celvrije bacteriële preparaten gaven een titer van 1:8; 3/17 (17,6%) celvrije bacteriële preparaten hadden een titer van 1:64; 2/17 (11,7%) celvrije bacteriële preparaten met een titer van 1:32; en 1/17 (5,8%) celvrije bacteriële preparaten met een titer van 1:256 (figuur 1g).
Toxineneutralisatie
de toepassing van anti-STX1 Ab in 11/17 (64.7%) stammen de schade aan cellen in het supernatant werd volledig geremd bij 39,1 µg / µL AB concentratie; in 4/17 (23,5%) cel-vrije bacteriële preparaten, verminderde celschade werd waargenomen bij dezelfde concentratie; en in 2/17 (11,7%) cel-vrije bacteriële preparaten, celschade werd volledig geremd bij een concentratie 78,2 µg/µL. Met behulp van de AB anti-STX2 bleek dat in 9/17 (52,9%) cel-vrije bacteriële preparaten, celschade volledig werd geremd bij 37,4 µg/µL, en 6/17 (35,2%) cel-vrije bacteriële preparaten toonde verminderde celschade bij dezelfde concentratie; en in 2/17 (11.7%) celvrije bacteriële preparaten, celschade werd volledig geremd met een Ab-concentratie van 74,8 µg / µL (figuren 2 en 3).

figuur 2. Remming van het cytotoxische effect geïnduceerd in verocellencultuur door celvrije bacteriële preparaten van Aeromonas spp. stammen met het stx1-of stx2-gen.
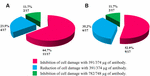
figuur 3. Percentage stammen dat remming of vermindering van celbeschadiging vertoonde. (A) neutralisatie met de anti-Stx1 Ab. (B) neutralisatie met de anti-Stx2 Ab.
Stx1 Gen PCR-versterkingen van OMVs
polymerasekettingreactie van OMVs’ DNA van A. hydrophila F-0050 onthulde dat OMVs het gen stx1 bevatte; vandaar dat OMVs een potentieel vehikel zou kunnen zijn voor horizontale virulentie-overdracht van genen (Figuur 4).
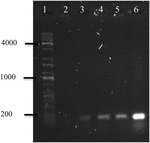
figuur 4. Elektroferogram van stx1 genamplificatie van OMVs ‘ DNA. (1) Kapa Universele Ladder, (2) negatieve controle, (3) OMVs van A. hydrophila F-0050, (4) A. hydrophila F-0050, (5) OMVs van E. coli O157:H7 en (6) E. coli O157:H7.
discussie
Het geslacht Aeromonas, als producent van Stx, zou een opkomende ziekteverwekker kunnen zijn die diarree veroorzaakt, voornamelijk bij pediatrische patiënten (Hernández-Cortez et al., 2011; Figueras en Baez-Hidalgo, 2014). Niettemin is dit geslacht relevanter geworden in het medische gebied, aangezien het een ziekteverwekker is die HUS veroorzaakt (San Joaquín and Pickett, 1988; Bogdanović et al., 1991; Robson et al., 1992; Fang et al., 1999; Monforte-Cirac et al., 2010).
In deze studie vonden we, door PCR-amplificatie van de genen stx1 en stx2, dat 22/66 (33.3%) van de aeromonad-stammen bevatten het stx1-gen, 42/66 (63,6%) stammen bevatten beide genen en er waren geen stammen die alleen stx2 bevatten. Dit kan ons doen vermoeden dat dit gen wijd verspreid is in de Aeromonas stammen geïsoleerd uit pediatrische patiënten en dat deze patiënten een risico kunnen lopen op het ontwikkelen van HUS.er is slechts één eerder rapport waarin de stx-genen werden bestudeerd in Aeromonas-stammen geïsoleerd uit verschillende ziekenhuizen in Spanje; de verkregen resultaten waren dat 19/80 (23,7%) stammen het stx1-gen hadden en slechts 1/80 (1.25%) de stam was positief voor beide genen (Alperi and Figueras, 2010). Deze resultaten tonen aan dat er een grotere verspreiding van het gen in Mexicaanse stammen is; we moeten er echter rekening mee houden dat in Spanje het geslacht Aeromonas een bekende gastro-intestinale pathogeen is die routinematig wordt geïsoleerd bij patiënten met een gastro-intestinale profiel, daarom wordt een adequate behandeling gegeven om dit geslacht te bestrijden.
in Mexico is dit geslacht niet opgenomen in de lijst van pathogenen die diarree veroorzaken en wordt het niet routinematig geïsoleerd.; als gevolg hiervan is het moeilijk om een behandeling en een goede kwaliteit van leven aan patiënten te geven; bovendien zijn er geen statistieken over de prevalentie ervan. Bovendien wordt het geslacht relevanter vanwege de sociaaleconomische omstandigheden van de Mexicaanse bevolking, waaronder watertekort; dit vergemakkelijkt de overdracht en verhoogt de mogelijkheid van HUS steeds een probleem voor de volksgezondheid.
Sequencing van de ampliconen werd uitgevoerd en een Blast search werd uitgevoerd, die 79-99% gelijkenis en een verwachte waarde van 3e-16/2e-97 tussen genen stx1/stx2 in vergelijking met E. coli O157:H7 toonde.
de LD50 werd bepaald om de cytotoxische schade in verocelcultuur te evalueren; met deze parameter en gebaseerd op Marques et al. (1986), kunnen de stammen worden gegroepeerd in lage (2 × 101 tot 6 × 102), matige (103-104), en hoge (105-108) productie (figuur 1G). Marques et al. (1986) een studie uitgevoerd waarin zij een soortgelijke test uitvoerden als de huidige studie, maar met verschillende stammen van STEC verkregen zij dat 262/400 (63%) stammen werden gegroepeerd als lage STX-producenten en dat 48% cytotoxische schade veroorzaakte; niettemin werd bij 40% van deze stammen de cytotoxische schade geremd met anti-Stx antilichamen.
in dit onderzoek veroorzaakte 25,7% van de bacterievrije preparaten cytotoxische schade die kenmerkend is voor Stx in Verocellen, wat wijst op de productie van actieve Stx; alle Aeromonas-stammen werden gegroepeerd als lage producenten van Stx; bij 50-70% van de celvrije supernatanten werd de cellulaire schade echter geremd en bij 20-30% van de celvrije supernatanten werd de cellulaire schade verminderd (Figuur 3). De cel-vrije supernatants waarin cellulaire schade werd verminderd dit zou kunnen zijn als gevolg van twee varianten in de toxine aanwezig in de supernatant, bijgevolg, omdat ze verschillend immunologisch, de Stx kon niet volledig worden geremd en de cellulaire schade bleef (Marques et al., 1986).
twee eerdere onderzoeken (Haque et al., 1996; Alperi and Figueras, 2010) verkregen respectievelijk 10,2% en 10,53% van Stx1-producerende Aeromonas stammen. De reden voor een hoger percentage Aeromonas-stammen die actieve Stx produceren, kan te wijten zijn aan de hoge beschikbaarheid van de STX-bacteriofaag in de cultuur, aangezien sommige Stec-stammen dragers van de STX-bacteriofaag zijn geïsoleerd uit stedelijk afvalwater van zuiveringsinstallaties, afvalwater van slachthuizen en runder ontlasting (García-Aljaro et al., 2004, 2009). Ook transductiestudies zijn in vivo uitgevoerd met Stx-Fagen van E. coli, die intestinale microbiota-bacteriën kunnen infecteren, waardoor de toxigene eigenschap wordt gegeven aan stammen die niet eerder waren geïnfecteerd (Acheson et al., 1998; Schmidt et al., 1999; Gamage et al., 2003). Hetzelfde kan gebeuren met het geslacht Aeromonas wanneer het een gastro-intestinaal profiel induceert, gevolgd door het feit dat het geslacht Aeromonas de mogelijkheid heeft om virulentiefactoren in zijn genoom te vangen en te integreren, en een daarvan is het STX-coderende gen.
de rest van de stammen veroorzaakte cytotonische schade in de cel, wat mogelijk wijst op de productie van andere toxinen dan Stx, aangezien Aeromonas een geslacht is dat in staat is twee cytotonische enterotoxinen te produceren, thermostabiele (AST) en thermolabile (ALT) (Figueras and Baez-Hidalgo, 2014), die cytotonische schade kunnen veroorzaken in Verocellen; een andere mogelijkheid is dat de Aeromonas-stammen meer dan één bacteriofaag in hun genoom hebben ingebracht, omdat is aangetoond dat STEC-stammen met dubbele lysogenie in staat zijn om bacteriofagen te reguleren om de capaciteit van lytische cyclus inductie te remmen, wat resulteert in een afname van de STX-productie, maar zonder verlies van het gen (García-Aljaro et al., 2004; Imamovic and Muniesa, 2011). Daarom moet worden vastgesteld hoeveel bacteriofagen Aeromonas-stammen bevatten, ook in dit onderzoek, om de aanwezigheid van STX-bacteriofagen te kunnen correleren met de hoeveelheid Stx die wordt geproduceerd.
anderzijds is de aanwezigheid van STX-bacteriofagen in induceerbare Aeromonas een horizontaal overdrachtsmechanisme van het STX-gen, maar het is niet het enige. In meer recente studies is vastgesteld dat Aeromonas in staat zijn om OMVs (Guerrero-Mandujano et al., 2015a) en deze OMVs kunnen geïntegreerd DNA transporteren (Guerrero-Mandujano et al., 2015b). In deze studie hebben we het stx1-gen versterkt uit het DNA dat is geëxtraheerd uit de OMVs van een A. hydrophila-stam van klinische oorsprong, die cytotoxische schade induceerde in Verocellen, en deze schade werd geremd met anti-Stx-antilichamen. Dit wijst erop dat de STX-bacteriofaag het transportmechanisme van het STX-gen is; verder zijn de OMVs en het recent genoemde transportsysteem type 0 in staat om het STX-gen interspecies of intraspecies te verspreiden. Niettemin, is het vereist om te bevestigen of het gen in de OMVs volledig is. De resultaten van deze studie ondersteunen de hypothese dat het STX-gen een andere vermeende virulentiefactor van Aeromonas is die via OMVs kan worden overgedragen. Het zou een ander mechanisme kunnen zijn voor horizontaal transport van het STX-gen naar andere Aeromonas-stammen en/of andere bacteriële geslachten.
daarom moet dit geslacht worden opgenomen als mogelijke veroorzaker van gastro-enteritis wanneer wordt geprobeerd causale agentia te identificeren en moet dit worden gerapporteerd als onderdeel van standaardprocedures voor Gezondheidstoezicht.
Auteursbijdragen
IP-M en AG-M voerden de experimenten uit en MR-R verrichtte de bioinformaticaanalyses en stelde het manuscript op; CH-C ontwierp de primer; VB-G en JM-L becommentarieerde en reviseerde het manuscript; GC-E ontwierp het onderzoek, nam deel aan het ontwerp en de coördinatie ervan, beoordeelde de gegevens en stelde het manuscript op. Alle auteurs hebben het definitieve manuscript gelezen en goedgekeurd. We willen Sofia Marteli Mulia bedanken voor het corrigeren van de stijl van het manuscript.
financiering
GC-E en VB-G kregen steun van Estímulos al Desempeño en Investigación en Comisión y Fomento de Actividades Académicas (Instituto Politécnico Nacional) en Sistema Nacional de Investigadores (SNI, CONACyT). Deze studie werd gefinancierd door het secretariaat van onderzoek en postdoctorale van de nationale Polytechnic Institute (SIP 20160609). Het SIP-IPN was niet betrokken bij de ontwikkeling van de studieopzet, de verzameling, analyse en interpretatie van gegevens, bij het schrijven van het rapport of bij het besluit om het document voor publicatie in te dienen. IP – M en AG-M hadden een beurs van CONACyT en BEIFI.
belangenconflict verklaring
De auteurs verklaren dat het onderzoek werd uitgevoerd zonder enige commerciële of financiële relatie die als een potentieel belangenconflict kon worden opgevat.
bevestigingen
wij danken Dr.Patricia Arzate Barbosa voor het leveren van stamisolaten en Dr. Armando Navarro voor het leveren van de monoklonale antilichamen.
Afkortingen
Ab, antilichaam; HUS, hemolytisch uremisch syndroom; INP, Instituto Nacional de Pediatria Mexico; LD50, mediane letale dosis; OMVs, Outer membrane vesicles; PCR, Polymerase chain reaction; STEC, Shiga toxin-producing E. coli; Stx, Shiga-like toxin; TTP, Thrombotic thrombocytopenic purpura.
Acheson, D. W., Reidl, J., Zhang, X., Keusch, G. T., Mekalanos, J. J., and Waldor, M. K. (1998). In vivo transduction with shiga toxin 1-encoding phage. Infect. Immun. 66, 4496–4498.
Google Scholar
Alperi, A., and Figueras, M. J. (2010). Menselijke isolaten van Aeromonas bezitten shiga toxine genen (stx1 en stx2) zijn sterk vergelijkbaar met de brug virulente gen varianten van Escherichia coli. Clin. Microbiol. Infecteren. 16, 1563-1567. doi: 10.1111 / j. 1469-0691.2010.03203.x
CrossRef Full Text / Google Scholar
Bogdanovic, R., Čobeljić, M., Markovic, M., Nikolic, V., Ognjanović, M., Sarjanović, L., et al. (1991). Hemolytisch-uremisch syndroom geassocieerd met Aeromonas hydrophila enterocolitis. Kinderarts. Nefrol. 5, 293-295. doi: 10.1007
CrossRef Full Text/Google Scholar
Castro-Escarpulli, G., Aguilera-Arreola, M. G., Giono-Cerezo, S., Hernández-Rodríguez, C. H., Rodriguez-Chacon, M., Soler, F. L., et al. (2002). Het geslacht Aeromonas > een belangrijke ziekteverwekker in Mexico? Enf. Infec. Mike. 22, 206–216.
Google Scholar
Castro-Escarpulli, G., Figueras, M. J., Aguilera-Arreola, M. G., Soler, L., Fernández-Rendón, E., Aparicio, G. O., et al. (2003). Karakterisering van Aeromonas spp. geïsoleerd uit bevroren vis bestemd voor menselijke consumptie in Mexico. Int. J. Food Microbiol. 84, 41–49. doi: 10.1016 / S0168-1605 (02)00393-8
CrossRef Full Text | Google Scholar
Fang, J. S., Chen, J. B., Chen, W. J., and Hsu, K. T. (1999). Hemolytisch-ureamisch syndroom bij een volwassen man met Aeromonas hydrophila enterocolitis. Nefrol. Wijzerplaat. Transplantatie. 14, 439–440. doi: 10.1093/ndt/14.2.439
CrossRef Full Text/Google Scholar
Figueras, M. J., and Baez-Hidalgo, R. (2014). “Aeromonas,” in Encyclopedia of Food Microbiology, eds C. A. Batt and M. L. Tortorello (Cambridge, MA: Academic Press), 24-30.
Gamage, S. D., Strasser, J. E., Chalk, C. L., and Weiss, A. A. (2003). Nietpathogene Escherichia coli kan bijdragen aan de productie van shigatoxine. Infecteren. Immun. 71, 3107–3115. doi: 10.1128 / IAI.71.6.3107-3115.2003
CrossRef Full Text / Google Scholar
García-Aljaro, C., Muniesa, M., Jofre, J., and Blanch, A. R. (2004). Prevalentie van het stx2-gen in coliforme populaties uit aquatische milieus. Appl. Environ. Microbiol. 70, 3535–3540. doi: 10.1128 / AEM.70.6.3535-3540.2004
CrossRef Full Text / Google Scholar
García-Aljaro, C., Muniesa, M., Jofre, J., and Blanch, A. R. (2009). Genotypische en fenotypische diversiteit onder geïnduceerde, stx2-dragende bacteriofagen van omgevingsstammen van Escherichia coli. Appl. Environ. Microbiol. 75, 329–336. doi: 10.1128 / AEM.01367-08
CrossRef Full Text / Google Scholar
Giono-Cerezo, S., Rodríguez-Ángeles, M. G., Rodríguez-Cadena, M. J., and Valdespino-Gómez, J. L. (1994). Identificatie van enterotoxinen en cytotoxinen van Escherichia coli door verocelcultuur en vaste-fase hybridisatie (colony blot). Dominee Latinoam. Microbiol. 36, 231–241.
Google Scholar
Guerrero-Mandujano, A., López-Villegas, E. O., Longa-Briseño, A., and Castro-Escarpulli, G. (2015a). Productie van buitenste membraanblaasjes in een klinische stam van Aeromonas hydrophila. EC Microbiol. 1, 113–117.
Google Scholar
Guerrero-Mandujano, A., Palma-Martínez, I., en Castro-Escarpulli, G. (2015b). Transport DNA door buitenste membraanblaasjes van Aeromonas hydrophila. EC Microbiol. 2, 354–357.
Google Scholar
Haque, Q. M., Sugiyama, A., Iwade, Y., Midorikawa, Y., and Yamauchi, T. (1996). Diarree-en omgevingsisolaten van Aeromonas spp. produceer een toxine vergelijkbaar met shiga-achtige toxine 1. Curr. Microbiol. 32, 239–245. doi: 10.1007/s002849900043
CrossRef Full Text / Google Scholar
Hernández-Cortez, C., Aguilera-Arreola, M. G., Chávez-Méndez, Y., Arzate-Barbosa, P., Lara-Hernandez, A., and Castro-Escarpulli, G. (2011). Genetische identificatie van stammen van Aeromonas spp. geïsoleerd bij het Nationaal Instituut voor Kindergeneeskunde. Eerwaarde Enfer. Infectie. Kinder. 24, 157–165.
Google Scholar
Hernández-Cortez, C., Méndez-Tenorio, A., Aguilera-Arreola, M. G., en Castro-Escarpulli, G. (2013). Ontwerp en standaardisatie van vier multiplex polymerasekettingreacties om bacteriën te detecteren die gastro-intestinale ziekten veroorzaken. Afr. J. Microbiol. 7, 2673-2681. doi: 10.5897/AJMR2013.5452
CrossRef Full Text/Google Scholar
Imamovic, L., and Muniesa, M. (2011). Kwantificering en evaluatie van infectiviteit van Shiga toxine-codeert bacteriofagen in rundvlees en salade. Appl. Environ. Microbiol. 77, 3536–3540. doi: 10.1128 / AEM.02703-10
CrossRef Full Text / Google Scholar
Marques, L. R. M., Moore, M. A., Wells, J. G., Wachsmuth, I. K., and O ‘ Brien, A. D. (1986). Productie van shiga-achtige toxine door Escherichia coli. J. Infecteren. Dis. 154, 338–341. doi: 10.1093/infdis / 154.2.338
CrossRef Full Text / Google Scholar
Mauro, S. A., and Koudelka, G. B. (2011). Shiga toxine: expressie, distributie en zijn rol in het milieu. Toxines 3, 608-625. doi: 10.3390/toxins3060608
CrossRef Full Text/Google Scholar
Monforte-Cirac, M. L., Palacian-Ruiz, M. P., Aisa-Iriarte, M. L., and Espuelas-Monge, M. (2010). Hemolytisch uremisch syndroom door Aeromonas: over een klinisch geval. Rev. Clin. Geest. 210, 206–207. doi: 10.1016 / j.cer.2009.08.002
CrossRef Full Text / Google Scholar
Robson, W. L. M., Leung, A. K. C., and Trevenen, C. L. (1992). Hemolytisch-uremisch syndroom geassocieerd met Aeromonas hydrophila enterocolitis. Kinder. Nefrol. 6, 221–222. doi: 10.1007
CrossRef Full Text / Google Scholar
San Joaquin, V. H., and Pickett, D. A. (1988). Aeromonas-geassocieerde gastro-enteritis bij kinderen. Kinderarts. Infecteren. Dis. J. 7, 53-57. doi: 10.1097 / 00006454-198801000-00013
CrossRef Full Text / Google Scholar
Schmidt, H., Bielaszewska, M., and Karch, H. (1999). Transductie van enterische Escherichia coli-isolaten met een derivaat van shigatoxine 2-codeert bacteriofaag f3538 geïsoleerd uit Escherichia coli O157:H7. Appl. Environ. Microbiol. 65, 3855–3861.
Google Scholar