normaal celmetabolisme hangt af van de handhaving van de pH-waarden in het bloed zeer smalle limieten (7,35-7,45).
zelfs relatief mildexcursies buiten dit normale pH-bereik kunnen schadelijke effecten hebben, waaronder verminderde zuurstoftoevoer naar weefsels, elektrolytverstoringen en veranderingen in de contractiliteit van de hartspier; overleving is gegarandeerd als de pH van het bloed onder 6,8 of boven 7,8 daalt.
het probleem voor het lichaam is dat een normaal metabolisme gepaard gaat met de continue productie van waterstofionen (H+) en kooldioxide(CO2), die beide de pH verlagen. het mechanisme dat dit probleem overwint en dient om een normale pH in het bloed te handhaven(d.w.z. de zuur-base-homeostase te behouden) is een complexe synergie van chemische buffers in het bloed, de rode cellen(erytrocyten), die in het bloed circuleren, en de functie van drie organen: longen, nieren en hersenen.
alvorens uit te leggen hoe deze vijf elementen bijdragen tot het algemene behoud van de pH van het bloed, zou het nuttig zijn om snel een aantal basisconcepten te herzien.
- Wat is een zuur, wat is een base en wat is pH?
- Wat is een buffer? – het bicarbonaatbuffersysteem
- longfunctie, transport van CO2 en zuurgebaseerde balans
- nieren en zuur-base balans
- verstoringen van de zuur-BASE-balans
- oorzaken van zuur-base stoornissen
- respiratoire acidose – (verhoogde pCO2(a),verlaagde pH)
- respiratoire alkalose – (reducedpCO2(a), verhoogde pH)
- metabole acidose– (verlaagde HCO3 -, verlaagde pH)
- metabole alkalose – (verhoogde HCO3 -, verhoogde pH)
- compensatie – een gevolg van zuurbasisverstoring
- gemengde zuur-base-stoornissen
- samenvatting
- sommigen suggereerden verder te lezen
Wat is een zuur, wat is een base en wat is pH?
een zuur is een stof die bij dissociatie in oplossing waterstofionen (H+) vrijmaakt.
bijvoorbeeld: Zoutzuur (HCl) distantieert te hydrogenions en chloride-ionen
HCl ![]() H+ + Cl-
H+ + Cl-
Koolzuur (H2CO3) distantieert tohydrogen ionen en bicarbonaat-ionen
H2CO3 ![]() H+ +HCO3–
H+ +HCO3–
We maken een onderscheid tussen sterke zuren zoals zoutzuur andweak zuren, zoals koolzuur. Het verschil is dat sterke zuurdissociate meer dan zwakke zuren. Bijgevolg is de waterstofionconcentratie van een sterk zuur veel hoger dan die van een zwak zuur.
een base is een stof die in oplossing waterstofionen accepteert.
bijvoorbeeld: het basisbicarbonaat (HCO3–)accepteert waterstofionen om koolzuur te vormen:
HCO3– + H+ ![]() H2CO3
H2CO3
pH is een schaal van 0-14 van zuurgraad en alkaliniteit. Zuiver water heeft een pH van 7 en is neutraal (noch zuur noch alkalisch). pH hoger dan 7 is alkalisch en lager dan 7 zuur. Aldus is de pH van bloed (7.35-7.45)licht alkalisch hoewel in klinische geneeskunde de term alkalose, misschien verwarrend, voor bloed pH groter dan 7 wordt gereserveerd.45en de term acidose is gereserveerd voor de pH van het bloed lager dan 7,35.
pH is een maat voor de waterstofionenconcentratie (h+).De twee zijn gerelateerd aan de volgende vergelijking:
pH = – log10
waar is de concentratie van waterstofionen inmol per liter (mol/l)
uit deze vergelijking
pH 7.4 = h+ concentratie van 40 nmol/L
pH 7.0 = h+ concentratie van 100 nmol/L
pH 6.0 = h+ concentratie van 1000 nmol/L
het is duidelijk dat:
- de twee parameters veranderen omgekeerd; naarmate de waterstofionenconcentratie toeneemt, daalt de pH
- vanwege de logaritmische relatie, is een grote verandering in de waterstofionconcentratie eigenlijk een kleine verandering in de pH. bijvoorbeeld, door een verdubbeling van de waterstofionconcentratie daalt de pH met slechts 0,3
Wat is een buffer? – het bicarbonaatbuffersysteem
Buffers zijn chemische stoffen in oplossing die de verandering in pH die optreedt wanneer zuren worden toegevoegd door “op te dweilen” waterstofionen minimaliseren. Een buffer is een oplossing van een zwak zuur en zijnconjugaatbasis. In bloed is het belangrijkste buffersysteem het weakacid, koolzuur (H2CO3) en zijn conjugatebase, bicarbonaat (HCO3–). Om uit te leggen hoe dit systeem veranderingen in pH minimaliseert, stel dat we een sterk zuur,bijvoorbeeld HCl, toevoegen aan de bicarbonaatbuffer:
het zuur zal dissociëren, waardoor waterstofionen vrijkomen:
HCl ![]() H+ + Cl –
H+ + Cl –
De bicarbonaatbuffer ‘absorbeert’ de waterstofionen, waardoor in het proces koolzuur ontstaat:
HCO3– + h+ ![]() H2CO3 (koolzuur)
H2CO3 (koolzuur)
het belangrijke punt is dat, omdat de waterstofionen van HCL zijn opgenomen in het zwakke koolzuur, dat niet zo gemakkelijk met elkaar kan worden verbonden, het totale aantal waterstofionen in oplossing en derhalve de pH niet zoveel veranderen als zou zijn opgetreden bij afwezigheid van de buffer.
hoewel een buffer de sph-verandering sterk minimaliseert, elimineert het deze niet omdat zelfs een zwak zuur (zoals koolstofzuur) tot op zekere hoogte dissocieert. De pH van een bufferoplossing is een functie van de relatieve concentraties van het weakacid en zijn geconjugeerde base.
pH = 6.1 + log ( /)
waarbij = concentratie vanbicarbonaat
= concentratie van koolzuur
deze relatie, bekend als De Henderson-Hasselbalch– vergelijking,toont aan dat de pH wordt bepaald door de verhouding van base(HCO3 -) concentratie tot zuur(H2CO3) concentratie.
als waterstofionen worden toegevoegd aan de bicarbonaatbuffer:
H+ +HCO3– ![]() H2CO3
H2CO3
bicarbonaat (base) wordt verbruikt (concentratie neemt af) encarbonzuur wordt geproduceerd (concentratie neemt toe). Als hydrogenionen blijven worden toegevoegd, zou al het bicarbonaat uiteindelijk worden opgenomen (omgezet in koolzuur) en zou er geen buffereffect zijn – pH zou dan sterk dalen als meer zuur zou worden toegevoegd.
echter, indien koolzuur continu uit het systeem kon worden verwijderd en bicarbonaat voortdurend kon worden geregenereerd, dan kon de buffercapaciteit en dus de pH worden gehandhaafd door voortdurende toevoeging van waterstofionen.
zoals zal blijken met meer detail van de fysiologie van de gezichtsbasisbalans, dat wil zeggen, in feite, wat er in het lichaam gebeurt. Inessentie, de longen zorgen voor verwijdering van koolzuur (als kooldioxide) en de nieren zorgen voor continue regeneratie vanbicarbonaat.
deze rol van de longen is afhankelijk van een singularkarakteristiek van het bicarbonaatbuffersysteem en dat is de mogelijkheid van koolzuur om te worden omgezet in kooldioxide en water.
De volgende vergelijking beschrijft de relatie van allelements van het bicarbonaat buffersysteem als het werkt in thebody
H+ +HCO3– ![]() H2CO3
H2CO3 ![]() H2O + CO2
H2O + CO2
Het is belangrijk om op te merken dat de reacties zijn omkeerbaar.Richting is afhankelijk van de relatieve concentratie van elk element. Zodat, bijvoorbeeld, een toename van kooldioxide concentratie krachten reactie naar links met een verhoogde vorming van koolzuur en uiteindelijk waterstofionen.
Dit verklaart het AIDS-potentieel van koolstofdioxide en brengt ons bij de belangrijke bijdrage die de longen en rode cellen leveren aan de algehele zuurgebaseerde balans.
longfunctie, transport van CO2 en zuurgebaseerde balans
een constante hoeveelheid CO2 in het bloed, essentieel voor een normale zuur-base balans, weerspiegelt een evenwicht tussen de hoeveelheid CO2 die wordt geproduceerd als gevolg van het metabolisme van weefselcellen en de hoeveelheid die wordt uitgescheiden door de longen zonder lucht.
door de snelheid waarmee kooldioxide wordt uitgestoten te variëren, regelen de longen het kooldioxidegehalte van het bloed.De volgorde van de gebeurtenissen van de productie van kooldioxide in thetissues tot de eliminatie in uitgeademde lucht is beschreven in Fig. 1.Koolstofdioxide verspreidt vanuit weefselcellen naar omringende capillair bloed (Fig. 1 bis). Een klein deel lost op in bloedplasma en wordt onveranderd naar de longen getransporteerd.
maar de meeste diffuus in rode cellen waar het combineert met water om koolzuur te vormen.Het zuur dissocieert met de productie van waterstofionen enbicarbonaat. Waterstofionen combineren met gedeoxygeneerde hemoglobine (hemoglobine fungeert hier als buffer), het voorkomen van een gevaarlijke val in cellulaire pH, en bicarbonaat diffuus langs een concentratiegradiënt van rode cel naar plasma.
aldus wordt het grootste deel van het in de weefsels geproduceerde koolstofdioxide naar de longen getransporteerd als bicarbonateinenbloedplasma.
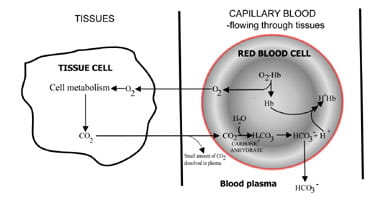
Fig. 1a. CO2 geproduceerd in weefsel omgezet naar bicarbonaat voor transport naar longen.
|
|
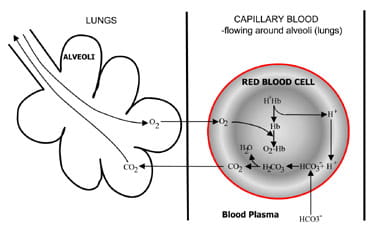
Fig. 1b. At the lungs bicarbonate convertedback to CO2 and eliminated by the lungs.
bij de longblaasjes wordt het proces omgekeerd (Fig. 1 ter).Waterstofionen worden verplaatst van hemoglobine als het neemt zuurstof uit geïnspireerde lucht. De waterstofionen worden nu gebufferd doorbicarbonaat dat van plasma terug in rode cel verspreidt, encarbonzuur wordt gevormd. Naarmate de concentratie hiervan stijgt, wordt het omgezet in water en kooldioxide. Ten slotte verlaagt kooldioxide een concentratiegradiënt van rode bloedcellen naar alveoli forexcretion in uitgeademde lucht.
respiratoire chemoreceptoren in de hersenstam reageren op veranderingen in de kooldioxideconcentratie in het bloed, wat een verhoogde ventilatie (ademhaling) veroorzaakt als de kooldioxideconcentratie stijgt en een verminderde ventilatie als koolstofdioxide daalt.
nieren en zuur-base balans
normaal cellulair metabolisme resulteert in continue productie van waterstofionen. We hebben gezien dat door deze waterstofionen te combineren, de bicarbonaatbuffer in het bloed hun effect minimaliseert. Bufferen is echter alleen op korte termijn nuttig,en uiteindelijk moeten waterstofionen uit het lichaam worden verwijderd.Bovendien is het belangrijk dat het bicarbonaat dat wordt gebruikt om waterstofionen op te vullen, continu wordt vervangen.
deze twee taken,verwijdering van waterstofionen en regeneratie van bicarbonaat, worden door de nieren uitgevoerd. De cellen van de niertubulus zijn rijk aan het enzym koolzuuranhydrase, dat de vorming van carbonicacid van kooldioxide en water vergemakkelijkt. Koolzuur dissocieert tobicarbonaat en waterstofionen. Het bicarbonaat wordt opnieuw geabsorbeerd in het bloed en de waterstofionen gaan over in het lumen van de tubulus en worden via de urine uit het lichaam geëlimineerd.
deze urinaire eliminatie is afhankelijk van de aanwezigheid in de urine van buffers, principallyfosfaat en ammoniakionen.
verstoringen van de zuur-BASE-balans
De meeste zuur-base-stoornissen zijn het gevolg van
- ziekte of schade aan organen (nieren, longen, hersenen) waarvan de normale functie noodzakelijk is voor de zuur-base-homeostase,
- ziekte die abnormaal verhoogde productie van metabole zuren veroorzaakt, zodat homeostatische mechanismen worden overspoeld
- medische interventie (bijv. arteriële bloedgassen zijn de bloedtest die wordt gebruikt om zuur-base stoornissen te identificeren en te controleren. Drie parameters die tijdens de analyse van bloedgas worden gemeten, de pH van arterieel bloed (pH), de partiële druk van koolstofdioxide in arterieel bloed (pCO2(a)) en de concentratie van bicarbonaat (HCO3–) zijn van cruciaal belang (zie tabel I voor het referentiebereik (normaal)).De resultaten van deze drie maken het mogelijk om zuurgebaseerde urbanisatie te classificeren tot een van de vier etiologische categorieën:
- Respiratory acidosis
- Respiratory alkalosis
- Metabolic acidosis
- Metabolic alkalosis
Adults
Neonates
pH
7.35-7.45
7.30-7.40
pCO2 (kPa)
4.7-6.0
3.5-5.4
Bicarbonate
(mmol/L)22-28
15-25
TABLE I. Om te begrijpen hoe de resultaten van pH, pCO2 (a) en bicarbonaat worden gebruikt om zuur-base verstoringen op deze manier te classificeren, moeten we terugkeren naar De Henderson-Hasselbalch vergelijking
pH = 6.1 + log ( / )
we meten pH en bicarbonaat maar niet koolzuur(H2CO3). Er is echter een verband tussen pCO2 (a) en H2CO3, waardoor de Henderson-Hasselbalch-vergelijking tussen de drie parameters (pH, pCO2(A) en bicarbonaat), gemeten tijdens de bloedgasanalyse, kan worden aangepast:
pH = 6.1 + log ( /( pCO2(a) × 0.23))
door alle constanten uit deze vergelijking te verwijderen, kan de relatie tussen de drie gemeten parameters eenvoudiger worden:
pH ∝ / pCO2(a)
Deze relatie, cruciaal voor het begrijpen van alles wat volgt met betrekking tot zuur-base stoornissen, stelt dat de pH van arteriaalbloed evenredig is met de verhouding van de concentratie bicarbonaat tot pCO2(a). Het maakt de volgende reducties mogelijk:
- pH blijft normaal zolang de verhouding: pCO2(a) blijft normaal
- pH-stijgingen (dat wil zeggen alkalose optreedt) als ofwel verhogingen of pCO2(a) afneemt.
- pH neemt af (d.w.z. acidose treedt op) als zowel pCO2(a) afneemt als pCO2(a) toeneemt
- als beide pCO2(a) met relatief dezelfde hoeveelheid worden verhoogd, zijn de verhouding en dus de pH normaal
- als beide pCO2 (a) met relatief dezelfde hoeveelheid worden verlaagd, zijn de verhouding en dus de pH normaal.
zuur-base stoornissen hebben voornamelijk invloed op eitherpCO2 (a), in welk geval het eenrespiratoire verstoring wordt genoemd, of, in welk geval het anon-respiratoire of metabolische disturbance wordt genoemd:
- Als de primaire verstoring is een verhoogde pCO2(a) (die veroorzaakt acidose – zie hierboven), is er sprake van respiratoire acidose
- Als de primaire verstoring is een verlaagde pCO2(a) (waardoor loogziekte – zie hierboven), is er sprake van respiratoire loogziekte
- Als de primaire verstoring is geassocieerd met een verminderde bicarbonaat (wat resulteert in een acidose – zie hierboven), de aandoening heet metabole acidose
- Als de primaire verstoring is geassocieerd met een verhoogd bicarbonaat (wat resulteert in loogziekte – zie hierboven), de voorwaarde wordt genoemd metabole alkalose
oorzaken van zuur-base stoornissen
respiratoire acidose – (verhoogde pCO2(a),verlaagde pH)
respiratoire acidose wordt gekenmerkt door verhoogde pCO2(a) als gevolg van onvoldoende alveolaire ventilatie(hypoventilatie) en de daaruit voortvloeiende verminderde eliminatie van CO2 uit het bloed. Respiratoire aandoeningen, zoals bronchopneumonie, emfyseem, astma en chronische obstructieve luchtwegaandoeningen, kunnen allemaal gepaard gaan met hypoventilatie die voldoende is om respiratoire acidose te veroorzaken.
sommige geneesmiddelen (bijv. morfine en barbituraten) kunnen respiratoire acidose veroorzaken door hetspiratoire centrum in de hersenen te deprimeren. Schade of trauma aan de borst walland de musculatuur betrokken bij de mechanica van de ademhaling kan verminderen ventilatiesnelheid. Dit verklaart de luchtwegacidose die het verloop van ziekten zoals poliomyelitis,Guillain-Barre syndroom en herstel van ernstige borsttrauma kan compliceren.
respiratoire alkalose – (reducedpCO2(a), verhoogde pH)
daarentegen wordt de respiratoire alkalose gekenmerkt door verlaagde pCO2 (A) als gevolg van overmatige alveolaire ventilatie en resulterende overmatige eliminatie van CO2 uit het bloed.Ziekte waarbij, als gevolg van verminderde zuurstof in het bloed (hypoxemie), despiratoire centrum wordt gestimuleerd kan resulteren in respiratoryalkalose.
voorbeelden hiervan zijn ernstige anemie, pulmonair embolisme en Adult respiratory syndrome. Hyperventilatie voldoende om respiratoire alkalose kan een kenmerk van angst aanvallen en reactie op ernstige pijn. Een van de minder welkome eigenschappen vansalicylaat (aspirine) is het stimulerend effect op het respiratorycenter. Dit effect is verantwoordelijk voor de respiratoire alkalose die optreedt na een overdosis salicylaat. Ten slotte kan overenthusiastische mechanische ventilatie respiratoire alkalose veroorzaken.
metabole acidose– (verlaagde HCO3 -, verlaagde pH)
verminderd bicarbonaat is altijd een kenmerk van metabolicacidose. Dit gebeurt om een van de twee redenen: verhoogd gebruik vanbicarbonaat bij het bufferen van een abnormale zuurbelasting of verhoogde verliezen van bicarbonaat uit het lichaam. Diabetische ketoacidose en lacticacidose zijn twee aandoeningen die worden gekenmerkt door overproductie vanmetabole zuren en de daaruit voortvloeiende uitputting van bicarbonaat.
in het eerste geval weerspiegelen abnormaal hoge concentraties ketozuren in het bloed(B-hydroxyboterzuur en acetoazijnzuur) de ernstige metabolische stoornissen die het gevolg zijn van insulindeficiëntie.
alle cellen produceren melkzuur als ze zuurstofgebrek hebben, zodat een verhoogde melkzuurproductie en de daaruit voortvloeiende metabolicacidose optreden in elke toestand waarin de zuurstoftoevoer naar thetissues ernstig gecompromitteerd is.
voorbeelden zijn hartstilstand en elke aandoening geassocieerd met hypovolemische shock (bijvoorbeeld verlies van massiefsluide). De lever speelt een belangrijke rol bij het verwijderen van de kleine hoeveelheid melkzuur die wordt geproduceerd tijdens normaal celmetabolisme, zodat lactaatacidose een kenmerk van leverfalen kan zijn.
abnormaal verlies van bicarbonaat uit het lichaam kan optreden tijdens ernstige diarree. Indien niet gecontroleerd, kan dit leiden tot metabole acidose.Falen om bicarbonaat te regenereren en waterstofionen uit te scheiden verklaart de metabole acidose die optreedt in renalfailure.
metabole alkalose – (verhoogde HCO3 -, verhoogde pH)
bicarbonaat wordt altijd verhoogd bij metabole alkalose. Zelden kan overmatige toediening van bicarbonaat of inname van antacidumpreparaten van bicarbonaten metabole alkalose veroorzaken, maar dit is meestal van voorbijgaande aard. Abnormaal verlies van waterstofionen uit het lichaam kan het primaire probleem zijn. Bicarbonaat dat anders zou worden opgenomen in het bufferen van deze verloren waterstofionen als gevolg daarvanaccumuleert in bloed. Maagsap is zuur en gastricaspiratie of een ziekteproces waarbij maaginhoud zijnlost uit het lichaam vertegenwoordigt een verlies van waterstofionen.
Hetprojectiel braken van maagsap verklaart bijvoorbeeld de metabolische alkalose die kan optreden bij patiënten met pyloricstenose. Ernstige kaliumdepletie kan metabole alkalose veroorzaken als gevolg van de wederzijdse relatie tussen waterstof en kaliumionen.
compensatie – een gevolg van zuurbasisverstoring
Het is van vitaal belang voor het leven dat de pH niet te ver van normaal afwijkt,en het lichaam zal altijd proberen een abnormale pH naar normaalwaarden terug te brengen wanneer de zuur-base balans verstoord is. Aan dit levensparende proces wordt ook compensatie gegeven. Om de compensatie te begrijpen, is het belangrijk eraan te herinneren dat de pH wordt beheerst door theratio : pCO2(a).zolang de verhouding normaal is, zal de pH normaal zijn.
overweeg de patiënt met metabole acidose bij wie de pH laag is, omdat bicarbonaat laag is. Om het Lage te compenseren en de allerbelangrijkste verhouding te herstellen naar normaal moet de patiënt hispCO2(a) verlagen. Chemoreceptoren in het ademhalingscentrum van de hersenen reageren op een stijgende concentratie waterstofionen(lage pH), wat leidt tot verhoogde ventilatie (hyperventilatie) en door verhoogde eliminatie van kooldioxide; de CO2(a) daalt en de verhouding : pCO2(a) keert terug naar normaal.
compensatie voor metabole alkalose, waarbij daarentegen een hoge reactie op de ademhaling plaatsvindt en daardoor het vasthouden van kooldioxidezodat de pCO2(a) stijgt om de toename te evenaren . Echter, depressie vanrespiratie heeft de ongewenste bijwerking van bedreigende adequate zuurstof van weefsels. Om deze reden is de ademhalingscompensatie vanmetabole alkalose beperkt.
primaire stoornissen van pCO2 (a) (respiratoryacidose en alkalose) worden gecompenseerd door nieraanpassingen van de uitscheiding van waterstofionen, die resulteren in veranderingen die de primaire verandering van pCO2 (A) op passende wijze compenseren. De renalcompensatie voor respiratoire acidose (verhoogde pCO2(a)) impliceert dus een verhoogde reabsorptie vanbicarbonaat, en de renale compensatie voor respiratoire alkalose(verminderde pCO2(a)) impliceert een verminderde bicarbonatereabsorptie.
het begrip zuur-base-balans tijdens compensatiewordt visueel weergegeven in Fig. 2. Tabel II geeft een overzicht van de bloedgasresultaten die kenmerkend zijn voor alle vier zuur-base verstoringen voor en na compensatie.
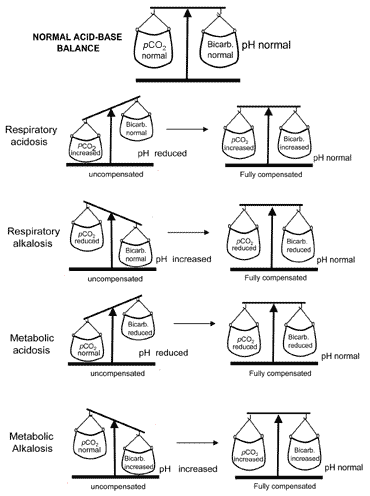
Fig. 2. De “zuur-base balans” : compensationrestores normal pH
Primary disturbance
Respiratory
acidosis
primary
increase
in pCO2Repiratory
alkalosis
primary
decrease
in pCO2Metabolic
acidosis
primary
decrease
in bicarb.Metabolic
alkalosis
primary
increase
in bicarb.Some
common
causesEmphysema
COPD
Pneumonia
Depression
of repiratory
centerHyper-
ventilation
Anxiety
attacks
Stimulation
of brain
respiratory
centerRenal failure
Diabetic
ketoacidosis
Circulatory
failure
– clinical
shock
(lactic
acidosis)Bicarbonate
admini-
strationPotassium
depletionCompen-
satory
mechanismRENAL
increase
bicarbonateRENAL
decrease
bicarbonateRESPIRA-
TORY
decrease
pCO2RESPIRA-
TORY
increase
pCO2
but limited
compen-
sation
in metabolic
alkalosisInitial blood
gas results
(uncompen-
sated)pH
decreased
pCO2
increased
Bicarbonate
normalpH
increased
pCO2
decreased
Bicarbonate
normalpH
decreased
pCO2
normal
Bicarbonate
decreasedpH
increased
pCO2
normal
Bicarbonate
increasedBlood gas
results after
gedeeltelijke
compen-
vangingpH
daalde
maar dichter
normaalpCO2
inreased
Bicarbonaat
verhoogdepH
verhoogde
maar dichter
normaalpCO2
daalde
Bicarbonaat
marginaal
daaldepH
daalde
maar dichter bij
normaalpCO2
marginaal
daalde
Bicarbonaat
daaldeBeperkte
compen-
verş gunning voor het in de
metabole
loogziekteBlood gas
results after
full
compen-
sationpH normal
pCO2
increased
Bicarbonate
increasedpH normal
pCO2
decreased
Bicarbonate
decreasedpH normal
pCO2
decreased
Bicarbonate
decreasedLimited
compen-
sation in
metabolic
alkalosisPrintvriendelijke versie van table, pdf.
tabel II. bloedgas resulteert in verstoringen van de gezichtsbasisbalans
respiratoire compensatie voor een primaire metabole verstoring treedt veel sneller op dan metabole (renale) compensatie voor een primaire respiratoire verstoring. In het tweede geval vindt compensatie plaats over dagen in plaats van over uren.
als compensatie resulteert in een normale pH-normaalteruggang, wordt gezegd dat de patiënt volledig wordt gecompenseerd. Maar in veel gevallen keert de compensatie terug naar normaal zonder daadwerkelijk normaliteit te bereiken; in dergelijke gevallen wordt gezegd dat de patiënt gedeeltelijk wordt gecompenseerd.
voor de hierboven beschreven redenen wordt metabole alkalose zeer zelden volledig gecompenseerd.
gemengde zuur-base-stoornissen
Uit bovenstaande discussie kan worden aangenomen dat alle patiënten met zuur-base-stoornissen slechts lijden aan één van de vier categorieën van zuur-base-balans. Dit kan het geval zijn, maar in bijzondere omstandigheden kunnen patiënten meer dan één verstoring vertonen.
overweeg bijvoorbeeld de patiënt met een chronische ziekte zoals emfyseem die al lang een partieel gecompenseerde respiratoire acidose heeft. Als deze patiënt ook adiabetisch was die zijn normale insulinedosis niet had ingenomen en als gevolg daarvan in een toestand van diabetische ketoacidose verkeerde, zouden de bloedgasresultaten het gecombineerde effect van zowel respiratoire acidose alsmetabole acidose weerspiegelen.
dergelijke gemengde zuur-base-stoornissen komen niet zelden voor en kunnen moeilijk te ontrafelen zijn op basis van alleen de resultaten van arteriaalbloedgas.
samenvatting
het behoud van een normale pH van het bloed heeft betrekking op verschillende orgaansystemen en is afhankelijk van de bloedsomloopintegriteit. Het is dan ook niet verwonderlijkdat verstoring van zuur-base-balans het verloop van zeer uiteenlopende ziekten en trauma aan vele delen van het lichaam kan compliceren. Het lichaam heeft aanzienlijke macht om de pH van het bloed te behouden, endistributies impliceren meestal ofwel ernstige chronische ziekte of acutekritische ziekte.
de resultaten van de analyse van arterieel bloedgas kunnen zuur–base-verstoring identificeren en waardevolle informatie over de oorzaak ervan verschaffen.
sommigen suggereerden verder te lezen
- Thomson WST, Adams JF, Cowan RA. Klinische zuur-base balans. Oxford: Oxford Medical Publications 1997
- Harrison RA. Zuur-base balans. Respir Care Clin N. America 1995; 1,1: 7-21
- Woodrow P. Arterial blood gas analysis. Nursing Standard 2004; 18,21: 45-52
- Sirker AA, Rhodes A, Gounds RM, Bennet ED. Zuur-base fysiologie: de’ traditionele ‘en de’ moderne ‘ benadering. Anesthesie 2002; 57: 348-56