omdat de meeste nieuwe hydroxideionen worden verwijderd, neemt de pH niet veel toe.
verwijdering van de hydroxideionen door reactie met waterstofionen
onthoud dat er enkele waterstofionen aanwezig zijn door de ionisatie van het ethaanzuur.
![]()
![]()
Hydroxide-ionen kunnen hiermee worden gecombineerd om water te maken. Zodra dit gebeurt, de evenwicht tips om ze te vervangen. Dit blijft gebeuren totdat de meeste hydroxide-ionen zijn verwijderd.
![]()
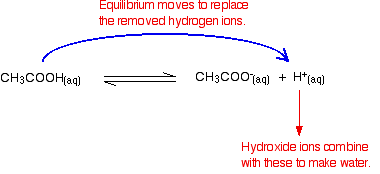
nogmaals, omdat er evenwichten bij betrokken zijn, worden niet alle hydroxide – ionen verwijderd-slechts de meeste. Het gevormde water re-ioniseert in zeer geringe mate tot enkele waterstofionen en hydroxide-ionen.
alkalische bufferoplossingen
We nemen een mengsel van ammoniak en ammoniumchlorideoplossingen als typisch.
ammoniak is een zwakke base, en de positie van dit evenwicht zal ruim naar links liggen:
![]()
![]()
het toevoegen van ammoniumchloride hieraan voegt veel extra ammoniumionen toe. Volgens het principe van Le Chatelier zal dat de positie van het evenwicht nog verder naar links doen omslaan.
De oplossing zal daarom deze belangrijke dingen bevatten:
-
partijen niet-gereageerde ammoniak;
-
partijen ammoniumionen uit het ammoniumchloride;
-
voldoende hydroxideionen om de oplossing alkalisch te maken.
andere zaken (zoals water en chloride-ionen) die aanwezig zijn, zijn niet belangrijk voor het argument.
een zuur toevoegen aan deze bufferoplossing
Er zijn twee processen die de waterstofionen kunnen verwijderen die u toevoegt.
verwijdering door reactie met ammoniak
de meest waarschijnlijke basisstof waarmee een waterstofion zal botsen is een ammoniamolecuul. Ze zullen reageren om ammoniumionen te vormen.
![]()
![]()
De meeste, maar niet alle, waterstofionen zullen worden verwijderd. Het ammoniumion is zwak zuur, waardoor sommige waterstofionen weer vrijkomen.
verwijdering van de waterstofionen door reactie met hydroxideionen
onthoud dat er enkele hydroxideionen aanwezig zijn uit de reactie tussen ammoniak en water.
![]()
![]()
waterstofionen kunnen met deze hydroxideionen water maken. Zodra dit gebeurt, de evenwicht tips om de hydroxide ionen te vervangen. Dit blijft gebeuren totdat de meeste waterstofionen zijn verwijderd.
![]()
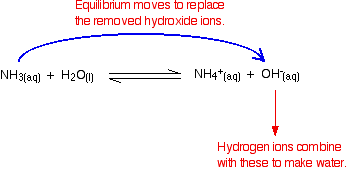
ook hier worden niet alle waterstofionen verwijderd, maar de meeste.
toevoeging van een alkali aan deze bufferoplossing
De hydroxideionen uit de alkali worden door een eenvoudige reactie met ammoniumionen verwijderd.
![]()
![]()
omdat de ammoniak gevormd is een zwakke base, kan het reageren met het water – en dus is de reactie enigszins omkeerbaar. Dat betekent dat de meeste (maar niet alle) hydroxide-ionen uit de oplossing worden verwijderd.
berekeningen met bufferoplossingen
Dit is slechts een korte inleiding. Er zijn meer voorbeelden, waaronder verschillende variaties, over 10 pagina ‘ s in mijn chemie berekeningen boek.
zure bufferoplossingen
Dit is gemakkelijker te zien met een specifiek voorbeeld. Vergeet niet dat een zuurbuffer kan worden gemaakt van een zwak zuur en een van zijn zouten.
stel dat je een bufferoplossing hebt die 0,10 mol dm-3 ethaanzuur en 0 bevat.20 mol dm-3 natriumethanoaat. Hoe bereken je de pH?
in elke oplossing die een zwak zuur bevat, is er een evenwicht tussen het niet-geïoniseerde zuur en zijn ionen. Voor ethaanzuur heb je dus het evenwicht:
![]()
![]()
de aanwezigheid van de ethanoaationen uit het natriumethanoaat zal het evenwicht naar links hebben verplaatst, maar het evenwicht bestaat nog steeds.
dat betekent dat je de evenwichtsconstante, Ka, hiervoor kunt schrijven:
![]()
![]()
wanneer u eerder berekeningen met behulp van deze vergelijking met een zwak zuur hebt uitgevoerd, zult u hebben aangenomen dat de concentraties van de waterstofionen en ethanoaationen gelijk waren. Elk molecuul ethaanzuur dat zich splitst geeft één van elke soort ion.
dat is niet langer waar voor een bufferoplossing:
![]()
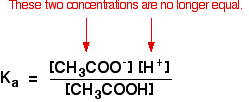
als het evenwicht nog verder naar links wordt geduwd, zal het aantal ethanoaationen uit het ethaanzuur volledig verwaarloosbaar zijn in vergelijking met die uit het natriumethanoaat.
We gaan er daarom van uit dat de concentratie van het ethanoaation gelijk is aan de concentratie van het natriumethanoaat – in dit geval 0,20 mol dm-3.
bij een zwakke zuurberekening gaan we er normaal gesproken van uit dat zo weinig van het zuur geïoniseerd is dat de concentratie van het zuur bij evenwicht dezelfde is als de concentratie van het zuur dat we gebruikten. Dat geldt des te meer nu het evenwicht nog verder naar links is verschoven.
dus de veronderstellingen die we maken voor een bufferoplossing zijn:
![]()
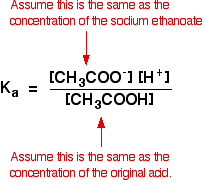
nu, als we de waarde voor Ka kennen, kunnen we de waterstofionconcentratie berekenen en dus de pH.
Ka voor ethaanzuur is 1,74 x 10-5 mol dm-3.
onthoud dat we de pH willen berekenen van een bufferoplossing die 0,10 mol dm-3 ethaanzuur en 0,20 mol dm-3 natriumethanoaat bevat.
![]()
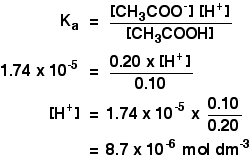
dan hoeft u alleen maar de pH te vinden met behulp van de expressie
pH = -log10
u hebt nog steeds de waarde voor de waterstofionconcentratie op uw rekenmachine, dus druk op de log-knop en negeer het negatieve teken (om het minteken in de pH-expressie toe te staan).
u krijgt een antwoord van 5.1 op twee significante cijfers. Je kunt niet nauwkeuriger zijn dan dit, omdat je concentraties slechts aan twee cijfers werden gegeven.