- Introduksjon
- Materialer og Metoder
- Stammer
- DNA-Ekstraksjon
- STX1 OG STX2 PCR-Forsterkninger
- DNA-Sekvensering
- Mikroplate Vero Cellepreparater
- Cellefrie Bakteriepreparater
- Cytotoksisk Analyse og LD50-Bestemmelse
- Blokade-Og Toksinnøytraliseringsanalyse
- OMVs Innkjøp og DNA Ekstraksjon fra OMVs
- Resultater
- STX1-Og STX2-GEN PCR-Forsterkninger
- DNA-Sekvensering
- Cytotoksisk Analyse og LD50-Bestemmelse
- Toksin Nøytralisering
- STX1 Genet PCR Forsterkninger fra OMVs
- Diskusjon
- Forfatterbidrag
- Midler
- Interessekonflikt
- Takk
- Forkortelser
Introduksjon
I flere år, betydningen Av Aeromonas spp. flere studier viste at den patogene mekanismen Til Aeromonas er multifaktoriell fordi mange virulensfaktorer er involvert, inkludert produksjon av cytotoksiner (Castro-Escarpulli et al., 2002, 2003). Disse toksinene kan forårsake diare eller hemorragisk kolitt, og kan spille en viktig rolle i hemolytisk-uremisk syndrom (HUS) og ttp-utvikling (Bogdanović et al., 1991; Fang et al., 1999; Monforte-Cirac et al., 2010).
cytotoksinene som er involvert i disse sykdommene inkluderer Shiga toksin og nært beslektet Stx. Stx varianter er uttrykt I Shigella, Enterobacter, Citrobacter, Acinetobacter, Campylobacter og Hamiltonella bakteriearter (Mauro Og Koudelka, 2011). Alperi Og Figueras (2010) beskrev tilstedeværelsen Av Stx1 Og Stx2 i kliniske isolater Av Aeromonas spp., assosiert med gastroenteritt, hemorragisk kolitt OG HUS. Gener som koder for disse toksinene ligger i forskjellige lambdoid bakteriofager som lysogeniserer denne stammen. I tillegg har Slekten Aeromonas et nullsekresjonssystem kalt OMVs. Omver kan være et middel som noen proteiner, RNA, periplasmic plass komponenter og andre komponenter forbundet med virulens, kan overføres horisontalt til andre slekter; derfor er det antatt at Omver spille en viktig rolle i patogenitet (Guerrero-Mandujano et al., 2015a, b).av denne grunn var målet med denne studien å evaluere skaden forårsaket av produksjon Av Stx av stammer isolert fra Mexico City-barn i Vero-cellekulturer.
Materialer og Metoder
Stammer
denne studien inkluderte 66 kliniske isolater FRA INP, 54 oppnådd fra tarm og 12 fra ekstra tarminfeksjoner. Stammer ble isolert fra prøver oppnådd for rutinemessig testing på nevnte sykehus; derfor var det ikke nødvendig med informert samtykke fra foreldre eller juridiske foresatte av barn. Alle stammer ble genetisk identifisert AV 16S rDNA-RFLP (Hern@ndez-Cortez et al., 2011). Den typede stammen For Escherichia coli O157: H7 CECT 4076 ble brukt som positiv kontroll og e. coli K12 stamme (5512 ENCB) fra samlingen Av Medisinsk Bakteriologi Laboratorium (Escuela Nacional De Ciencias Biologicas, IPN) ble brukt som negativ kontroll for toksinproduksjon. Stammene ble opprettholdt i korte perioder ved romtemperatur på blodagarbaserte skråninger; for lengre lagring ble de enten frosset ved -70°C i 20% (w/v) glyserol-Todd – Hewitt-buljong (Oksoid, Mexico) eller lyofilisert i 7.5% hest glukose serum.
DNA-Ekstraksjon
alle kulturer ble dyrket på tryptisk soya agar ved 30°C i 18 timer. det genomiske DNA av hver stamme ble oppnådd Gjennom InstaGene Matrix (BioRad®, Mexico) i henhold til instruksjonene fra produsenten. DNA renhet og mengde ble bestemt ved Hjelp Av Amplikvant AQ – 07 spektrofotometer. DNA ble lagret ved -20°C til bruk.
STX1 OG STX2 PCR-Forsterkninger
tilstedeværelsen av STX1 og stx2 FRA DNA Fra OMVs og genomisk DNA ble detektert ved enkelt PCR-reaksjoner ved bruk av primere STX1F/STX1R og stxf/STXR med henholdsvis 144 og 217 bp-produkt, disse primerne ble utformet basert på sekvensen av underenhet A. primerne, reaksjonen og amplifikasjonsforholdene ble behandlet som tidligere beskrevet av Hern@ndez-cortez et al. (2013), med de positive (E. coli O157:H7) og negative (E. coli K12) kontrollene.
DNA-Sekvensering
Polymerasekjedereaksjonsprodukter ble renset ved Hjelp Av Et PureLink Quick Gel Extraction Kit (Invitrogen®, Mexico) i henhold til produsentens instruksjoner. Produktene ble direkte sekvensert på EN ABI-PRISM 310 Genetisk Analysator (Applied Biosystems, Foster City, CA, USA) ved hjelp av forover og revers primere som brukes TIL PCR, i henhold til produsentens instruksjoner. Sekvensering ble utført Ved Instituto De Biologí, UNAM (Mexico). Sekvensanalyse ble utført Med Basic Local Alignment Search Tool (BLAST) levert Av National Center For Biotechnology Information (NCBI).
Mikroplate Vero Cellepreparater
denne prosedyren ble utført i 96-brønns mikroplater med Vero (ATCC CCL81) cellemonolag med 80% sammenløp, og tilsatte minimalt essensielt medium (Mem; Invitro®, Mexico) supplert med 10% v/v føtalt bovint serum (FBS; Invitro®, Mexico).cellesuspensjonen ble homogenisert og justert til 105-106 celler/mL ved Hjelp Av Et neubauer-kammer. Etter justering ble suspensjonen deponert i 200-hryvnl brønn. Mikroplatene ble inkubert ved 37°C under 5% CO2 i 24 timer (CO2-Inkubator, VWR Scientific, USA) (Giono-Cerezo et al., 1994).
Cellefrie Bakteriepreparater
Fem kolonier fra hver blodagarplate ble inokulert i 3 mL Craig medium (0,4% gjærekstrakt, 3% casaminosyrer, 0,05% K2HPO4). Disse ble inkubert i 24 timer ved 37°C og den optiske tettheten av bakteriekulturen som ble brukt var 0,25 ved 600 nm. Cellefrie preparater ble laget ved sentrifugering av kulturer ved 14 000 g i 10 minutter ved 4°C, etterfulgt av filtrering av supernatanten gjennom et membranfilter (porestørrelse 0,45 pm, Sartorius Minisart NML). Cellefrie supernatanter ble lagret ved -20°C. totalt 66 cellefrie bakteriepreparater ble oppnådd på denne måten; den positive kontrollen (E. coli O157: H7)og den negative kontrollen (E. coli K12) ble oppnådd også på samme måte (Giono-Cerezo et al., 1994).
Cytotoksisk Analyse og LD50-Bestemmelse
det cellefrie filtratet (20 µ) ble inokulert i brønner som inneholdt celler og det respektive vekstmediet uten antibiotika. Inokulerte celler ble inkubert i 96 timer ved 37°C med 5% CO2 og observert hver 24. time på det inverterte mikroskopet. Den cytotoksiske effekten ble forventet å oppstå som avrunding og krymping av celler med tykk granulering og til slutt progressiv og irreversibel ødeleggelse av monolaget. Alle tester ble utført i to eksemplarer; levedyktighetskontroller med MEM og Craig medium ble utført også (Giono-Cerezo et al., 1994).
LD50 ble bestemt i Aeromonas-stammer som ble påvist som positive for å forårsake cytotoksisk skade I Vero-celler. En standard 96-brønns mikroplate Med Vero-celler ble utarbeidet som angitt i 2.6, men mediet ble endret til 100 µ AV MEM med 1% BFS. Dette preparatet ble eksponert for 100 µ cellefritt bakteriepreparat, og serielle fortynninger ble gjort på hele raden av plater. ETTER 24 timers inkubasjon ved 37°C med 5% CO2 ble LD50 bestemt under det inverterte mikroskopet. LD50 ble tildelt brønnen der 50% Av Vero-cellene ble skadet og 50% uskadet (Marques et al., 1986).
Blokade-Og Toksinnøytraliseringsanalyse
toksinnøytraliseringsanalysen ble utført i stammer som induserte cytotoksisk skade i Vero-celler fordi denne skaden er indikativ For Stx. For denne testen ble En mikroplate fremstilt Med Vero-celle vokst til en sammenløp på 90-100% med LD50 av hvert cellefritt bakteriepreparat. For å utføre nøytraliseringsanalysen for å vise celleskader produsert som følge Av Stx-virkning, ble det brukt to monoklonale antistoffer (Universidad Nacional Aut@noma de Mé) fra E. coli O157:H7.
For Hver Ab Ble En bradford-proteinkvantitasjon utført i henhold til produsentens anvisninger (Biorad), med henholdsvis 78,2 og 74,8 µ/µ, av anti-Stx1 og anti-Stx2 A. den konsentrerte Ab ble bearbeidet og en dobbel fortynning Av Ab. Deretter ble 10 hryvnl Av Ab (anti-STX1 eller anti-STX2) inkubert med 190 hryvnl av den cellefrie supernatanten i en konsentrasjon PÅ LD50 i 1 h ved 37°C. Etter Dette ble 200 µ av sistnevnte inokulert I Vero-celler ved 90% av sammenløp og inkubert i 24 h ved 37°C med 5% CO2(Marques et al ., 1986).
OMVs Innkjøp og DNA Ekstraksjon fra OMVs
Ytre membranvesikler ble oppnådd Fra Aeromonas hydrofila F-0050. Protokollen ble utført som tidligere beskrevet Av Guerrero-Mandujano et al. (2015a).
OMVs’ DNA ble oppnådd Gjennom InstaGene Matrix (BioRad®, Mexico) i henhold til instruksjonene fra produsenten. DERETTER ble OMVs’ DNA renset MED DNA-ekstraksjon fenol-kloroform teknikk (Guerrero-Mandujano et al.( 2015b).
Resultater
STX1-Og STX2-GEN PCR-Forsterkninger
polymerasekjedereaksjonsscreening av 66 kliniske Aeromonas-stammer viste at 22/66 (33,3%) stammer inneholdt stx1-genet, 42/66 (63,6%) stammer inneholdt begge gener, ingen stammer inneholdt bare stx2-genet, og 2/66 (3%) stammer var negative for begge gener.
DNA-Sekvensering
blastn analyse viste en 79 til 99% likhet og en forventet verdi på 3e-16/2e-97 mellom stx-1 / stx-2 gener Av E. coli O157:H7 Og amplicon Fra Aeromonas spp., belastning.
Cytotoksisk Analyse og LD50-Bestemmelse
cytotoksisitetstesten utført I Vero-cellekulturer viste at 17/66 (25,7%) cellefrie bakteriepreparater forårsaket cytotoksisk skade, noe som tyder på produksjon av en aktiv Stx (Figur 1), avslørt av den karakteristiske skaden Forårsaket Av Stx.
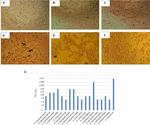
FIGUR 1. Cytotoksisitetsanalyse og LD50-bestemmelse utført I Vero – cellekulturer. (A) Vero cellekultur Med Minimalt Essensielt Medium(Levedyktighetstest). (B) Vero cellekultur Med Craig Medium(Levedyktighet test). (C) Negativ kontroll med E. coli K12. (D) Positiv kontroll Med E. coli O157: H7, Cytotoksisk skade er vist (piler) ved ødeleggelse av cellemonolaget og» gammel blonder » effekt. (E) Cytotoksisk skade Av a. hydrofila f-0050 stamme. (F) Cytotoksisk skade Av a. caviae 421423 stamme. (G) Grafisk representasjon AV LD50 titer av alle stammer.RESULTATENE for bestemmelse AV LD50-titeren var som følger: 6/17 (35,2%) cellefrie bakteriepreparater presenterte en titer på 1:16; 5/17 (29,4%) cellefrie bakteriepreparater viste en titer på 1:8; 3/17 (17,6%) cellefrie bakteriepreparater hadde en titer på 1:64; 2/17 (11,7%) cellefrie bakteriepreparater med en titer på 1:32; og 1/17 (5,8%) cellefrie BAKTERIEPREPARATER MED en titer på 1:256 (figur 1g).
Toksin Nøytralisering
anvendelsen av anti-STX1 Ab i 11/17 (64 .7%) stammer skaden på cellene i supernatanten ble fullstendig hemmet ved 39,1 µ/µ ab-konsentrasjon; i 4/17 (23,5%) cellefrie bakteriepreparater ble det observert redusert celleskade ved samme konsentrasjon; og i 2/17 (11,7%) cellefrie bakteriepreparater ble celleskader fullstendig hemmet ved en konsentrasjon 78,2 µg/µ. Ved Bruk Av Ab anti-STX2 viste det seg at i 9/17 (52,9%) cellefrie bakteriepreparater ble celleskader fullstendig hemmet ved 37,4 µ/µ, og 6/17 (35,2%) cellefrie bakteriepreparater viste redusert celleskade i samme konsentrasjon; og i 2/17 (11.7%) cellefrie bakteriepreparater ble celleskader fullstendig hemmet med En ab-konsentrasjon på 74,8 µ/µ (Figur 2 og 3).

FIGUR 2. Hemming av cytotoksisk effekt indusert I Vero cellekultur ved cellefrie bakteriepreparater Av Aeromonas spp. stammer som bærer stx1-eller stx2-genet.
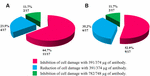
FIGUR 3. Prosent av stammer som viste hemming eller reduksjon av celleskader. (A) Nøytralisering med anti-Stx1 Ab. (B) Nøytralisering med anti-Stx2 Ab.
STX1 Genet PCR Forsterkninger fra OMVs
Polymerase kjedereaksjon Av OMVs’ DNA Av A. hydrophila F-0050 avslørte OMVs inneholdt gen stx1; derfor, OMVs kan være et potensielt redskap for horisontal virulens gener overføring (Figur 4).
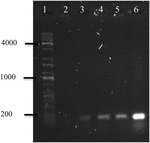
FIGUR 4. Elektroferogram av stx1 genforsterkning FRA OMVs’ DNA. (1) Kapa Universell Stige, (2) Negativ kontroll, (3) Omv Av a. hydrofila F-0050, (4) a. hydrofila F-0050, (5) Omv Av E. coli O157:H7 og (6) E. coli O157: H7.
Diskusjon
slekten Aeromonas, som Produsent Av Stx, kan være et fremvoksende patogen som forårsaker diare hovedsakelig hos pediatriske pasienter (Hern@ndez-Cortez et al.(2011; Figueras Og Baez-Hidalgo, 2014). Likevel har denne slekten blitt mer relevant i det medisinske området, da det er et patogen som forårsaker HUS (San Joaquí og Pickett, 1988; Bogdanović et al., 1991; Robson et al., 1992; Fang et al., 1999; Monforte-Cirac et al., 2010).
i denne studien fant VI, VED PCR-forsterkning av stx1-og stx2-genene, at 22/66 (33.3%) av aeromonad-stammene inneholdt stx1-genet, 42/66 (63,6%) stammer inneholdt begge gener, og det var ingen stammer som inneholdt stx2 alene. Dette kan føre oss til å foreslå at dette genet er utbredt i Aeromonas-stammene isolert fra pediatriske pasienter, og at disse pasientene kan være i fare for å utvikle HUS.det er bare en tidligere rapport hvor stx-genene ble studert i Aeromonas-stammer isolert fra forskjellige sykehus i Spania; resultatene som ble oppnådd var at 19/80 (23,7%) stammer hadde stx1-genet og bare 1/80 (1.25%) stamme var positiv for begge gener(Alperi Og Figueras, 2010). Disse resultatene formidler at det er en større fordeling av genet i Meksikanske stammer; vi bør imidlertid ta hensyn til At I Spania Er Aeromonas-slekten et kjent gastrointestinalt patogen isolert rutinemessig hos pasienter med en gastrointestinal profil.
I Mexico er denne slekten ikke inkludert i listen over patogener som forårsaker diare, og den er ikke isolert rutinemessig; som et resultat er det vanskelig å gi noen behandling og god livskvalitet til pasienter; dessuten er det ingen statistikk om utbredelsen. I tillegg blir slekten mer relevant på grunn av de sosioøkonomiske forholdene til Den Meksikanske befolkningen, som inkluderer vannmangel; dette letter overføringen og øker muligheten FOR AT HUS blir et folkehelseproblem.Sekvensering av amplikonene ble utført og Et Blastsøk ble utført, som viste 79-99% likhet og en forventet verdi på 3e-16/2e-97 mellom gener stx1 / stx2 sammenlignet Med E. coli O157:H7.
LD50 ble bestemt for å evaluere cytotoksisk skade I Vero cellekultur; med denne parameteren og basert På Marques et al. (1986), kan stammene grupperes i lav (2 × 101 til 6 × 102), moderat (103-104) og høy (105-108) produksjon (Figur 1g). Marques et al. (1986) gjennomførte en studie der de gjorde en lignende analyse som i denne studien, men med forskjellige stammer AV STEC, oppnådde de at 262/400 (63%) stammer ble gruppert som lave stx-produsenter, og 48% produserte cytotoksisk skade; likevel, i 40% av disse stammene ble den cytotoksiske skaden hemmet med anti-Stx antistoffer.
i denne studien forårsaket 25,7% av bakteriefrie preparater cytotoksisk skade som er karakteristisk For Stx i Vero-celler, noe som tyder på produksjon av aktiv Stx, alle Aeromonas-stammer ble gruppert som lave produsenter Av Stx; i 50-70% av de cellefrie supernatantene ble den cellulære skaden hemmet, og i 20-30% av cellefrie supernatanter ble den cellulære skaden redusert (Figur 3). De cellefrie supernatanter hvor cellulær skade ble redusert dette kunne ha vært på grunn av to varianter i toksinet tilstede i supernatanten, derfor, da De er forskjellige immunologisk, Kunne Stx ikke bli helt hemmet og den cellulære skaden forble (Marques et al., 1986).
To tidligere studier (Haque et al., 1996; Alperi Og Figueras, 2010) oppnådde henholdsvis 10,2% og 10,53% av Stx1-produserende Aeromonas-stammer. Årsaken til en høyere prosentandel Av Aeromonas-stammer som produserer aktiv Stx, kan skyldes den høye tilgjengeligheten Av stx-bakteriofagen inne i kulturen, da NOEN STEC-stammer bærere Av Stx-bakteriofagen har blitt isolert fra urbane avløpsvann fra renseanlegg, avløpsvann fra slakterier og storfestoler (Garc@a-Aljaro et al., 2004, 2009). På samme måte har transduksjonsstudier blitt utført in vivo med Stx-fager Fra E. coli, som kan infisere tarmmikrobiotabakterier, noe som gir den toksigeniske egenskapen til stammer som ikke var infisert før (Acheson et al., 1998; Schmidt et al., 1999; Gamage et al., 2003). Det samme kan skje med Slekten Aeromonas når man induserer en gastrointestinal profil, etterfulgt av at slekten Aeromonas har evnen til å fange og integrere virulensfaktorer i sitt genom, og en Av disse Er Stx-kodende genet.resten av stammene forårsaket cytotonisk skade i cellen, noe som muligens tyder på produksjon av forskjellige toksiner enn Stx, siden Aeromonas er et slekt som er i stand til å produsere to cytotoniske enterotoksiner, termostabile (AST) og termolabile (ALT) (Figueras og Baez-Hidalgo, 2014), som kan forårsake cytotonisk skade I Vero-celler; En annen mulighet er At Aeromonas-stammene har mer enn en bakteriofag satt inn i deres genom, da DET har vist seg at STEC-stammer med dobbelt lysogeni er i stand til å regulere bakteriofager for å hemme kapasiteten til lytisk syklusinduksjon, noe som resulterer i en reduksjon Av Stx-produksjonen, men uten å miste genet (Garcauka-Aljaro et al.(2004; Imamovic Og Muniesa, 2011). Derfor er det nødvendig å fastslå hvor mange bakteriofager Aeromonas stammer inneholder, inkludert i denne studien, for å kunne korrelere tilstedeværelsen Av stx bakteriofager og mengden produsert Av Stx.på den annen side representerer tilstedeværelsen Av stx bakteriofager i inducerbare Aeromonas en horisontal overføringsmekanisme av stx-genet, men det er ikke den eneste. I nyere studier har Det blitt fastslått At Aeromonas er i stand til å produsere Omver (Guerrero-Mandujano et al., 2015a) og Disse Omvene er i stand til å transportere integrert DNA (Guerrero-Mandujano et al.( 2015b). I denne studien forsterket vi stx1-genet fra DNA ekstrahert fra Omvene av en a. hydrofila-stamme av klinisk opprinnelse, som induserte cytotoksisk skade I Vero-celler, og denne skaden ble hemmet med anti-Stx-antistoffer. Dette indikerer At stx-bakteriofagen er transportmekanismen til stx-genet; videre Er Omvene og Det nylig kalt Transportsystem type 0 i stand til å spre stx-genet interspecies eller intraspecies. Likevel er det nødvendig å bekrefte om genet i Omvene er fullført. Resultatene oppnådd i denne studien støtter hypotesen om at stx-genet er en annen antatt virulensfaktor Av Aeromonas som kan overføres gjennom OMVs. Det kan representere en annen mekanisme for horisontal transport av stx-genet til andre Aeromonas-stammer og / eller andre bakterielle slekter.
av denne grunn bør denne slekten inkluderes som mulig utløsende agent for gastroenteritt når man prøver å identifisere kausale midler og bør rapporteres som en del av standard helseovervåkningsprosedyrer.
Forfatterbidrag
IP-M og AG-M utførte forsøkene OG MR-R utførte bioinformatikkanalysene og utarbeidet manuskriptet; CH-C designet primeren; VB-G, OG JM-L kommenterte kritisk og revidert manuskriptet; GC-E oppfattet studien, deltok i design og koordinering, vurderte dataene og utarbeidet manuskriptet. Alle forfattere leste og godkjente det endelige manuskriptet. Vi vil gjerne takke Sofia Marteli Mulia for vennlig korrigere stilen på manuskriptet.
Midler
GC-E og VB-G fikk støtte fra Estímulos al Desempeño no Investigación og Comisión y Fomento de Actividades Académicas (Instituto Politécnico Nacional) og Sistema Nacional de Investigadores (SNI, CONACyT). Denne studien ble finansiert av Sekretariatet For Forskning og Doktorgrad Ved National Polytechnic Institute (SIP 20160609). SIP-IPN var ikke involvert i utviklingen av studiedesign, innsamling, analyse og tolkning av data, i skrivingen av rapporten eller i beslutningen om å sende papiret til publisering. IP-M og AG-M hadde stipend Fra CONACyT OG BEIFI.
Interessekonflikt
forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller økonomiske forhold som kan tolkes som en potensiell interessekonflikt.
Takk
vi takker Dr. Patricia Arzate Barbosa for å gi stamme isolater og Dr. Armando Navarro for å gi de monoklonale antistoffene.
Forkortelser
Ab, Antistoff; HUS, Hemolytisk uremisk syndrom; Inp, Instituto Nacional De Pediatria Mexico; LD50, MEDIAN dødelig dose; OMVs, Outer membrane vesicles; PCR, Polymerase chain reaction; STEC, Shiga toxin-producing E. coli; Stx, Shiga-like toxin; TTP, Thrombotic thrombocytopenic purpura.
Acheson, D. W., Reidl, J., Zhang, X., Keusch, G. T., Mekalanos, J. J., and Waldor, M. K. (1998). In vivo transduction with shiga toxin 1-encoding phage. Infect. Immun. 66, 4496–4498.
Google Scholar
Alperi, A., and Figueras, M. J. (2010). Humane isolater Av Aeromonas besitter shiga toksin gener er (stx1 og stx2) svært lik broen virulente genvarianter Av Escherichia coli. Clin. Mikrobiol. Infisere. 16, 1563-1567. doi: 10.1111/j.1469-0691. 2010. 03203.x
CrossRef Full Text | Google Scholar
Bogdanovic, R., Č, M., Markovic, M., Nikolic, V., Ognjanović, M., Sarjanović, L., Et al. (1991). Hemolytisk-uremisk syndrom assosiert Med Aeromonas hydrophila enterocolitt. Pediatr. Nephrol. 5, 293-295. doi: 10.1007
Kryssref Full Tekst | Google Scholar
Castro-Escarpulli, G., Aguilera-Arreola, M. G., Giono-Cerezo, S., Hern@ndez-Rodríguez, C. H., Rodriguez-Chacon, m., soler, F. L., ET AL. (2002). Slekten Aeromonas > et viktig patogen I Mexico? Enf. Infec. Mike. 22, 206–216.
Google Scholar
Castro-Escarpulli, G., Figueras, M. J., Aguilera-Arreola, M. G., Soler, L., Fern Hryvndez-Rendó, E., Aparicio, G. O., et al. (2003). Karakterisering Av Aeromonas spp. isolert fra frossen fisk beregnet til konsum I Mexico. Int. J. Mat Mikrobiol. 84, 41–49. doi: 10.1016/S0168-1605 (02) 00393-8
CrossRef Full Text | Google Scholar
Fang, J. S., Chen, J. B., Chen, W. J., Og Hsu, K. T. (1999). Hemolytisk-ureemisk syndrom hos en voksen mann med Aeromonas hydrofila enterokolitt. Nephrol. Oppringt. Transplantasjon. 14, 439–440. doi: 10.1093 / ndt / 14.2.439
CrossRef Full Text / Google Scholar
Figueras, M. J., Og Baez-Hidalgo, R. (2014). «Aeromonas,» I Encyclopedia Of Food Microbiology, eds Ca Batt og Ml Tortorello (Cambridge, MA: Academic Press), 24-30.
Gamage, S. D., Strasser, J. E., Kritt, C. L., Og Weiss, Aa (2003). Nonpathogenic Escherichia coli kan bidra til produksjon av shiga toksin. Infisere. Immun. 71, 3107–3115. doi: 10.1128 / IAI.71.6.3107-3115.2003
CrossRef Full Text | Google Scholar
Garcí-Aljaro, C., Muniesa, M., Jofre, J., Og Blanch, A. R. (2004). Prevalens av stx2-genet i koliforme populasjoner fra akvatiske miljøer. Appl. Miljø. Mikrobiol. 70, 3535–3540. doi: 10.1128 / AEM.70.6.3535-3540.2004
CrossRef Full Text | Google Scholar
Garcí-Aljaro, C., Muniesa, M., Jofre, J., Og Blanch, A. R. (2009). Genotypisk og fenotypisk mangfold blant induserte, stx2-bærende bakteriofager fra miljømessige Escherichia coli-stammer. Appl. Miljø. Mikrobiol. 75, 329–336. doi: 10.1128 / AEM.01367-08
CrossRef Full Text / Google Scholar
Giono-Cerezo, S., Rodríguez-Á, M. G., Rodrí-Cadena, M. J. og Valdespino-Gó, J. L. (1994). Identifikasjon av enterotoksiner og cytotoksiner Av Escherichia coli ved hjelp av vero – cellekultur og fastfasehybridisering (colony blot). Pastor Latinoam. Mikrobiol. 36, 231–241.
Google Scholar
Guerrero-Mandujano, A., L ④ez-Villegas, E. O., Longa-Briseñ, A., Og Castro-Escarpulli, G. (2015a). Produksjon av ytre membranvesikler i en klinisk stamme Av Aeromonas hydrofila. Ec Mikrobiol. 1, 113–117.
Google Scholar
Guerrero-Mandujano, A., Palma-Mart@nez, I., Og Castro-Escarpulli, G. (2015b). Transport DNA av ytre membran vesikler Av Aeromonas hydrophila. Ec Mikrobiol. 2, 354–357.
Google Scholar
Haque, Q. M., Sugiyama, A., Iwade, Y., Midorikawa, Y., Og Yamauchi, T. (1996). Diare og miljøisolater Av Aeromonas spp. lag et gift som ligner på shiga – lignende toksin 1. Curr. Mikrobiol. 32, 239–245. doi: 10.1007/s002849900043
CrossRef Full Text | Google Scholar
Hern@ndez-Cortez, C., Aguilera-Arreola, M. G., Chá-Mé, Y., Arzate-Barbosa, P., Lara-hernandez, a., og castro-escarpulli, g. (2011). Genetisk identifikasjon av Stammer Av Aeromonas spp. isolert ved nasjonalt institutt for pediatri. Rev. Enfer. Infecc. Pediatrisk. 24, 157–165.
Google Scholar
Hern@ndez-Cortez, C., Mé-Tenorio, A., Aguilera-Arreola, M. G., Og Castro-Escarpulli, G. (2013). Design og standardisering av fire multiplexpolymerasekjedereaksjoner for å oppdage bakterier som forårsaker gastrointestinale sykdommer. Afr. J. Mikrobiol. Res. 7, 2673-2681. doi: 10.5897/AJMR2013.5452
CrossRef Full Text/Google Scholar
Imamovic, L., Og Muniesa, M. (2011). Kvantifisering og evaluering av smittsomhet av shiga toksin-kodende bakteriofager i biff og salat. Appl. Miljø. Mikrobiol. 77, 3536–3540. doi: 10.1128 / AEM.02703-10
CrossRef Full Text/Google Scholar
Marques, L. R. M., Moore, M. A., Wells, J. G., Wachsmuth, I. K. og O ‘ Brien, A. D. (1986). Produksjon av shiga-lignende toksin Av Escherichia coli. J. Infisere. Dis. 154, 338–341. doi: 10.1093/infdis / 154.2.338
CrossRef Full Text / Google Scholar
Mauro, S. A. og Koudelka, G. B. (2011). Shiga toksin: uttrykk, distribusjon og dens rolle i miljøet. Giftstoffer 3, 608-625. doi: 10.3390 / toxins3060608
CrossRef Full Text/Google Scholar
Monforte-Cirac, M. L., Palacian-Ruiz, M. P., Aisa-Iriarte, M. L., Og Espuelas-Monge, M. (2010). Hemolytisk uremisk syndrom Av Aeromonas: om et klinisk tilfelle. Pastor Clin. Ånd. 210, 206–207. doi: 10.1016 / j.cer . 2009.08.002
CrossRef Full Text / Google Scholar
Robson, W. L. M., Leung, A. K. C., Og Trevenen, C. L. (1992). Hemolytisk-uremisk syndrom assosiert Med Aeromonas hydrophila enterocolitt. Pediatrisk. Nephrol. 6, 221–222. doi: 10.1007
CrossRef Full Text / Google Scholar
San Joaquin, V. H., Og Pickett, Da (1988). Aeromonas-assosiert gastroenteritt hos barn. Pediatr. Infisere. Dis. J. 7, 53-57. doi: 10.1097/00006454-198801000-00013
CrossRef Full Text / Google Scholar
Schmidt, H., Bielaszewska, M., Og Karch, H. (1999). Transduksjon av enteriske escherichia coli isolater med et derivat av shiga toksin 2-kodende bakteriofag f3538 isolert fra Escherichia coli O157: H7. Appl. Miljø. Mikrobiol. 65, 3855–3861.
Google Scholar