fordi de fleste nye hydroksidioner fjernes, øker pH ikke veldig mye.
Fjerning av hydroksidioner ved å reagere med hydrogenioner
Husk at det er noen hydrogenioner tilstede fra ioniseringen av etansyren.
![]()
![]()
Hydroksidioner kan kombineres med disse for å lage vann. Så snart dette skjer, vil likevekten tips for å erstatte dem. Dette fortsetter å skje til de fleste hydroksidioner er fjernet.
![]()
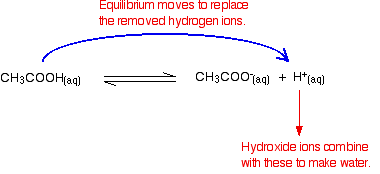
Igjen, fordi du har likevekter involvert, fjernes ikke alle hydroksidioner – bare de fleste av dem. Vannet dannet re-ioniserer i svært liten grad for å gi noen hydrogenioner og hydroksidioner.
Alkaliske bufferløsninger
vi tar en blanding av ammoniakk og ammoniumkloridløsninger som typisk.
Ammoniak er en svak base, og posisjonen til denne likevekten vil være godt til venstre:
![]()
![]()
Legge ammoniumklorid til dette legger masse ekstra ammoniumioner. Ifølge Le Chateliers Prinsipp vil det tippe posisjonen til likevekten enda lenger til venstre.
løsningen vil derfor inneholde disse viktige tingene:
-
masse uomsatt ammoniakk;
-
masse ammoniumioner fra ammoniumklorid;
-
nok hydroksidioner til å gjøre løsningen alkalisk.
Andre ting (som vann og kloridioner) som er til stede, er ikke viktige for argumentet.
Legge til en syre til denne bufferløsningen
Det er to prosesser som kan fjerne hydrogenioner som du legger til.
Fjerning ved å reagere med ammoniakk
det mest sannsynlige grunnstoffet som et hydrogenion kommer til å kollidere med er et ammoniakkmolekyl. De vil reagere for å danne ammoniumioner.
![]()
![]()
De fleste, men ikke alle, av hydrogenioner vil bli fjernet. Ammoniumionet er svakt surt, og så vil noen av hydrogenioner bli frigjort igjen.
Fjerning av hydrogenioner ved å reagere med hydroksidioner
Husk at det er noen hydroksidioner tilstede fra reaksjonen mellom ammoniakk og vannet.
![]()
![]()
Hydrogenioner kan kombinere med disse hydroksidioner for å lage vann. Så snart dette skjer, vil likevekten erstatte hydroksidioner. Dette fortsetter å skje til de fleste hydrogenioner er fjernet.
![]()
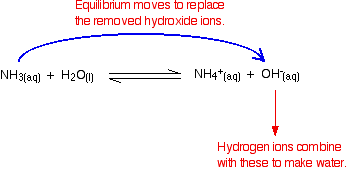
Igjen, fordi du har likevekter involvert, fjernes ikke alle hydrogenioner – bare de fleste av dem.
Tilsetning av et alkali til denne bufferløsningen
hydroksydioner fra alkalien fjernes ved en enkel reaksjon med ammoniumioner.
![]()
![]()
fordi ammoniakk dannet er en svak base, kan den reagere med vannet – og så reaksjonen er litt reversibel. Det betyr at igjen, de fleste (men ikke alle) av hydroksydioner fjernes fra løsningen.
Beregninger som involverer bufferløsninger
Dette er bare en kort introduksjon. Det er flere eksempler, inkludert flere varianter, over 10 sider i min kjemi beregninger bok.
Sure bufferløsninger
dette er lettere å se med et bestemt eksempel. Husk at en syrebuffer kan fremstilles av en svak syre og et av dets salter.
La oss anta at du hadde en bufferløsning som inneholdt 0,10 mol dm-3 av etansyre og 0.20 mol dm – 3 av natriumetanoat. Hvordan beregner du pH?
i enhver løsning som inneholder en svak syre, er det en likevekt mellom den uioniserte syren og dens ioner. Så for etansyre har du likevekten:
![]()
![]()
tilstedeværelsen av etanoationer fra natriumetanoatet vil ha flyttet likevekten til venstre, men likevekten eksisterer fortsatt.
det betyr at du kan skrive likevektskonstanten, Ka, For den:
![]()
![]()
der du har gjort beregninger ved hjelp av denne ligningen tidligere med en svak syre, vil du ha antatt at konsentrasjonene av hydrogenioner og etanoationer var de samme. Hvert molekyl av etansyre som splitter opp gir en av hver type ion.
det er ikke lenger sant for en bufferløsning:
![]()
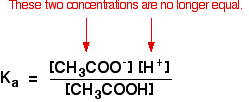
hvis likevekten har blitt presset enda lenger til venstre, vil antall etanoationer som kommer fra etansyren være helt ubetydelig sammenlignet med de fra natriumetanoatet.
vi antar derfor at etanoatjonskonsentrasjonen er den samme som konsentrasjonen av natriumetanoatet-i dette tilfellet 0,20 mol dm-3.
i en svak syreberegning antar vi normalt at så lite av syren har ionisert at konsentrasjonen av syren ved likevekt er den samme som konsentrasjonen av syren vi brukte. Det er enda mer sant nå at likevekten har blitt flyttet enda lenger til venstre.
så forutsetningene vi gjør for en bufferløsning er:
![]()
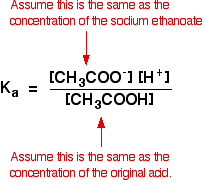
nå, hvis vi vet verdien For Ka, kan vi beregne hydrogenionkonsentrasjonen og dermed pH.
Ka for etansyre er 1,74 x 10-5 mol dm-3.
Husk at vi ønsker å beregne pH i en bufferløsning som inneholder 0,10 mol dm-3 av etansyre og 0,20 mol dm-3 av natriumetanoat.
![]()
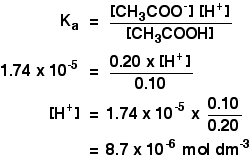
så er alt du trenger å gjøre å finne pH ved hjelp av uttrykket
pH = – log10
du vil fortsatt ha verdien for hydrogenionkonsentrasjonen på kalkulatoren din, så trykk på log-knappen og ignorer det negative tegnet (for å tillate minustegnet i pH-uttrykket).
du bør få svar på 5,1 til to signifikante tall. Du kan ikke være mer nøyaktig enn dette, fordi konsentrasjonene dine bare ble gitt til to figurer.