새로운 수산화 이온의 대부분이 제거되기 때문에 pH 는 그다지 증가하지 않습니다.
제거하는 수산화물이온 반응하여 수소이온
있다는 것을 기억하고 수소이온에서 존재하는 이온화의 ethanoic 산입니다.
![]()
![]()
수산화물이온 결합할 수 있습을 가진 이들을 물. 이런 일이 발생하자마자 평형 팁을이를 대체 할 수 있습니다. 이것은 수산화 이온의 대부분이 제거 될 때까지 계속 발생합니다.
![]()
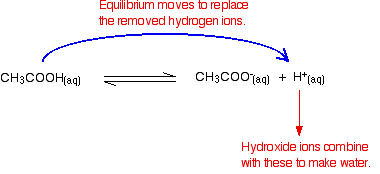
다시,당신이 있기 때문에 평형이 참여,모든 수산화물 이온을 제거-장니다. 물 형성 재 이온화 아주 작은 정도 수 수소 이온 및 수산화 이온 몇 수.
알칼리 버퍼 솔루션
우리는 혼합물의 암모니아 암모늄 염화 솔루션으로 일반적입니다.
암모니아는 약한 염기이며,이 평형의 위치는 왼쪽으로 잘 될 것입니다:
![]()
![]()
추가 염화 염화물이 많이 추가의 추가 암모늄이온. Le Chatelier 의 원리에 따르면,그것은 평형의 위치를 왼쪽으로 더 기울일 것입니다.
솔루션에 따라서는 이러한 중요한 일이다.
-
의 많은 unreacted 암모니아;
-
의 암모늄이온에서의 암모늄 염화물;
-
충분한 수산화물 이온 확인 솔루션을 알칼리성이다.
존재하는 다른 것들(물 및 염화물 이온과 같은)은 인수에 중요하지 않습니다.
이 완충 용액에 산을 첨가
첨가하는 수소 이온을 제거 할 수있는 두 가지 과정이 있습니다.
제거를 반응시켜 암모니아
가능성이 가장 높은 기본적인 물질의 수소이온이 충돌하는 암모니아 분자입니다. 그들은 반응하여 암모늄 이온을 형성 할 것입니다.
![]()
![]()
대부분이지만,모든,수소이온이 제거됩니다. 암모늄 이온은 약산성이므로 수소 이온의 일부가 다시 방출 될 것입니다.
제거의 수소이온 반응하여 수산화물이온
기억이 있다는 것을 몇 가지 수산화물이온 현재 반응에서 사 암모니아 및 물.
![]()
![]()
수소이온 결합할 수 있습으로 이러한 수산화물 이온 확 물. 이런 일이 발생하자마자 수산화 이온을 대체 할 평형 팁이 있습니다. 이것은 수소 이온의 대부분이 제거 될 때까지 계속 발생합니다.
![]()
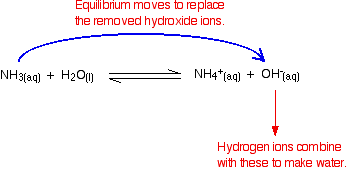
다시,당신이 있기 때문에 평형이 참여,모든 수소이온은 제 다만 그들의 대부분.
를 추가하는 알칼리를 이 버퍼 솔루션
수산화물이온에서 알칼리 제거하여 간단한 반응과 암모늄이온.형성된 암모니아는 약한 염기이기 때문에 물-과 반응할 수 있으므로 반응은 약간 가역적이다. 즉,다시 수산화 이온의 대부분(전부는 아니지만)이 용액에서 제거된다는 것을 의미합니다.
산 관 버퍼 솔루션
이것은 간단한 소개입니다. 내 화학 계산 책에서 10 페이지가 넘는 여러 변형을 포함하여 더 많은 예제가 있습니다.
산성 완충 용액
이것은 특정 예와 함께보기가 더 쉽습니다. 산성 완충제는 약산과 그 염 중 하나로 만들 수 있음을 기억하십시오.
0.10mol dm-3 의 에탄 산과 0 을 함유 한 완충 용액을 가지고 있다고 가정 해 봅시다.나트륨 ethanoate 의 20mol dm-3. 당신은 어떻게 그것의 pH 를 계산합니까?
약산을 함유하는 임의의 용액에서,이온화되지 않은 산과 그 이온 사이에 평형이있다. 그래서 예 ethanoic 산,당신은 균형
![]()
![]()
의 존재 ethanoate 온에서 나트륨 ethanoate 이 이동 평형을 남아 있지만,평형은 여전히 존재합니다.
즉,평형 상수,Ka 를 쓸 수 있습니다.:
![]()
![]()
어디에 당신이 계산을 수행이 방정식을 사용하여 이전에 약산,당신은 것으로 가정 농도의 수소이온과 ethanoate 온도 동일하게 적용되었습니다. 분열하는 에탄 산의 모든 분자는 각 종류의 이온 중 하나를 제공합니다.
버퍼 솔루션에 대해서는 더 이상 사실이 아닙니다:
![]()
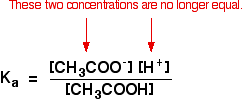
경우에는 균형있 밀어 더욱이,왼쪽에있는 수 ethanoate 온에서 나오는 ethanoic 산이 완전히 무시할 이들에 비해서 나트륨 ethanoate.
그러므로 우리는다고 가정 ethanoate 이온의 농도와 같은 농도의 나트륨 ethanoate,이 경우 0.20mol dm-3.
에서 약한 산성 계산에,우리는 일반적으로 추측하는 이렇게 약간의 산에는 이온화는 농도의 산에서 평형과 같은 농도의 산 우리가 사용됩니다. 평형이 더욱 왼쪽으로 이동했다는 것은 이제 더욱 사실입니다.
그래서 우리는 버퍼 솔루션습니다:
![]()
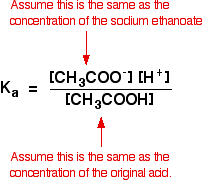
경우,지금 우리가 알고있는 가치에 대한 Ka,우리가 계산할 수 있습니다 수소이온 농도를 따라서 pH.
Ka ethanoic 산 1.74×10-5mol dm-3.
기억 우리가 원하는 것을 계산하의 pH 완충액을 포함하는 0.10mol dm-3 의 ethanoic 산 및 0.20mol dm-3 의 나트륨 ethanoate.
![]()
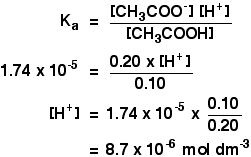
그 다음 당신이해야 할 모든 것을 찾을 사용하여 pH 식
pH=-log10
당신은 여전히 가치에 대한 수소이온 농도에서,계산기 그래서 로그 버튼을 누르면을 무시하고 부정적인 기호(을 허용하는 마이너스 등에서 pH expression).
두 가지 중요한 수치에 5.1 의 답을 얻어야합니다. 당신의 농도는 단지 두 가지 수치에만 주어 졌기 때문에 이것보다 더 정확할 수는 없습니다.