소개
몇 년 동안 Aeromonas spp 의 중요성. 으로,인간의 설사를 일으키는 에이전트이었다 논란의 여러가지 연구에 증명하는 병원성 메커니즘의 Aeromonas 은 인성이 많기 때문에 독성 요인은 참여의 생산을 포함,cytotoxins(카스트로-Escarpulli et al., 2002, 2003). 이 독소는 설사 또는 출혈성 대장염을 일으킬 수 있으며 용혈성 요독 증후군(HUS)및 TTP 발달에 중요한 역할을 할 수 있습니다(Bogdanović et al.,1991;팡 외.,1999;Monforte-Cirac 외., 2010).
이러한 질병에 연루된 세포 독소에는 시가 독소와 밀접한 관련이있는 Stx 가 포함됩니다. Stx 변이체는 Shigella,Enterobacter,Citrobacter,Acinetobacter,Campylobacter 및 Hamiltonella 박테리아 종(Mauro and Koudelka,2011)에서 발현된다. Alperi 와 Figueras(2010)는 Aeromonas spp 의 임상 분리 물에서 Stx1 과 Stx2 의 존재를 기술했다. 위장염,출혈성 대장염 및 후스와 관련이 있습니다. 이러한 독소를 코딩하는 유전자는이 균주를 분해하는 상이한 람도 이드 박테리오파지에 위치한다. 또한,Aeromonas 속에는 OMVs 라는 제로 분비 시스템이 있습니다. OMVs 이 될 수 있을 의미하는 몇몇 단백질,RNA,periplasmic 공간 구성 요소와 다른 구성 요소와 관련된 독성,전송될 수 있습니다로 다른 장군;따라서,그것은 믿고 OMVs 에서 중요한 역할을 pathogenicity(Guerrero-Mandujano et al.,2015a,b).
이러한 이유로,이 연구의 목표를 평가하는 손해에 의해 발생한 생산의 Stx 중공업이 발전 사업자들에 의해 균주에서 고립 멕시코시티에 자녀 베로 셀의 문화.
재료 및 방법
균주
본 연구에는 INP 로부터 66 개의 임상 분리 물,장에서 얻은 54 개 및 여분의 장 감염에서 얻은 12 개가 포함되었다. 종자 고립되었에서 얻은 표본에 대한 일상 시험에서 언급하는 병원에 따라서,동의 필요에 부모 또는 법적 보호자의 아이들이다. 모든 균주는 16s rDNA-RFLP 에 의해 유 전적으로 확인되었다(Hernández-Cortez et al., 2011). 입력된 변형에 대한 Escherichia coli O157:H7CECT4076 로 사용되었다는 긍정적인 제어 및 대장균 K12 변형(5512ENCB)의 컬렉션에서 의료 세균학 연구실(Escuela Nacional de Ciencias Biologicas,IPN)로 사용되었다는 부정적인 통제에 대한 독소 생산입니다. 의 긴장이 유지되었다 짧은 기간 동안 상온에서 혈액에 agar 기반으로 기울입니다;이상 저장,그들이 하나 냉동에 -70°C 에서 20%(w/v)글리세롤 토드-Hewitt 국물(Oxoid,멕시코)또는 동결건조에서 7.5%말 포도당 혈청.
DNA 를 추출
모든 문화들에서 재배간의 혈 청 다차원 콩 agar30°C18h. The genomic DNA 의 각 변형이었을 통해 얻은 InstaGene 매트릭스(된®,멕시코)의 지침에 따르면 제조업체에서 제공. DNA 순도 및 양은 Ampli Quant AQ-07 분광 광도계를 사용하여 결정되었다. DNA 는 사용할 때까지 -20℃에서 저장되었다.
stx1 및 stx2PCR 증폭
의 존재 stx1 및 stx2 에서의 DNA 를 OMVs 및 genomic DNA 이 검색되었으로 단일 PCR 반응을 사용하여 프라이머 STX1F/STX1R 및 STXF/STXR 로 144 217bp 제품,각각이 프라이머 설계되었 시퀀스에 따라 소 단위 A. 프라이머,반응,증폭 조건에 처리되었으로 이전에 의해 설명 에르난데스-코르테즈 et al. (2013),양성(대장균 O157:H7)및 음성(대장균 K12)대조군.
DNA 시퀀싱
중합효소 연쇄 반응은 제품이 정화되었을 사용하여 PureLink 빠른 젤 추출 키트(Invitrogen®,멕시코)에 따르면 제조업체의 지침에. 제품을 직접 순서에 ABI-프리즘 310 유전 분석기(Applied Biosystems,Foster City,CA,미국)사용하여 정방향 및 역방향 사용되는 프라이머를 PCR,제조업체의 지침에 따라. 시퀀싱은 Unam(멕시코)의 Instituto de Biología 에서 수행되었습니다. 서열 분석은 국립 생명 공학 정보 센터(Ncbi)가 제공 한 기본 지역 정렬 검색 도구(BLAST)로 수행되었습니다.
마이크로플레이트 베로 세포 준비
이 절차에서 수행되었 96-well microplates 에 Vero(ATCC CCL81)세포 단층 80%를 가진 합류를 추가,최소한의 필수적인 중소(MEM;생체외®,멕시코)로 보충 10%v/v 태아 소럼(FBS;생체외®,멕시코).
세포 현탁액을 균질화하고 Neubauer 챔버를 사용하여 105-106 세포/mL 로 조정 하였다. 조정 후,현탁액을 200-μl 웰에 침착시켰다. 마이크로 플레이트를 24 시간 동안 5%CO2 하에서 37°c 에서 배양 하였다(CO2 인큐베이터,VWR Scientific,USA)(Giono-Cerezo et al., 1994).
셀 무료 세균 준비
다섯 식민지로서 각 혈액 agar plate 었 접종으로 3mL 의 크레이그 중간(0.4%효모추출물,3%casamino 산,0.05%K2HPO4). 이들은 37°C 에서 24h 동안 배양되었고 사용 된 세균 배양의 광학 밀도는 600nm 에서 0.25 이었다. 셀 무료비에 의해 만들어졌 centrifuging 문화에 14,000g10 분에서 4°C,다음의 여과 상등액을 통해서 멤브레인 필터(구멍 크기 0.45pm,사토리 Minisart NML). 셀 무료 supernatants 저장되었 20°C 에서의 총 66 셀 무료 세균 준비를 얻을 수 있었 이러한 방식으로 긍정적인 제어(E.coli O157:H7)및 부정적인 제어(E.coli K12)얻었다 또한 같은 방법으로(지오노-세레 소 et al., 1994).
Cytotoxic 분석 및 LD50 결정
셀 무료 여과물(20µL)었 접종으로 우물을 포함하는 세포 그리고 각각의 성장 매체없이 항생제입니다. 접종 된 세포를 5%CO2 로 37°C 에서 96h 동안 배양하고 반전 현미경에서 24h 마다 관찰 하였다. 세포 독성 효과가 나타날 것으로 예상대로 반올림하고 수축의 세포와 함께 두꺼운 립하고,마지막으로,진취적이고 돌이킬 수 없는 파괴의 단층. 모든 시험은 중복으로 수행되었다;MEM 과 Craig medium 을 사용한 생존력 대조군도 수행되었다(Giono-Cerezo et al., 1994).
Ld50 은 Vero 세포에서 세포 독성 손상을 일으키는 양성으로 검출 된 Aeromonas 균주에서 결정되었다. Vero 세포를 갖는 표준 96-웰 마이크로 플레이트는 2.6 에 지시 된대로 제조되었지만,배지는 1%BFS 로 100μl 의 MEM 으로 변경되었다. 이 제제는 100μl 의 세포없는 박테리아 제제에 노출되었고,직렬 희석은 플레이트의 전체 행에서 수행되었다. 5%CO2 로 37°C 에서 24h 의 배양 후,거꾸로 된 현미경으로 LD50 을 결정 하였다. Ld50 은 베로 세포의 50%가 손상되고 50%가 손상되지 않은 우물에 할당되었다(Marques et al., 1986).
봉쇄와 독소 중립화 분석
독소 중립화 분석 결과에서 수행된 균주는 세포 독성을 유발한 손상에 베로 세포이기 때문에 손상을 나타내는 Stx. 이 시험을 위해,각 세포없는 박테리아 제제의 LD50 과 90-100%의 합류로 성장한 Vero 세포로 마이크로 플레이트를 제조 하였다. 을 수행하는 중화 분석 결과를 보여 세포의 손상으로 제작의 결과 Stx 조치,두 단일 클론항체(Universidad Nacional Autónoma de México)에서 얻을 수 E.coli O157:H7 사용되었습니다.
각 Ab 는 브래드포드 단백질 정량에 따라 수행되었다 제조업체의 지침(된)결과의 78.2 및 74.8µg/μl,각각의 반대로 Stx1 및 anti-Stx2A. 집중 Ab 일했고 두 배의 희석 Ab. 그런 다음,10µL Ab(anti-STX1 또는 반대로 STX2)was incubated190µL 의 세포에는 무료 뜨는 농도에서의 LD50 1h37°C. 다음과 같은 이,200µL 의 후자 접종으로 베로세포에서의 90%에 합류 배양을 위해 24 시간 37°C5%CO2(Marques et al., 1986).
OMVs 조달 및 OMVs
외막 소포로부터의 DNA 추출은 Aeromonas hydrophila F-0050 으로부터 수득되었다. 프로토콜은 Guerrero-Mandujano et al.에 의해 이전에 기술 된 바와 같이 수행되었다. (2015a).
OMVs 의 DNA 는 제조자가 제공 한 지침에 따라 InstaGene Matrix(BioRad®,Mexico)를 통해 얻어졌다. 이어서,OMVs 의 DNA 를 DNA 추출 페놀-클로로포름 기술로 정제 하였다(Guerrero-Mandujano et al.,2015b).
결과
stx1 및 stx2 유전자 PCR 증폭
중합효소 연쇄 반응의 심사 66 임상 Aeromonas 긴장이 나타났 22/66(33.3%)균주를 포함 stx1 유전자,42/66(63.6%)긴장이 모두 포함하는 유전자,아 균주를 포함 stx2 유전자,그리고 2/66(3%)균주들에 대한 부정적인 모두 유전자가 있습니다.
DNA 시퀀싱
BLASTn 분석은 e.coli O157:H7 의 stx-1/stx-2 유전자와 Aeromonas spp 의 amplicon 사이에서 79~99%의 유사성과 3e-16/2e-97 의 기대 값을 나타냈다.,균주.
Cytotoxic 분석 및 LD50 결정
세포 독성 테스트에서 수행되 베로 셀 문화를 보여주었 17/66(25.7%)셀룰라이-무료 세균 준비해 발생하는 세포 독성 손상,제안 생산의 활성 Stx(그림 1)에 의해 밝혀 특성에 의해 손상이 발생 Stx.
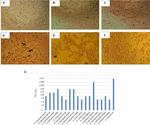
그림 1. Vero 세포 배양에서 수행 된 세포 독성 분석 및 LD50 결정. (A)최소한의 필수 배지를 갖는 베로 세포 배양(생존력 시험). (B)크레이그 배지를 이용한 베로 세포 배양(생존력 시험). (C)대장균 K12 로 음성 대조군. (D)대장균 O157:H7 로 양성 대조군,세포 단층의 파괴 및”오래된 레이스”효과에 의해 세포 독성 손상이 표시됩니다(화살표). (E)A.hydrophila F-0050 균주의 세포 독성 손상. (F)A.caviae421423 균주의 세포 독성 손상. (G)모든 균주의 Ld50 역가의 그래픽 표현.
결과를 결정하기 위한 LD50 가 다음과 같다:6 월 17 일(35.2%)셀룰라이-무료 세균 준비를 제시하는 역가의 1:16 일;5/17(29.4%)셀룰라이-무료 세균 준비를 묘사하는 역가의 1:8;3/17(17.6%)셀룰라이-무료 세균 준비했다가 1:64;2/17(11.7%)셀룰라이-무료 세균 준비와 역가의 1:32;및 1/17(5.8%) 셀 무료 세균 준비와 역가의 1:256(그림 1G).
독소 중화
11/17(64.7%)균주에 손상을 세포에서 상층액을 완전히 저해서 39.1µg/μl Ab 농도;에 4/17(23.5%)셀룰라이-무료 세균 준비를 감소,셀룰라 손상이 관찰되었에서 동일한 농도에 2/17(11.7%)셀룰라이-무료 세균 준비,셀룰라 손상이 완전히 저해 농도에서 78.2µg/μl. 를 사용하는 Ab anti-STX2 것으로 나타났 9/17(52.9%)셀룰라이-무료 세균 준비,셀룰라 손상을 완전히 저해서 37.4µg/μl,그리고 6 월 17 일(35.2%)셀룰라이-무료 세균 준비를 감소를 보였 셀룰라 손상에서 동일한 농도에 2/17(11.7%)무 세포 세균 제제,세포 손상은 74.8μg/μl 의 Ab 농도로 완전히 억제되었다(그림 2 및 3).

그림 2. Aeromonas spp 의 세포가없는 박테리아 제제에 의한 Vero 세포 배양에서 유도 된 세포 독성 효과의 억제. stx1 또는 stx2 유전자를 지닌 균주.
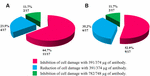
그림 3. 세포 손상의 억제 또는 감소를 보인 균주의 백분율. (A)anti-Stx1Ab 로 중화. (B)anti-Stx2Ab 로 중화.
stx1 유전자 PCR 증폭에서 OMVs
중합효소 연쇄 반응의 OMVs’DNA A.hydrophila F-0050 밝혔 OMVs 포함 gen stx1;따라서,OMVs 될 수 있는 잠재적인 차량에 대한 수평 독성 유전자 전송(그림 4).
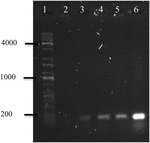
그림 4. OMVs 의 DNA 에서 stx1 유전자 증폭의 일렉트로 페로 그램. (1)Kapa 범용 사다리,(2)음성 대조군,(3)A.hydrophila F-0050 의 OMVs,(4)A.hydrophila F-0050,(5)E.coli O157 의 OMVs:H7,및(6)대장균 O157:H7.
토론
Stx 의 생산자로서 Aeromonas 속은 주로 소아 환자에서 설사를 일으키는 응급 병원체가 될 수 있습니다(Hernández-Cortez et al.,2011;Figueras 와 Baez-Hidalgo,2014). 그럼에도 불구하고,이 속은 HUS 를 일으키는 병원체이기 때문에 의료 분야에서 더 관련성이 높아졌습니다(San Joaquín and Pickett,1988;Bogdanović et al.,1991;롭슨 외.,1992;팡 외.,1999;Monforte-Cirac 외., 2010).
본 연구에서 우리는 stx1 과 stx2 유전자의 PCR 증폭에 의해 22/66(33.3%)의 aeromonad 균주를 포함 stx1 유전자,42/66(63.6%)긴장이 모두 포함하는 유전자,아이 균주를 포함하는 stx2 혼자입니다. 이 이어질 수 있습니다 우리에게 제안하는 것이 유전자에 널리 퍼 Aeromonas 균주에서 고립된 소아환자 및 이러한 환자에 대한 위험에 노출 될 수 있습니다 개발이 있습니다.
단 하나의 이전 보고서에서는 stx 유전자가에서 공부 Aeromonas 균주에서 분리 된 다른 병원에서는 스페인;얻은 결과는 19/80(23.7%)균주했 stx1 유전자 및 단 1/80(1.25%)균주는 두 유전자 모두에 양성이었다(Alperi and Figueras,2010). 이러한 결과 전달을 더 많이 분포의 유전자에서 멕시코 균주,그러나,우리는 계정으로는,스페인,Aeromonas 속이려 위장 병원체를 정기적으로 절연 가진 환자에 있는 위장 프로필,따라서 적절한 치료가 주어진 직면하는 이습니다.
멕시코에서는이 속이 설사를 일으키는 병원균 목록에 포함되어 있지 않으며 일상적으로 분리되지 않습니다; 결과적으로 어렵게 처리와 좋은 삶의 질을 환자;또한,기에 대한 통계적 유행. 또한,속이 더 관련성으로 인해 사회 경제적 조건에 멕시코 인구,포함하는 물 부족;이것을 용이하게 전송의 가능성을 증가시킨 HUS 되는 공중 건강 문제입니다.
amplicons 의 시퀀싱을 수행하고 Blast search 를 수행했는데,이는 E.coli O157:H7 과 비교하여 79-99%의 유사성 및 유전자 stx1/stx2 사이의 3e-16/2e-97 의 기대 값을 나타냈다.
Ld50 은 Vero 세포 배양에서 세포 독성 손상을 평가하기로 결정되었다;이 매개 변수와 Marques et al. (1986),균주는 낮은(2×101~6×102),중간(103-104)및 높은(105-108)생산으로 그룹화 할 수 있습니다(그림 1G). 마르케스 외. (1986)실시한 연구에서 그들이 만든 비슷한 분석 결과는 현재 연구,하지만 서로 다른 종자의 까지,그들은 획득하는 262/400(63%)균주에 분류되었으로 낮은 Stx 생산자,그리고 48%세포 독성 생산 손상; 그럼에도 불구하고,이들 균주의 40%에서 항-Stx 항체로 세포 독성 손상이 억제되었다.
현재의 연구에서,25.7%의 박테리아 무료 준비해 발생하는 세포 독성 손해의 특성 Stx 베로세포,제안 생산의 활성 Stx 모든 Aeromonas 균주로 분류되었 저렴한 생산자의 Stx 그러나,50-70%세포의 무 supernatants,셀룰러 손상되었을 저해 하고의 20~30%무세포 supernatants 셀룰러한 손상 감소 하였다(그림 3). 셀 무료 supernatants 는 셀룰러한 손상 감소했이 있었기 때문에 두 개에서 독재에서 쏟고,따라서 그들은 다른 immunologically,Stx 수 없습이 완전히 억제 및 셀룰러한 손상 유지(Marques et al., 1986).
이전의 두 연구(Haque et al.,1996;Alperi 및 Figueras,2010)은 각각 Stx1-생산 Aeromonas 균주의 10.2%및 10.53%를 얻었다. 는 이유에 대해 높은 비율의 Aeromonas 변종 생산 active Stx 수 있으로 인해 높은 가용성의 Stx 박테리오파지 내부의 문화로 까지 변종의 캐 Stx 박테리오파지 고립되었습에서 도시 폐수 처리 식물,폐수서는 가축을 도살장과 의자(가르시아-Aljaro et al., 2004, 2009). 마찬가지로 전달 연구가 수행되었습니다 in vivo 와 Stx 페이지에서 대장균할 수 있는 감염 장 microbiota 박테리아를 제공,toxigenic 특성을 균주는 감염되지 않기(애치슨 et al.,1998;슈미트 외.,1999;가마 지 외., 2003). 같은 일이 일어날 수 있으로 속 Aeromonas 때 유도하기 위장 프로파일한다는 사실 속 Aeromonas 이 있을 캡처 할 수있는 기능을 통합 독성 요소의 게놈에,그리고 이들 중 하나 Stx-encoding 유전자입니다.
나머지 긴장의 발생 cytotonic 손상에 셀,아마도 제안의 생산 다른 독소로 다른 것보다 단지 실현의 꿈을 이루기 때문 Aeromonas 속 생산할 수있는 두 개의 cytotonic 한 독소,내열성(AST)및 thermolabile(ALT)(피게하고 바에즈-Hidalgo,2014 년),을 일으킬 수 있는 cytotonic 손상에 베로세포; 또 다른 가능성은 Aeromonas 균주에 있는 하나 이상의 박테리오파지에 삽입된 그들의 게놈으로 입증되었는 까지 긴장과 함께 두 번 lysogeny 할 수 있을 조절하는 bacteriophages 을 억제의 용량이 용균성기 감응작용,결과의 감소 Stx 생산을 잃지 않고 유전자(가르시아-Aljaro et al.,2004;Imamovic and Muniesa,2011). 따라서,그것은 필요한을 설정하는 방법은 많은 박테리오파지 Aeromonas 종자 포함,포함하여 현재에서의 연구를 할 수 있도록,상관 관계를 존재 Stx 살균소와 양을 생산의 Stx.
반면에,유도 성 Aeromonas 에서 Stx 박테리오파지의 존재는 stx 유전자의 수평 전달 메커니즘을 나타내지 만 유일한 것은 아닙니다. 보다 최근의 연구에서,Aeromonas 가 OMVs 를 생산할 수 있다고 결정되었다(Guerrero-Mandujano et al.,2015a)및 이들 Omv 는 통합 DNA 를 수송 할 수있다(Guerrero-Mandujano et al.,2015b). 현재 연구에서,우리는 증폭 stx1 유전자에서 DNA 를 추출한에서 OMVs 의 한 A.hydrophila 변형의 임상 원산지를 유발 cytotoxic 손상에 베로세포,그리고 이러한 손상되었을 저해 anti-Stx 체입니다. 이는 Stx 박테리오파지가 전송 메커니즘의 stx 유전자;또한,OMVs 그리고 최근 이라고 전송 시스템 유형 0 할 수 있의 확산 stx 유전자 종간나 공략. 그럼에도 불구하고 OMVs 에 포함 된 유전자가 완전한지 확인하는 것이 필요합니다. 이 연구에서 얻은 결과는 stx 유전자가 OMVs 를 통해 전달 될 수있는 Aeromonas 의 또 다른 putative virulence factor 라는 가설을 뒷받침합니다. 그것은 stx 유전자를 다른 Aeromonas 균주 및/또는 다른 박테리아 속으로의 수평 수송을위한 또 다른 메커니즘을 나타낼 수있다.
이러한 이유로,이 속에 포함되어야 가능한 한 원인이 되는 에이전트의 위장하려고 할 때 식별이의 인과 에이전트 및 보고되어야 한 일환으로 표준의 건강 감시 절차가 있습니다.
저자는 기여금
IP-M AG-M 수행한 실험 및 MR-R 수행한 생물정보학 분석하고 초안을 작성한 원고;CH-C 디자인 프라이머;VB-G,JM-L 비판적으로 논평하고 수정 원고를;GC-E 잉태,연구에 참여의 디자인 및 조화,평가는 데이터와 초안문입니다. 모든 저자는 최종 원고를 읽고 승인했습니다. 원고의 스타일을 친절하게 수정해 주신 Sofia Marteli Mulia 에게 감사드립니다.
자금 조달
GC-E 와 VB-G 는 Estímulos al Desempeño en Investigación 과 Comisión y Fomento de Actividades Académicas(Instituto Politécnico Nacional)와 Sistema Nacional de Investigadores(SNI,CONACyT)로부터 지원을 받았다. 이 연구는 국립 폴리 테크닉 연구소(sip20160609)의 연구 및 대학원 사무국이 자금을 지원했습니다. SIP-IPN 지 개발에 참여의 연구,디자인,수집,분석,해석의 데이터에 서면으로 보고도 의사 결정에 제출하는지에 대한 출판물이다. IP-M 과 AG-m 은 CONACyT 와 BEIFI 에서 장학금을 받았습니다.
이해의 충돌 문
저자가 선언하는 연구가 수행되었의 부재에서 어떠한 상업 또는 금융 서비스를 제공하는 것으로 해석될 수 있는 잠재적인 이해의 충돌.
승인
우리는 균주 분리 물을 제공 한 Patricia Arzate Barbosa 박사와 단클론 항체를 제공 한 Armando Navarro 박사에게 감사드립니다.
약어
Ab,항체;HUS,용혈성 요독 증후군;INP,Instituto Nacional de Pediatria 멕시코;LD50,중간 치사량; OMVs, Outer membrane vesicles; PCR, Polymerase chain reaction; STEC, Shiga toxin-producing E. coli; Stx, Shiga-like toxin; TTP, Thrombotic thrombocytopenic purpura.
Acheson, D. W., Reidl, J., Zhang, X., Keusch, G. T., Mekalanos, J. J., and Waldor, M. K. (1998). In vivo transduction with shiga toxin 1-encoding phage. Infect. Immun. 66, 4496–4498.
Google Scholar
Alperi, A., and Figueras, M. J. (2010). Aeromonas 보유 시가 독소 유전자의 인간 분리 물은(stx1 및 stx2)대장균의 다리 악성 유전자 변이체와 매우 유사합니다. 클린입니다. 마이크로 바이올. 감염. 16, 1563-1567. 도이:10.1111/j.1469-0691.2010.03203.x
CrossRef 전체 텍스트|Google 학자
Bogdanovic,R.,Čobeljić,M.,Markovic,M.,Nikolic,V.,Ognjanovic,M.,Sarjanovic,L.,et al. (1991). Aeromonas hydrophila enterocolitis 와 관련된 Haemolytic-uraemic 증후군. 소아과. 네프롤. 5, 293-295. 도이:10.1007
CrossRef 전체 텍스트|Google Scholar
Castro-Escarpulli,G.,Aguilera-Arreola,M.G.,Giono-Cerezo,S.,Hernández-Rodríguez,C.H.,Rodriguez-Chacon,M.,Soler,F.L.,et al. (2002). Aeromonas 속>멕시코의 중요한 병원체? 엔프. 인펙. 마이크. 22, 206–216.
Google Scholar
Castro-Escarpulli,G.,Figueras,M.J.,Aguilera-Arreola,M.G.,Soler,L.,Fernández-Rendón,E.,Aparicio,G.O.,et al. (2003). Aeromonas spp 의 특성. 멕시코에서 인간의 소비를 목적으로하는 냉동 생선에서 격리됩니다. Int. J. 식품 마이크로 바이올. 84, 41–49. 쩔짤쨌짱쨘째쩍 짹쨍쨌짹쨍 쨉챨철쨌 32 짹챈 30,13 첸 쩔짙쩔징징쩔짙째챠쨉쨉()째챠째쨈쩌쩐(1688-7662)째챠째쨈쨈 쨔짰쨩챌쨘(1688)째챠째쨈쨈 쨔짰쨩챌쨘(1688)째챠째쨈쨈 쨔짰쨩챌쨘(1688)째챠째쨈쨈. Aeromonas hydrophila enterocolitis 를 가진 성인 남성에서 Haemolytic-ureaemic 증후군. 네프롤. 다이얼. 이식. 14, 439–440. doi:10.1093/ndt/14.2.439
CrossRef 전체 텍스트|Google Scholar
Figueras,M.J.,및 Baez-Hidalgo,R.(2014). “Aeromonas,”식품 미생물학 백과 사전,eds C.A.Batt 및 M.L.Tortorello(Cambridge,MA:Academic Press),24-30.
Gamage,S.D.,스트라,J.E.,Chalk,C.L.,그리고 Weiss,A.(2003). 비병원성 대장균은 시가 독소의 생산에 기여할 수있다. 감염. 임문. 71, 3107–3115. 도이:10.1128/아이아이.71.6.3107-3115.2003
CrossRef 전체 텍스트|Google 학술검색
가르시아-Aljaro,C.,Muniesa,M.,Jofre,J.,그리고 희게,A.R.(2004). 수생 환경에서 대장균 개체군에서 stx2 유전자의 유행. 아플. 에비론. 마이크로 바이올. 70, 3535–3540. doi:10.1128/AEM.70.6.3535-3540.2004
CrossRef 전체 텍스트|Google 학술검색
가르시아-Aljaro,C.,Muniesa,M.,Jofre,J.,그리고 희게,A.R.(2009). 환경 대장균 균주로부터 유도 된 stx2 운반 박테리오파지 사이의 유전형 및 표현형 다양성. 아플. 에비론. 마이크로 바이올. 75, 329–336. doi:10.1128/AEM.01367-08
CrossRef 전체 텍스트/Google Scholar
Giono-Cerezo,S.,Rodríguez-Ángeles,M.G.,Rodríguez-Cadena,M.J.,및 Valdespino-Gómez,J.L.(1994). 베로 세포 배양 및 고체상 혼성화(콜로니 블롯)에 의한 대장균의 장 독소 및 세포 독소의 확인. 목사 라티노암. 마이크로 바이올. 36, 231–241.
Google Scholar
Guerrero-Mandujano,A.,López-Villegas,E.O.,Longa-Briseño,A.,및 Castro-Escarpulli,G.(2015a). Aeromonas hydrophila 의 임상 변형에서 외막 소포의 생산. 적능력 마이크로 바이올. 1, 113–117.
Google Scholar
Guerrero-Mandujano,A.,Palma-Martínez,I.,및 Castro-Escarpulli,G.(2015b). Aeromonas hydrophila 의 외막 소포에 의한 dna 수송. 적능력 마이크로 바이올. 2, 354–357.
Google Scholar
Haque,Q.M.,Sugiyama,A.,Iwade,Y.,Midorikawa,Y.,및 Yamauchi,T.(1996). Aeromonas spp 의 설사와 환경 분리. 시가 유사 독소 1 과 유사한 독소를 생성합니다. 커르. 마이크로 바이올. 32, 239–245. doi:10.1007/s002849900043
CrossRef 전체 텍스트|Google Scholar
Hernández-Cortez,C.,Aguilera-Arreola,M.G.,Chávez-Méndez,Y.,Arzate-Barbosa,P.,Lara-Hernandez,A.,및 Castro-Escarpulli,G.(2011). Aeromonas spp 의 균주의 유전 적 식별. 소아과 국립 연구소에서 격리되었습니다. 레브 엔퍼. Infecc. 소아과. 24, 157–165.
Google Scholar
Hernández-Cortez,C.,Méndez-Tenorio,A.,Aguilera-Arreola,M.G.,및 Castro-Escarpulli,G. (2013). 위장병을 일으키는 박테리아를 검출하기위한 4 가지 멀티 플렉스 중합 효소 연쇄 반응의 설계 및 표준화. Afr. 제이 마이크로 바이올. 레스.7,2673-2681. doi:10.5897/AJMR2013.5452
CrossRef 전체 텍스트|Google Scholar
Imamovic,L.,및 Muniesa,M.(2011). 쇠고기 및 샐러드에서 시가 독소 인코딩 박테리오파지의 감염성의 정량화 및 평가. 아플. 에비론. 마이크로 바이올. 77, 3536–3540. doi:10.1128/AEM.나는 이것이 내가하는 일이 아니라는 것을 알고 싶다. 그러나,이 경우,그 중 어느 것이 더 나은지 이해해야합니다. 대장균에 의한 시가 유사 독소 생산. J. 감염. 디스. 154, 338–341. doi:10.1093/infdis/154.2.338
CrossRef 전체 텍스트|Google Scholar
Mauro,S.A. 및 Koudelka,G.B.(2011). 시가 독소:표현,분포 및 환경에서의 역할. 독소 3,608-625. doi:10.3390/toxins3060608
CrossRef 전체 텍스트|Google Scholar
Monforte-Cirac,M.L.,Palacian-Ruiz,M.P.,Aisa-Iriarte,M.L.,및 Espuelas-Monge,M.(2010). Aeromonas 에 의한 용혈성 요독 증후군:임상 사례에 대해. 레브 클린. 정신. 210, 206–207. 도이:10.1016/j.cer.2009.08.002
CrossRef 전체 텍스트/Google 학술검색
Robson,W.L.M.,양조위,A.K.C. 및 Trevenen,C.L.(1992). Aeromonas hydrophila enterocolitis 와 관련된 Haemolytic-uraemic 증후군. 소아과. 네프롤. 6, 221–222. 쨈챘짹쨀째쩔징 쨈챘쩔짤 쨘쨍쨀쨩쩔챘짹쨀째쩔징 쨈챘쩔짤 쨘쨍쨀쨩쩔챘짹쨀째쩔징 쨈챘쩔짤 쨘쨍쨀쨩쩔챘짹쨀째쩔징 쨈챘쩔짤 쨘쨍쨀쨩쩔챘짹쨀째쩔징 쨈챘쩔짤 쨘쨍쨈쨈. 어린이의 아에로모나스 관련 위장염. 소아과. 감염. 디스. 제이 7,53-57. doi:10.1097/00006454-198801000-00013
CrossRef 전체 텍스트|Google Scholar
Schmidt,H.,Bielaszewska,M.,및 Karch,H.(1999). 대장균 o157 에서 분리 된 시가 독소 2 인코딩 박테리오파지 f3538 의 유도체로 장내 대장균 분리 형질 전환:H7. 아플. 에비론. 마이크로 바이올. 65, 3855–3861.
Google Scholar