소개
전기 절연의 폐동맥(PV)초석이의 카테터를 제거하기 위한 전략을 발작성 심방 세동 및 영구(AF). 현재 사용할 수 있는 에너지 형식과 같은 고주파,cryotherapy,레이저 기반 PV 격리(PVI)에 의해 제한됩니다 장기적인 PV 다시 연결 속도,최고의 범위에서 22%38%로,1,2 다른 연구와 보고의 요금으로 높은 62.5%.3 난방 조직(고주파 열치)또는 동결(cryotherapy),두 개의 가장 일반적으로 사용되는 방법,절제 조직에 반하여 무분별하게 구별 없이 조직의 비행기가 있습니다. 따라서,이러한 에너지 자원과 관련된 부수적 피해와 같은 횡격막 신경 및 손상 식도 포함하여,지칠대로 지친 심방 식도 루. 또한,카테터 절제는 PV 협착,스팀 팝 및 색전 성 뇌졸중의 위험과 같은 다른 합병증과 관련 될 수 있습니다.4,5 이러한 안전 한계는 유감스럽게도 af 재발에 대한 알려진 메커니즘 인 일관된 병변 transmurality 의 결여에 의해 악화된다.6 따라서,매우 효과적일뿐만 아니라 매우 안전한 융제 전략에 대한 시급한 필요성이있었습니다.
Pulsed field ablation(Pfa)은 수년 동안 유전자 electrotransfer 및 고체 장기 종양 절제 모두에 활용 된 비열 에너지 양식입니다.7,8 더 최근에,연구자가 증명하는 독특한 안전 단면도와 융제 효과 관련된 그것의 기능을 선택적으로 대상 cardiomyocytes 면서 살려주는 담보 조직입니다. 이것은 pfa 를 심장 절제 용 새로운 에너지 원으로 스포트라이트로 밀어 넣었습니다.
기초의 PFA
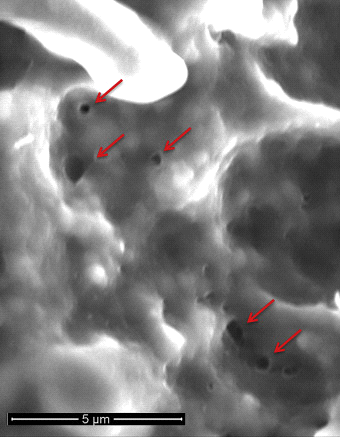
PFA 는 광범위하게 개념을 기반으로 직류의 제거를 사용한 간단히에서 1980 년대 이전 가용성 고주파의 에너지입니다.4 특히,PFA 을 포함한 급속한(초단위)응용 프로그램의 간헐적 인 강도 높은 전기 펄스를 생성하는 전기 분야에서 세포막의 지질 bilayer 을 만드는 나노공(electroporation)에서 세포막의(그림 1). 용어 뒤집을 수 있 전기충격법을 참조하 non-영원한 구멍이 형성할 때 강도가 낮은 전기 분야를 초과하지 않는 대상 조직의 임계값이 적용됩니다. 다른 한편으로,돌이킬 수 없는 전기충격법의 창조를 영구적이 구멍을 때는 전기 분야를 초과하는 대상 조직의 임계값입니다. 이러한 영구적 인 기공은 세포 사멸에서 절정에 달하는 세포 함량 누출로 이어진다(그림 2). 아마도 가장 소중한 기능의 심장 PFA 는 심근 선택성,결과를 cardiomyocytes 낮은 전기장 임계 값(400V/㎝)의 모든 조직이 유형이 있다.4,5
림 1
림 1

림 2
림 2

PFA 기술
PFA 는 포괄적인 기간을 참조하는 스펙트럼의 펄스와 카테테르 디자인 특성이 있습니다. 이러한 기능은 pfa 의 효능 및 안전성 프로파일과 밀접한 관련이 있습니다. 중요한 임상 워크 플로우 암시가있는 PFA 의 한 가지 특징은 파형 설계입니다. 단상 파형은 전형적으로 상당한 근육 활성화를 유발하여 전신 마취 및 신경근 마비의 사용을 의무화합니다. 반대로,biphasic PFA 파형은 제한된 골격근 교전을 보여 주므로 마비제가 필요없이 임상 적으로 사용할 수 있습니다.9
허가자료인 전임상시험 자료를
전 임상 타당성 조사 실험 데이터에 PFA 으로 융제 치료에 대한 심근 조직되었 발생 지난 십 년간.심장 조직의 4,10-14PFA 병변은 특징적으로 균질하며 조직 비계 내에서 세포 외 매트릭스를 예비합니다.4 이것은 열 에너지 원으로 생성 된 무차별적이고 파괴적인 병변과는 대조적입니다. 에 관한 PFA 및 심방 조직,연구자들은 보이 완전히 녹 심근 소매 200 줄 단상 응용 프로그램에서는 돼지 PV ostia 없이 중요한 상처를 남기거나 확산의 내막과 탄성 lamina.11 중요한 것은,에도 불구하고 만들기 병변에서 PV 자체,PV 경 영향을 받지 않았는지,10,11 증명하는 PFAs 한 비 stenotic 융제 메커니즘이 있습니다. 심실 조직에서 PFA 는 병변 내 및 인접한 혈관 및 신경의 스페어 링으로 큰 병변을 만드는 것으로 나타났습니다.15 또한,PFA 는 식도에 pfa 를 의도적으로 적용 함에도 불구하고 식도 점막 및 점막하 층을 예비하는 것으로 나타났습니다.16,17PFA 는 또한 그 과정을 따라 여러 응용에도 불구하고 골상 신경을 손상시키지 않는 것으로 나타났습니다.18 이러한 중요한 발견은 PFA 가 심방 조직 절제에 매우 매력적으로 만드는 독특한 안전성 프로파일을 가지고 있음을 시사합니다. 위에서 언급 한 전임상 평가는 모두 단상 PFA 파형으로 수행되었습니다. 더 많은 최근의 임상 데이터와 함께 새로운 나아졌다 PFA 파형이 있는 격려되었음을 만들기 연속,균일하고,전층 심 병변을 달성하기 위해 관련 끝점 등의 튼튼한 PV 격리입니다.19 중요하게도,각 PFA 파형은 고유 한 실체로 간주되어야하며 상세한 전임상 안전성 및 효능 평가가 필요합니다.
임상 데이터
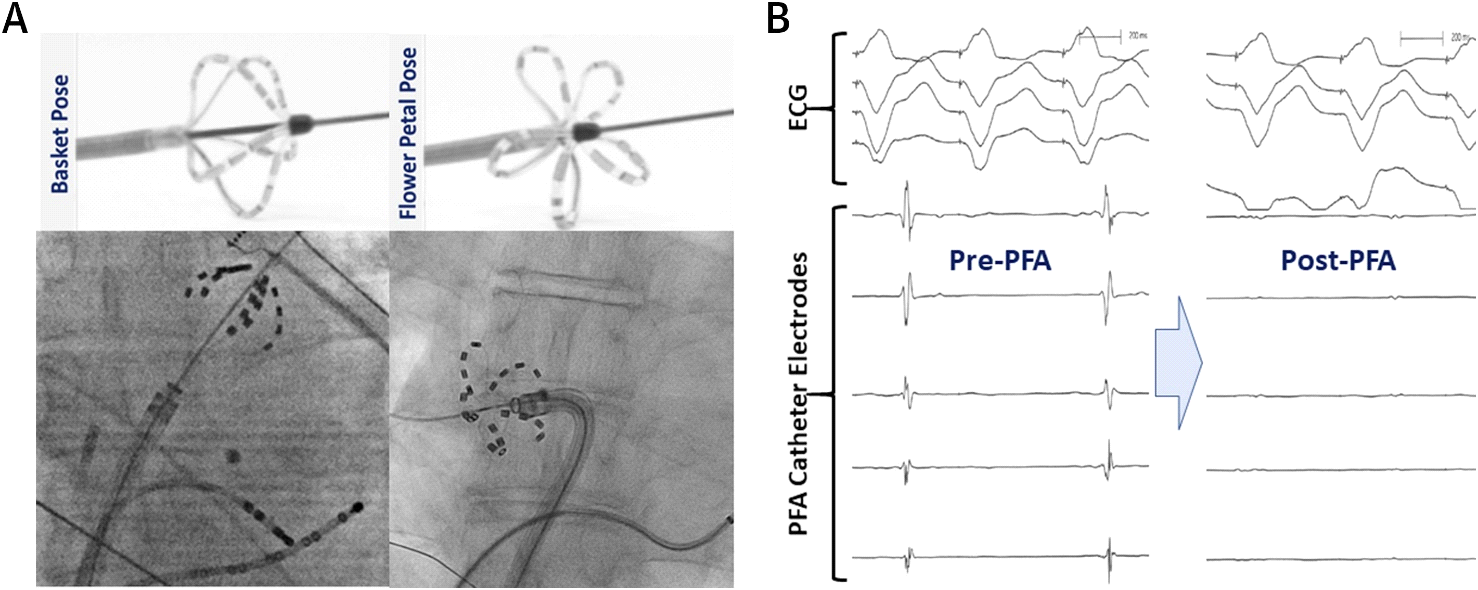
Reddy et al. 심내막 및 심 외막 PFA 모두에 대한 초기 급성 임상 경험을 최초로 기술 하였다. 그들은 af 환자에서 pfa 에 대한 공개 라벨,비랜드화 전향 적 연구를 수행했습니다.5 본 연구에서는 15 명의 환자에서 PV antra 에서 심내막 병변을 전달하기 위해 맞춤형 over-the-wire multispline PFA 카테터(FARAWAVE)를 사용했습니다. 이 심내 pfa 카테터에는 각각 4 개의 전극을 포함하는 5 개의 스플라인이 있으며 꽃 또는 바구니 구성 중 하나를 가정 할 수 있습니다. 이 설계는 원주 형 PV ostial 및 antral 커버리지를 허용합니다(그림 3). 또한,선형 PFA 테을 달성하기 위해 사용합 PVI 및 후방 왼쪽방 분리(자는 병변을 설정)7 추가적인 환자를 수반하는 심장 수술입니다. 단상 펄스 전압 파형은 본 연구에서 양극성 방식으로 전달되었다;따라서 모든 절차는 전신 마취하에 수행되었다. 심내 PVI 는 3.26±0.5 병변/PV 및<환자 당 60 초의 에너지 전달 시간을 가진 15 명의 환자(100%)모두에서 급성 성공적이었다. 상자 병변은 7 명의 환자 중 6 명(86%)에서 후벽을 분리하는 데 성공했다. 급성 안전성 프로파일은 절차 적 합병증없이 우수했다.
림 3
림 3

이후,동일한 그룹의 최근에 출판된 데이터에서 두 개의 금성의 임상 시험 카테터 기반 PFA 환자에서 발작성 AF.20 함께,이러한 시험을 등록 81 환자는 증상 발작성 AF 저항하는 항부정맥제 약물,심실 왼쪽 방출 분수>40%고로 왼쪽 심 anteroposterior 차원<5.5cm. PFA 펄스는 QRS 발병 직후에 동기화되었다. 독자적인 양극 PFA 파형들 중에 전달 단상(900-1000V 당 응용 프로그램을 초기의 경우)또는 나아졌다는 방식(1800-2000V 당 응용 프로그램은 대부분의 경우)를 사용하여 심장내 PFA 카테터(FARAWAVE). 급성 PVI 는 100%의 환자에서 달성되었습니다. 으로 인하여 밀리초 단위의 자연의 펄스,는 시간을 제공하는 데 필요한 에너지보다 더 3min/와 환자의 피부 절차의 시대 92.2±27.4min. 세월 PVI 내구성을 점진적으로 증가에서 18%과 함께 초기 단상 파형을 100%보다 최적화된 양극 파형에서 마지막 집단이 연구에서. 이 연구에서 12 개월 동안 부정맥으로부터의 추정 자유도는 87±5.6%였다.
에서는 안전 관점에서,하나의 절차-관련 pericardial 압전 보고되었지만,다른 부작용은 보고 이상 120 일 평균 기간. 내시경 검사는 29 명의 환자에서 절제 후 평균 3.4 일 동안 시행되었으며 식도 병변의 증거는 밝혀지지 않았다. 또한,8 환자 받 포스트 절차를 대비 향상된 심장 혈관 자기 공명 화상 진찰이 없 식도 향상되었는 지적에도 불구하고 증진의 왼쪽에 바로 인접 심 벽입니다. 이것은 PFA 로 식도 손상의 부족을 더욱 뒷받침합니다. 이 에너지 원은 펄스 전달 직후에 빠르게 해결되는 미세 가스 버블을 생성합니다.21 의 이론적 가능성이 이러한 기포 방해 모세관 혈액의 흐름을 일으키는 오르간 국소 빈혈과 뇌 마이크로 혈지에서 관찰되는 이 임상시험.
Loh 등. 도 조사 실현 가능성과 안전의 전기충격법을 위한 PVI 에서 작은 일련의 10 환자 발작성 또는 영구 AF 를 사용하여 사용자 지정 14-원형극 제거 카테테르. 급성 PVI 는 monopolar monophasic 파형을 사용하여 PV 당 최소 2 개의 비 아크 6ms,200Joule 응용 프로그램을 가진 100%(40PV)환자에서 안전하게 달성되었습니다.22 이 시리즈의 안전성 및 PVI 내구성 결과는 아직보고되지 않았습니다.
요약하면,pfa 는 우수한 단기 안전 프로파일과 장기 내구성으로 PV 를 빠르게 격리 할 수 있습니다. 이것이 매우 유망하지만,더 긴 후속 조치가있는 더 큰 연구가 필요합니다.
결론
PFA 은 매우 유망과 새로운 비 열 융제 전략는 기능을 가지고 있으며,특정한 한계를 극복의 현대 AF 제거 기술입니다. 짧은 절차 시간,부수적 인 부상의 부족 및 PVI 의 장기 내구성 향상은이 에너지 원을 다른 것과 구별합니다. 절제 카테터 및 펄스 디자인은 안전성과 효능에 모두 영향을 미칩니다. 이것은 새로운 PFA 기술이 임상 영역으로 나아갈 때 명심해야합니다.
- 후세인 A,다스 M,리바 S,외. 용의 박리 지수 유도 절제 결과에 높은 비율의 튼튼한 폐정맥 격리고 자유에서 부정맥에서 지속적인 심방 세동 환자가 있습니다. Circ 부정맥 Electrophysiol2018;11:e006576.
- De Pooter J,Strisciuglio T,El Haddad M,et al. 폐정맥 재 연결은 단일 폐정맥 격리 절차 후에 대다수의 환자에서 더 이상 발생하지 않습니다. JACC Clin Electrophysiol2019;5:295-305.
- Das M,Wynn GJ,Saeed Y,et al. 증상에 관계없이 일상적인 전략으로서의 폐정맥 재 격리:압력 무작위 대조 시험. JACC Clin Electrophysiol2017;3:602-11.
- Wittkampf FHM,van Es R,Neven K.Electroporation 및 심장 카테터 절제에 대한 관련성. JACC Clin Electrophysiol2018;4:977-86.
- Reddy VY,Koruth J,Jais P,et al. 맥박이 뛴 전기장을 가진 심방 세동의 절제:심장 절제를 위한 매우 급속한,조직 선택적인 양식. JACC Clin Electrophysiol2018;4:987-95.
- Darrat Y,Morales G,Di BL,Natale A,Elayi CS. 튼튼한 폐정맥 Antral 격리를 달성하는 방법? J Atr 세동 2014;6:1039.
- Paiella S,Butturini G,Frigerio I,et al. 국소 진행된 췌장암 환자에서 돌이킬 수없는 일렉트로 포 레이션(IRE)의 안전성과 타당성:전향 적 연구 결과. 발굴 Surg2015;32:90-7.
- Heller R,Heller LC. 유전자 electrotransfer 임상 시험. Adv Genet2015;89:235-62.
- Jais P,Takigawa M,Sacher F,et al. 동물 모델에서 2 상 및 단상 펄스 필드 절제의 비교. J Cardiovasc Electrophysiol2019;1-28(abstr).
- Witt CM,Sugrue A,Padmanabhan D,et al. 협착증이없는 폐내 정맥 절제:새로운 풍선 기반 직류 전기 이식 접근법. J 오전 심장 Assoc2018;7:e009575.
- van Driel VJ,Neven KG,van Wessel H,et al. 카테터 절제 후 폐정맥 협착증:일렉트로 포 레이션 대 고주파. Circ 부정맥 Electrophysiol2014;7:734-8.
- Takigawa M,Vlachos K,Viswanathan R,et al. 돼지 모델에서 펄스 전기장 절제를 사용한 우수한 대정맥 및 폐정맥 격리의 급성 결과. 심장 리듬 2018;15:S178-179(abstr).
- Stewart MT,Haines DE,Verma A,et al. 심장 내 펄스 필드 절제:만성 돼지 모델에서 타당성 증명. 심장 리듬 2019;16:754-64.
- Neven K,van Driel V,van Wessel H,van Es R,Doevendans PA,Wittkampf f.subxiphoid puncture 후 epicardial electroporation 카테터 절제 후 심근 병변 크기. Circ 부정맥 Electrophysiol2014;7:728-33.
- Kuroki K,Koruth JS,Pare M,et al. 돼지에서 심내막 펄스 필드 절제의 병리학 적 소견의 초기 보고서. 심장 Rhyhtm2019;16:S583.
- Neven K,van Es R,van Driel V,et al. 돼지 식도에 직접 전 동력 전기 절제의 급성 및 장기 효과. Circ 부정맥 Electrophysiol2017;10:e004672.
- McElderry H,Walcott G,Viswanathan R,Long G,Sauter E,Mickelsen S. 돼지 식도에 직접 적용 할 때 펄스 전기장 절제의 안전성. J Cardiovasc Electrophysiol2018;29:657-78(abstr).
- van Driel VJ,Neven K,van Wessel H,Vink A,Doevendans PA,Wittkampf FH. 일렉트로 포 레이션 절제에 대한 우측 골반 신경의 낮은 취약성. 심장 리듬 2015;12:1838-44.
- 쿠로키 K,코루트 J,이와사와 J,외. 2 상 펄스 필드 절제를 이용한 폐정맥 격리:관개 된 고주파 절제 전 임상 비교. J Cardiovasc Electrophysiol2019;1-28(abstr).
- Reddy VY,Neuzil P,Koruth JS,et al. 심방 세동에서 폐정맥 분리를위한 펄스 필드 절제. J Am Coll Cardiol2019;74:315-26.
- 밴 Es R,Groen MHA,Stehouwer M,Doevendans PA,Wittkampf 층,Neven K.In vitro 분석의 기원과적 특성 가스 microemboli 동안 카테터 전기충격법 제거. J Cardiovasc Electrophysiol2019;30:2071-9.
- Loh P,van Es R,Groen MHA,et al. 돌이킬 수없는 일렉트로 포 레이션에 의한 폐정맥 격리:최초의 인간 경험. 심장 리듬 2019;16:S579.
- Jourabchi N,Beroukhim K,Tafti BA,Kee ST,Lee EE. 암 치료에서 돌이킬 수없는 electroporation(NanoKnife). 위장 개입 2014;3:8-18.
- López-Alonso B,Hernáez A,Sarnago H,et al. 평행 판 전극과 고성능 발생기를 사용하여 돼지 간에서 일렉트로 포 레이션 후 조직 병리학 적 및 초 구조적 변화. Sci 담당자 2019;9:2647.
임상 주제: 부정맥과 임상 EP,심장 수술,이상지질혈증,침입 심장 혈관 조영술 및 개입,비침범성 이미징,심낭 질환,EP 기초과학,SCD/는 심실 부정맥 심방 세동/심실 부정맥 심장 수술 및 부정맥,지질 대사,내정간섭 및 이미징,자기 공명 화상 진찰
키워드: Atrial Fibrillation, Cardiac Tamponade, Feasibility Studies, Follow-Up Studies, Stroke Volume, Catheter Ablation, Anti-Arrhythmia Agents, Endoscopy, Electroporation, Magnetic Resonance Imaging, Cohort Studies, Phrenic Nerve, Myocytes, Cardiac, Pulmonary Veins, Cicatrix, Microscopy, Electron, Scanning, Feasibility Studies, Prospective Studies, Tissue Scaffolds, Catheter Ablation, Constriction, Pathologic, Heart Atria, Heart Rate, Esophageal Fistula, Cryotherapy, Cardiac Surgical Procedures, Endocardium, Electroporation, Cell Membrane, Electrodes, Extracellular Matrix, Cell Death, Muscle, 골격,간,마취,일반적으로,세포 증식,뇌졸중,멤브레인,지질,Neoplasms
<다시 목록을