기본 구조의 단백질로 정의 시퀀스의 아미노산의 구성됩니다. 이 순서 궁극적으로 모양을 결정하는 단백질을 채택에 따라,공간적 제한이의 배열에 원자에서 단백질,화학적 특성 구성 요소의 아미노산 잔류물,및 단백질의 환경입니다.
펩티드 채권에 링크되는 아미노산 잔류물 폴리펩타이드에 형성된 응축 반응이 신랄한 카르복실기의 그룹 중 하나의 아미노산과 기본적인 아미노 그룹의 다른 아미노산입니다. 펩타이드의 맥락에서,아미드 그룹(CO–NH)은 펩타이드 그룹으로 지칭된다.
단백질 구조에 대한 이해에 중요한 것은 펩타이드 결합의 구조에 대한 지식이다. Linus Pauling 은 1930 년대에 X 선 회절을 사용하여 두 아미노산 사이에 형성된 펩타이드 결합의 성질을 조사했습니다. 그는 펩타이드 그룹(CO–NH)이 단단한 평면 구조를 가지고 있다고보고했다. 이 구조가 간 상호작용에서 일어나는 부작용을 전자의 이중 결합의 카르보닐기의 C–N 결합니다(그림 2).그런 후자를 취득한 부분(약 40%)이중 채권 속성입니다.

이 효과 예의 공명으로 생각할 수 있는 공유의 전자 사이에 채권. 이 단일 채권 사이에 두 개의 원자는 더 이중 결합이 동일한 두 개의 원자로,길이의 C–N,C=O 채권에 펩티드 그룹과는 다른 것을 관찰한 이러한 유대에서 다른 컨텍스트 공명이 발생하지 않습니다. 따라서 부분적인 이중 결합의 C–N 펩티드 그룹이 결합이 보다 짧은 것에 대해 예측 C–N 단일 결합하는 동안,C=O 채권을 가지고,부분적인 단일 결합으로 문자를 공명 이상이 될 것에 대해 예측 C=O double bond. 펩타이드 그룹의 결합 길이는도 3 에 표시되어있다. 펩타이드 그룹의 C–N 결합을 N 과 Ca 사이의 결합(아미노기와 카르복실기가 부착 된 C 원자)과 비교하십시오.

평면 펩타이드 결합의 두 가지 가능한 형태가있다: 에서 트랜스 펩티드 그룹,Ca 원자의 반대 측에 펩타이드 본드(그림 3)과 cis 펩티드 그룹,Ca 원자 이 같은 측면에서의 펩타이드 본드(그림 3b).
-
고의 공간적 배열의 근접에서 원자 cis and trans conformations 의 펩타이드 본드는 형태로 당신은 당신이 될 것이라고 생각하는 선?
-
trans conformation 은 steric 방해를 최소화하기 때문에 cis conformation 보다 에너지 적으로 더 유리할 것입니다.
일반적으로 말하면,펩타이드 결합은 트랜스 구조에있다. 그러나 시스 형태는 프롤린 잔기에 선행하는 펩타이드 결합에서 발생할 수 있습니다. 이러한 경우에,시스 형태는 프롤린 측쇄가 방해를 덜 제공하기 때문에 평소보다 안정하다. 그럼에도 불구하고,시스 펩타이드 결합은 프롤린 잔기에 앞서 펩타이드 결합의 경우의 약 10%에서만 발생한다.
베어링 마음에 평면 자연의 펩티드 그룹,폴리펩타이드 체인을 볼 수 있습을 근간으로 구성되는 일련의 엄격한 평면 펩티드 그룹에 의해 연결되어 Ca 원자를 함유하고 있습니다. 그림 4 는 트랜스 구조에서 두 개의 평면 펩타이드 그룹을 가진 폴리 펩타이드의 일부를 보여줍니다. 펩타이드 결합에 대해서는 회전이 허용되지 않지만 Ca-N 및 Ca–C 결합 주위에 회전 가능성이 있음을 유의하십시오. 이러한 결합에 대한 회전 각도,비틀림 각이라고하는 각도는 폴리펩티드 백본의 구성을 지정합니다. Ca-N 및 Ca–C 결합에 대한 비틀림 각은 ɸ(phi)및 ψ 로 지칭된다. (psi),각각 및 이들은 폴리펩티드가 도 4 에 도시 된 바와 같이 확장 된 평면 구조에있을 때 180°로 정의된다.
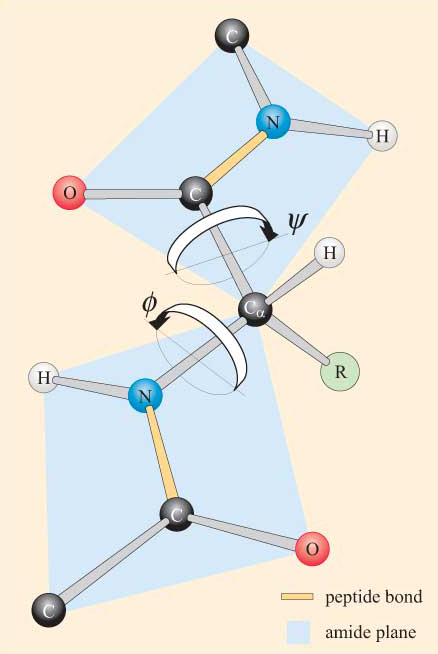
steric 제약 조건이 ɸ 와 ψ 에 적용된다는 것을 알면 놀라지 않을 것입니다.
의 결과로 이러한 제약 조건을 입체적,특정 값만의 ɸ 및 ψ,따라서 conformations 의 펩타이드,허용되는 반면 다른 사람은 없습니다.
폴리펩티드의 맥락에서 주어진 잔기에 대해 이러한 허용 값을 계산하는 것이 가능하다. 이 계산을 수행하기 위해 먼저 결정 거리를 사이에 모든 비 결합 원자로서 두 개의 이웃 펩티드 그룹(예 그림 4)에서 가능한 모든 값의 ɸ 및 ψ. 그것은 아미노산의 다만 1 개의 종류를 포함하는 폴리펩티드를 위해 가장 쉽게 합니다. 구조적 음모의 ɸ 에 대한 미디어에 대한 특정한 잔여물이 알려져 있으로 기본적인 줄거리(후 발명가,G.N. 기본적인). 이러한 줄거리를 식별할 수 있도록 그 conformations(즉,특정 값의 ɸ 및 ψ)는 유리한 입체 또는 불리한다(그림 5)에 따라,다음과 같은 기준:
-
어디 사이에 충돌이 없 van der Waals 반경의 비 결합,원자 구조은’허용. 이러한 구조는 그림 5 의 파란색 영역에 있습니다.
-
허용 가능한 한도에서 원자 간 거리를 요구하는 순응은’외부 한계’순응으로 정의됩니다. 그들은 그림 5 의 녹색 영역에 놓여 있습니다.
-
이론적 conformations 필요한 모든 두 개의 비 결합 원자들을 서로 가까이 다른 것보다 그들의 van der Waals 반경 허가 입체’금지’. 이들은 그림 5 의 흰색 영역에 놓여 있습니다.
그림 5 의 ɸ 와 ψ 의 값은−180º 에서+180º 까지입니다. 360º 를 통해 펩티드 그룹을 도는 것은 당연히 그것의 시작 위치에 그것을 후에 가져오고,−180º 와+180º 는 동일한 위치에 대응합니다. 따라서 그림 5 의 플롯의 왼쪽 하단 모서리에있는 녹색 스트립은 왼쪽 상단 모서리에있는 필드와 연속됩니다.

-
를 사용하여 그림 5 는지 여부를 결정은 다음과 같은 값의 ɸ 및 ψ 은 유리한 입체 또는 형편이 나쁜:(a)ɸ=90º ψ=90º;(b)ɸ=−90º ψ=90º.
-
(a)불리한; (b)유리한.
Ramachandran 플롯은 20 개의 아미노산 각각의 중합체에 대해 구성 될 수있다. 그것이 중요하다는 기본적인 플롯한 많은 아미노산 잔류물은 일반적으로 매우 유사한 정보의 정확성과 신뢰성을 보장 세 지역으로 유리한 또는 용납 conformations(로 표시된 1-3plot poly-l-알라닌 그림 5). 그러나 차이가 발생합니다. 예를 들어,어디 side-chain(R 그림 4)분 근처 캘리포니아에서와 같이,의 경우 트레오닌,그것은 더 많은 공간을 차지한 가 펩티드 근간을 제한 접근법의 원자 이웃 펩티드 그룹입니다. 결과적으로,허용되는 구조(ɸ 및 ψ 각도)는 분지 된 아미노산의 폴리 펩타이드에 대해 더 제한된다.
-
프롤린도 매우 다르 다른 아미노산의 측면에서 허용 입체 및 polyproline 만 ɸ 값에서 85º to−35º 은 허용됩니다. 프롤린의 구조에 대해 생각해 보면,이 비교적 좁은 범위의 허용 된 ɸ 값을 어떻게 설명 할 수 있습니까?
-
사이드 체인의 프롤린이 炭 접착 N 의 아미노에서,그래서 polyproline,있을 것입니다 적은 자유에 대해 회전할 수 있는 채권보다는 다른 아미노산을 포함하고 있습니다. 결과적으로,허용 된 γ 값은 다른 아미노산과 비교하여 상대적으로 제한 될 것이다.
-
그림 6 의 기본적인 줄거리를 위한 글리신 잔류물 폴리펩타이드 체인입니다. 영역은 그림 5 와 같이 색상으로 구분됩니다. 글리신이 채택하는 형태에 대해 무엇을 말할 수 있습니까? 글리신의 구조를 고려하십시오. 글리신은 그 구성과 관련하여 다른 잔기와 다른 이유는 무엇입니까?
-
글리신은 훨씬 더 큰 구조적 자유보다는 다른 아미노산 잔류물,기 때문에 더 적은 방해 입체.

기본적인 플롯에 그림 5 와 6 가 생성되었는 각각 l-알라닌 l-글리신에 기초하여 허용되며 외부 제한 거리에 대한 원자 사이의 연락처,결정에서 알려진 값에 대한 van der Waals 반지름의 원자(표 1).
표 1 원자 간 접촉에 대한 반 데르 발스 거리.
| 연락처 유형 | 일반적으로 허용되/Å | 외부 제한/Å | |
|---|---|---|---|
| H···H | 2.0 | 1.9 |
3.0 |
따라서 실제 구조 플롯보다는 예측 적입니다. 우리는 물론 X 선 회절을 사용하여 폴리 펩타이드의 잔기에 대한 ɸ 와 ψ 의’실제’값을 실험적으로 결정할 수 있습니다. 그림 7 에서 ɸ 및 미디어 값에 대한 모든 잔류물(제외하고 글리신하고 프롤린)숫자에 다른 구조의 결정에 의 고해상도 X-선 회절 및로 표시하여 기본적인 줄거리입니다. 우리는 예측 된 일치와 실제 일치 사이에 현저한 대응이 있음을 알 수 있습니다. 그러나 그 일치가’금지 된’영역에 매핑되는 일부 잔류 물이 있음을 알 수 있습니다. 이러한 잔류 물의 대부분은 ψ=0 주변의’허용 된’영역 2 와 3 사이의 영역에 매핑됩니다.

-
그림 4 를 다시보고 180°를 통해 최고 펩타이드 그룹을 ψ=0 이되도록 비틀 수 있다고 상상해보십시오. 이 구조에서 충돌 할 가능성이있는 그룹은 무엇입니까?
-
인접한 펩타이드 그룹의 N–H 그룹은 서로 충돌하여 근접하게 강제됩니다.
이러한 일치와 관련된 충돌은 펩타이드 결합의 작은 비틀림 정도에 의해 수용 될 수있다. 따라서,이러한 구조에서 펩타이드 그룹은 일반적인 평면 구조에서 비틀어진다.
제한된 수의’금지’conformations 의 특정 잔류 수 있습에서 허용 폴리펩타이드는 경우 채택한 구조,전체로서 정력적으로 유리한입니다. 폴리펩티드는 가장 안정한 구조를 채택하도록 접히는 경향이 있습니다. 이 구조에서 폴리펩티드는 자유 에너지를 최소화합니다. 다음 섹션에서 우리는이 더 높은 수준의 단백질 구조를 살펴볼 것입니다.