근육을 소성
골격근 가장 큰 조직에서는 몸입니다. 그것은 높은 플라스틱 및을 받을 수 있습 극적인 비 병리학적인 변화 모두에서 대량 및 강도에 응답하는의 수많은 환경 영향을 미칩니다. 저항 운동이나 단백 동화 스테로이드에 노출되면 근육은 비대를 겪고 질량,단면적 및 강도를 증가시킵니다(aagaard,2004; Schiaffino 등., 2013). 이러한 동일한 매개 변수할 수 있는 급격히 감소하면 근육을 시작하의 위축에 대한 응답의 범위는 모욕을 포함한다:기아,denervation,immobilization,패혈증,암 암,심장의 실패,당뇨병,신부전,만성 폐쇄성 폐질환 및 후천성 면역결핍증(Schiaffino et al., 2013).위축의 결과는 건강에 명백한 영향을 미칩니다. 근력 약화는 사망률과 이환율 모두에 주요 기여자이며 모든 사망 원인의 위험 증가와 관련이 있습니다(Metter et al., 2002). 사실,암 악액질에서 근육 위축을 줄이면 수명이 크게 연장 될 수 있습니다(Zhou et al., 2010). 뿐만 아니라,많은 사람들이 고통을에서 근육 감소증,장기 근육을 낭비하는 장애는 일반적으로 시작된 후 50 세과 손실을 포함한의 약 1%를 근육량이 연간(우,2017 년). 이것은 80 세까지 사르코 페닉 개인이 낙상,허약 및 요양원 입원의 핵심 요소 인 근육 질량의 약 40%를 잃었다는 것을 의미합니다. 결과적으로,위축에 대한 메커니즘과 잠재적 치료 반응을 이해하는 것은 광범위한 기본 및 임상 적 관심사입니다(Ali and Garcia,2014;Cohen et al.,2015;Ziaaldini 외., 2017).
Myonuclear 도메인 가설
골격근은 상당히 독특한에서는 성숙한 세포는 syncytial 포함할 수 있습니다 수백명의 핵. 이것은 필요한 적응어는 개별 근육 섬유할 수 있는 엄청난 달성,길이의 최대~600mm(23 일)(예:사토리 근육의 양 et al.,1998)및 전형적인 단핵구 세포보다 10 만 배 이상 클 수있는 부피(Bruusgaard et al., 2003). 에 기여서 여러 핵하는 데 필요한 대량 생산 mRNA 하는 데 필요한 직접 거대한 단백질 합성 필요를 생성하고 유지할 수축장치(Nevalainen et al., 2013).
모두 플라스틱 성격의 근육 그 syncytial 조직의 상승을 부여 논란을 최근에 나타납하여 해결되었습니다—”라 myonuclear 도메인 가설”(Qaisar 및 라르손,2014;Gundersen,2016;Schwartz et al., 2016). 이 이론은 그 기원의 개념에서”Wirkungssphäre”또는”영역의 영향”에 의해 제안 Strassburger(1893),에는 그는 주장 핵만 지원할 수 있습니다 이산 볼륨의 세포질,따라서 정의하기 위한 셀 크기입니다. 이 원리는 세포질 데 옥시 리보 핵산 함량과 부피가 단단히 결합되어 있다고 주장한 그레고리(2001)에 의해 더욱 정교화되었다. 골격근의 syncytial 특성은 이러한 세포가이 한계를 극복하는 데 도움이됩니다. 근핵 도메인 가설은 적절한 핵 대 세포질 비율을 유지하기 위해 비대 동안 새로운 핵이 추가되고 위축으로 손실된다고 지시한다.
핵 수가 근육 비대와 함께 증가한다는 것을 보여주는 실질적인 데이터가있다(Moss,1968;Cabric and James,1983;Egner et al.,2016),일부 논란이 남아 있지만(Murach et al., 2018). 이 과정은 강렬한 조사와의 기본을 조절 하는 분자 메커니즘의 취득 새로운 핵안 비대 정의는 최근(Guerci et al.,2012;Bentzinger 외.,2014;로스 외., 2018). 이러한 정원 외의 핵 획득할 때 혈통 제한 줄기 세포는,일반적으로 위성 셀,퓨즈와 함께 근육 섬유와여 그들의 핵(브랙와 란도,2012;바 et al., 2018). 위성 세포는 지하 막 아래에 상주하여 사르 콜레 마(Katz,1961;Mauro,1961)에 접해있다. 그들은 대기 전까지 자극에 의거나 스테로이드 같은 테스토스테론 또는 초 상해 다음과 같은 저항 운동이 어느 시점에서 그들을 다시 입력 세포주기와 증식(버트와 Tobin,1995;아브르 et al., 2017). 딸 세포 중 일부는 근육 섬유와 융합하여 수리와 성장을 촉진시키는 반면,다른 세포는 위성 풀을 체포하고 재구성합니다(Dumont et al.,2015;Goh and Millay,2017). 나머지 잉여 세포는 세포 사멸을 겪는다(Schwartz,2008).
근핵 도메인 가설의 논란의 측면은 근핵이 위축되는 동안 손실된다는 경합이다. 고정화,신경 분포 및 패혈증을 포함하여 동물 모델에서 위축을 유도하는 많은 중재가 있습니다(Fitts et al.,1986;Minnaard 외.,2005;오리어리 외., 2012). 각각의 경우에,근육 단면적(1 차 분석)과 조직 내의 세포 사멸 세포의 출현 모두의 순 손실이 존재한다(McCall et al.,1998;스미스 외.,2000;스트라서 외.,2000;Alway 등.,2003;맥클룽 외.,2007;Andrianjafiniony 외.,2010;구오 외.,2012;팔 룸보 외.,2012;반스 외.,2015;Cheema 외.,2015;리 외.,2016;Kletzien 외., 2018). 이러한 연구에서 세포 사멸은 카스파 제 활성화,미토콘드리아 엔도그 방출 또는 DNA 단편화를 포함한 다양한 방법으로 측정됩니다. 이러한 연구는 위축의 초기 단계에서 아폽토시스가 극적으로 증가한다는 강력한 데이터를 제공합니다. 예를 들어,최근의 포괄적 인 연구(Guo et al.,2012),구오 외. 쥐에게 14 일간의 hindlimb 현탁액을 투여 한 결과,근육 습윤 중량의~69%감소 및 관리되지 않은 대조근에 비해 단면적의~43.8%감소를 초래하는 치료법. 저자는 또한 계량의 수 apoptosis 마커를 포함하여 등 얼룩,caspase-3 열/활성화,그리고 분열의 폴리(아데노신 인산 ribose)polymerase(PARP),단백질에 참여 DNA repair. 이러한 각 아폽토시스 조치는 힌드림 현탁액에 따라 크게 증가했다. 는 동안의 주요 초점이되었다 종이를 평가 하는 긍정적인 영향을의 전기 자극에 제한 쇠약 다음과 같은 모욕,그들과 다른 많은 연구원은 해석 이러한 종류의 데이터를 제공하는 강력한 지원을 위해 myonuclear 도메인 가설입니다.
에서 세포 생물학적 관점에서,추정 손실의 핵 내 syncytial 조직과 같은 골격근을 제공합 중요한 실제적인 문제입니다. 할 수 있는 방법 개별 핵이 되도록 훼손하는 게놈 급속하게 응축과 조각을 하는 동안 이웃을 계속 유지하는 데 도움이 생존 능력의 근육 섬유? 는 apoptosis 은 일반적으로 중재에 의해 활성화 등의 시스테인 프로테아제로 알려져 있 caspases,그것이 무엇인지 명확하지 않 메커니즘을 수도 있습 제공을 제한하는 활동의 확산성 단백질 내에서 일반적인 세포질.
이 질문은 간접적으로 해결되었습니다에서 또 다른 세포융합 유형 셀,인 syncytiotrophoblast,조직을 둘러싸고 있는 태반과 포함되어에 대해 5×1010 핵(메 et al., 1999). Syncytiotrophoblast 에서 apoptosis 가 유도되면 전체 조직이 관여 할 때까지 분당 약 5 미크론의 속도로 파동으로 전파됩니다(Longtine et al., 2012). 결과적으로,syncytial 세포질 내에”특권”영역이 없으며 모든 핵이 궁극적으로 파괴됩니다.
중 하나는 중요한 도전의 분석을 apoptosis 골격 근육에서는 매우 다른 유형의 조직,위치를 대략 절반의 핵 거주하는 외부 근육 섬유(Schmalbruch 과 지옥망치,1977). 이러한 단핵구 세포는 위성 세포,내피 세포,섬유 아세포,과피 세포 및 대 식세포를 포함한다(Tedesco et al., 2010). 결과적으로,sarcolemma 의 어느 쪽,핵이 상주하는지,따라서 그것이 진정한 myonucleus 인지 결정하는 것은 매우 어렵습니다.
In Vivo 시간 경과 영상의 표 마우스 근육 섬유
의 많은 수에도 불구하고 논문을 보여주는 apoptosis 동안 근 위축,몇 작가는 의문을 제기 이러한 결과(와 et al.,2002;종 외.,2005;Aravamudan 외.,2006;Gundersen and Bruusgaard,2008;Duddy et al.”,2011;Qaisar and Larsson,2014). 예를 들어,시험 관내에서 고립 된 근육 섬유를 사용하여,Duddy et al. 주목하는 동안 근육 섬유질 볼륨은 시간이 지남에 따라 감소,반사의 위축 과정을 수 myonuclei 등장하여 안정적인 것(더디 et al., 2011).
시리즈에서 우아한 실험,Gundersen 실험실 주입한 개인 신 심지 롱(EDL)또는 soleus 근육을 근육 섬유 염료는 독립적으로 표시 핵 및 세포질을 취 쥐(Bruusgaard 및 Gundersen,2008;Bruusgaard et al., 2010). 이는 그들이 각각을 식별하는 핵 안에 개별 근육 섬유 in vivo 을 통해 시간 및 그 후에 평가입니다. 예를 들어,EDL 근육은 그들의 주요 상승 작용제의 절제에 의해 비대로 유도되었다(Bruusgaard et al., 2010). 6 일에서 11 일 사이에 근핵구 수가 약 54%증가했으며 9 일에서 14 일 사이에 단면적이 35%증가했습니다(그림 1). 이 데이터는 근육이 비대 동안 섬유의 주요 성장에 앞서 초막 핵을 획득한다는 가설과 일치한다.

그림 1. Myonuclei 는 비대 동안 획득되지만 마우스에서 위축 동안 손실되지 않습니다. 비대(맨 위 줄)의 유도와 위축(맨 아래 줄)의 후속 유도에 따라 시간이 지남에 따라 동일한 EDL 근육 섬유의 현미경 사진. 형광 표지 된 올리고 뉴클레오티드는 생체 내에서 핵을 시각화하기 위해 사용되었다. 점선은 sarcolemma 를 나타냅니다. 스케일 바=50μm. (Bruusgaard 등으로부터 적응., 2010. 국립 과학 아카데미 절차의 허가에 의해 사용됩니다.)
그들은 다음을 조사하는 운명의 이러한 고유하게 식별할 수 있는 myonuclei 에서 동일한 근육 섬유했을 때 그들은 유도를 받아야축. Denervation 은 근육 섬유 부피의 약 50%감소를 가져 왔지만 myonuclei 의 손실은 없었다(그림 1;Bruusgaard et al., 2010). 실패를 관찰하 핵 손실되지 않았으로 인해 위축 자극에 고용되기 때문 얻은 같은 결과를 때 근육을 유도 했기 위하여 응답에 복어 독 유도 신경 봉쇄,hindlimb 서스펜션,암 소모 또는 detraining(Bruusgaard 및 Gundersen,2008;Bruusgaard et al.,2010;Winje 등.,2018a). 사실의 과정에 자신의 연구,그들은 검사 200,000 개 이상의 개별 myonuclei 에 위축 근육 및 관찰 4TUNEL 긍정(apoptotic)핵를 나타내는 손실에만~0.002%의 핵(Bruusgaard et al., 2012). 이 데이터는 골격근 위축이 근핵 사망을 동반하지 않는다는 가설을 강력히지지합니다.
곤충 근육 모델로서
이러한 연구가 강력한 것처럼 포유류 모델의 사용에 내재 된 몇 가지 한계가 있습니다. 첫째,그들은 변함없이 근육 위축을 유도하기 위해 신경 분포와 같은 실험적 개입에 의존합니다. 두 번째,반대편은 근육으로 전형적으로 사용되는 내부 통제하더라도 그것은 너무에 노출되는 몇 가지 동일한 환경 신호와 같은 스트레스를 호르몬(Bonaldo 및 Sandri,2013). 마지막으로,골격근할 수 있도를 받아야 프로그래밍 세포의 죽음(PCD)동안 개발,그리고 이러한 모델을 거의 주소의 역할을 apoptosis 에서 이러한 세포입니다.
대체하지 않는 모델의 이러한 제한할 수 있는 연구는 근육의 핵 모두 동안 위축과 자연적으로 발생하는 PCD,은 개축 근육(ISM)에서 담배 hawkmoth Manduca sexta. ISMs 는 각 세포의 길이가 약 5mm 이고 직경이 최대 1mm 인 거대한 근육 섬유 시트로 구성됩니다(그림 2A). 는 ISMs 를 첨부하는 구역의 경계에 복부와 생성 모두를 크롤링한 동작의 애벌레와 우화하고(출현)동작의 성인 엄 때로부터 벗어나 번데기 표피의 끝에서 혁신에 직면하고 있습니다.
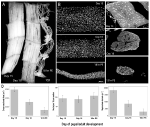
그림 2. 나방 Manduca sexta 에서 intersegmental 근육(ISMs)의 위축과 죽음 둘 다 도중 myonuclei 의 보유. (A)발달의 3 단계에서 ISMs:항상성(번데기-성인 발달의 15 일;왼쪽);위축성(18 일;중간); 그리고 죽어(18 시간 후 eclosion;권리). 스케일 바는~1mm 와 같습니다(Schwartz et al., 2016). (B)이 같은 발달 단계로부터의 ISMs 를 핵 염료 DAPI 로 지우고 염색하고 공 초점 현미경을 통해 시각화했다(Schwartz et al., 2016). (C)ISM 섬유 섹션(10μm)을 핵 염료 DAPI 로 염색 하였다. 참고 극적인 손실의 근육 단백질(밝은 회색 영역)동안 위축과 죽음이 있지만,보존 핵의 모든 단계에서(에서 적응 Schwartz et al., 2016). (D)항상성,위축 및 사망시 ISM 섬유 부피(왼쪽),핵수(중간)및 근핵 도메인 크기(오른쪽)의 정량화. (평균±표준 오차.)(슈워츠 등으로부터 적응., 2016).
일에 15 일반에 18 일,번데기-성인 개발,ISMs 을 시작하는 호르몬으로 트리거 프로그램을 위축하는 결과에서 40%의 손실을 대량으로 시간의 우화하고 3 일 이상(그림 2A;Schwartz 먼,1983). 근육 질량의이 극적인 손실은 sarcopenia 를 가진 80 세의 개인에서 보이는 것과 동등하지만 30 년이 아닌 3 일에 걸쳐 발생합니다. ISMs 는 질량을 잃는 동안 휴식 전위 및 힘/단면적과 같은 정상적인 생리 학적 특성을 유지합니다(Schwartz and Ruff,2002). ISMs 는 일 18 의 끝에 eclosion 행동을 생성하고 그 후에 펩티드 호르몬(Schwartz and Truman,1982,1983)에 의해 방아쇠를 당기는 PCD 를 개시하기 위하여 이용됩니다. .
에 대비하여 포유류 근육,ISMs 포함하지 않는 모세혈관,위성,세포 내피세포,또는 pericytes 접을 의미하는 실제로 모든 핵의에서는 조직 내에 있는 근육 섬유 자신(Beaulaton 및 Lockshin,1977). 우리는이 모델에서 위축과 죽음 모두에서 핵 운명을 모니터링하기 위해 두 가지 독립적 인 방법을 사용했다(Schwartz et al., 2016). 첫 번째는 표준 해부학 적 접근법이었습니다. ISMs 가 위축과 사망을 겪을 때 섬유의 부피와 단면적 모두에서 극적인 감소가 있지만 총체적으로 핵 수는 변하지 않았다(그림 2B). 를 사용하여 구분한 조직에 대한 정량적 연구 결과,우리는이 있었다는 것을 것을을 발견했 a~49%감소섬유 단면적 동안 위축과 더 30%감소의 초기 단계 동안 죽음(그림 2C,D,Schwartz et al., 2016). 그러나,이 같은 기간 동안 핵의 수가 변하지 않았다는 것은 기능적으로 근핵 도메인에서 84%의 감소가 있었음을 의미한다.
두 번째 방법을 우리는 고용되었을 측정 DNA 콘텐츠의 개별 근육 섬유에서 동물에서는 13 일 때 근육은 항상성,18 일까지 h post-우화하고,근육이 높은 퇴화(Schwartz et al., 2016). 우리는 420 개의 개별 세포의 DNA 함량을 정량화하여 발달 중에 유의 한 손실이 없다는 것을 발견했다. 이러한 생화학적 분석을 잘 동의 해부학 데이터는 것이 좋습니다 상대적인 농도는 모두의 핵 genomic DNA 기능적으로 증가는 근육을 위축하고 죽었습니다. 따라서,모두에서 데이터를 쥐고 나방안 근육의 핵를 받지 않습니 apoptosis 동안 위축(또는 PCD)리드하는 결론에 도달 myonuclear 도메인 가설을 거부해야 합니다.
결론
이러한 관찰의 의미를 모두에 대한 이해를 기본적인 생물학의 근육과 개발을 위한 잠재적인 치료입니다. 이 있는 동안은 실질적인 데이터 보고의 존재 apoptotic nuclei 조직 내에서 다음과 같은 위축 모욕,최근 데이터를 제안하는 이들은 진실하지 않 myonuclei 지만,오히려 증 단 셀 외부에 있는 근육 섬유입니다. 주된 이유는 이에 대한 불일치가 있는 전통적인 도구를 사용되는 검출 apoptosis 부족 해결에 필요한 적절하게 결정하는 측면의 sarcolemma 에어 셀 수 있습니다. 방법는 레이블 myonuclei 특히 중 하나를 통해 생체 내의 주입 형광성 염료(Bruusgaard 및 Gundersen,2008)또는 유전자 조작을 간편 마커 단백질(더디 et al.,2011),표지 된 섬유 내에서 아폽토 틱 핵이 거의 없다면 공개한다. 최근의 데모체에 대한 감독의 단백질 Pericentriolar 재료 1(PCM1)레이블만 본격적인 myonuclei 제공하는 유망한 도구를 적용할 수 있는 전통적인 조직학 자료는 정기적으로 분석 분야에서(Winje et al.,2018b).
골격근이 근핵을 제거하기위한 메커니즘으로 아폽토시스를 채택하지 못하는 것은 놀라운 일이 아닙니다. 그것은 나타납니다 성숙한 골격근 크게 배제에서 시작 apoptosis 에서는 upregulates 식의 유력한 생존 단백질과 같은 X-linked apoptosis 의 억제제 단백질(XIAP)(Smith et al.,2009)및 caspase 모집 도메인(ARC)을 갖는 세포 사멸 억제 자(Xiao et al.,2011),동시에 apoptotic protease activating factor1(Apaf-1)과 같은 낮은 수준의 apoptosis 매개체를 발현하면서(Burgess et al., 1999). 이것은 의미가 teleologically 이후 근육은 주제를 극단적인 물결을 포함한 장애의 sarcolemma 에 다음과 같은 강렬한 운동이다,그래서 치명적인 것으면 그들이 트리거되는 세포는 죽음이 아닌 시작된 조직은 복고 아마도 비 대입니다. 다른 말기 분화 된 세포와 마찬가지로 근육은 비 apoptotic 메커니즘,특히 autophagic PCD(Type II 변성이라고도 함)를 사용하는 경향이 있습니다(Clarke,1990;Schwartz et al.,1993;콜레 외.,2013;Ginet 외.,2014)개발 중에 죽을 때.근육이 개별 핵을 선택적으로 표적화 할 수있는 메커니즘이 있다고하더라도 이것이 유익 할 것이라는 것은 분명하지 않다. 사실,보존의”흑자”핵안 위축 부여 뚜렷한 장점에 대한 개별기 때문 골격근을 자주를 받아 주기의 위축 및 비대에 대응하여 환경 조건에 이러한 음식으로 이용 가능. 기존의 myonuclei 를 활용하여 신속하게 회복 할 수있는 능력은 적응에 중요한 역할을 할 수 있습니다(Jackson et al.,2012)및”근육 기억”현상을 설명하는 데 도움(Staron et al.,1991;군데르센,2016). 그것은 잘 설명되어 있습니다 분야에서 운동 생리학 그것은 훨씬 쉽게 얻으려면 일정 수준의 피트니스 근육 운동을 통해 보다 그것은 그것을 달성하는 첫 번째 장소가있는 경우에도 길었습니다 중간기간의 detraining. 에 다른 단어,구문”그것을 사용하거나 그것을 잃는”수 있습니다 더 정확하게 분명히 말라”그것을 사용하거나 그것을 잃을 때까지,당신이 작동 다시에 있습니다.”이 설명되었습에 의해 직접 또 다른 실험에서 Gundersen 실험실을 증명하면 근육을 획득했는 새로운 핵,그것들을 유지하 긴 후 hypertrophic 자극이 제거됩니다. 그들은 그 유도 근육의 비대에서 여성 마우스를 처리하여 그들을 위한 2 주 동안 가 테스토스테론하고 다음 조사 근육을 후 3 주 스테로이드 철수(Egner et al., 2013). 근육량은 기준선으로 돌아 왔지만 새로 획득 한 핵은 3 개월 후에도 지속되었다. 면 근육을 받게 되었는 과부하를 재개 비대,스테로이드 치료 것들이 급속하게 고객 36%증가 섬유 볼륨있는 동안 제어 근육이 증가하여 6%. 이 데이터는”잉여”핵이 재교육을 촉진하기 위해 빠르게 동원 될 수 있음을 시사한다.
이러한 관찰은 공중 보건 정책에 잠재적 인 영향을 미친다. 그것을 보여왔는 근육을 성장,생리적 기능,그리고 재생 용량이 모두 감소,나이 크게 감소로 인해성 세포 증식(Blau et al., 2015). 따라서 운동하는 동안 청소년기 때 근육을 성장에 의해 강화된 호르몬,영양하고 견고한 위성 수영장,수있는 기능적으로 제공하는 개인을 허용하”은행”myonuclei 할 수 있는 그에 따라 이후에 생활을 느린 노후화의 효력과 가능성을 막아 근육 감소증.또한 이러한 데이터는 경쟁 스포츠 영역에서 의미가 있습니다. 단백 동화 스테로이드의 사용은 근육 비대 및 새로운 myonuclei 의 추가에 대한 강력한 자극입니다(Egner et al., 2013). 이러한 핵 지속 후 긴 스테로이드 사용이 끝나는,운동선수 가능성이 파생되는 혜택의 불법 약물을 사용하지 않고의 위험을 감지합니다.
에서 요약하는 동안,새로운 핵 근육으로 성장 크게 허용,apoptotic 손실의 핵과 위축을 지원할 수 없을 제안하는 엄격한 해석의 myonuclear 도메인 가설을 지원할 수 없습니다. 대신,일단 획득되면 근육이 위축성이되거나 세포 사멸을 시작하는 경우에도 근핵이 지속되는 것으로 보입니다.
저자 기여
저자는이 작품의 유일한 기여자임을 확인하고 출판을 위해 승인했습니다.
자금 조달
이 간행물에 대한 작업은 Eugene M. 와 Ronnie Isenberg Professorship Endowment 의 기금으로 지원되었습니다. 저자에게 기업 지원이 제공되지 않았으며 상용 제품이 언급되거나 승인되지 않았습니다.
이해의 충돌 문
저자가 선언하는 연구가 수행되었의 부재에서 어떠한 상업 또는 금융 서비스를 제공하는 것으로 해석될 수 있는 잠재적인 이해의 충돌.
감사
저자는 감사하고 싶 Ms. 크리스틴 브라운에 대한의 준비 지원이 원고와 유진 M. 및 로 Isenberg 교수기금을 지원합니다.째쨀짚쨘쨍 쨘쨍짙쨍짝 쨘쨍짙쨍짝 쨘쨍짙째챠 쨈쨈. 근육을”강하게”만들기:운동,영양,마약. J.Musculoskelet. 뉴런. 상호 작용하십시오. 4, 165–174.
PubMed 추상|Google 학술검색
아브르,P.,멘데스,S.V.,Ceccatto,V.M. 및 Hirabara,S.M.(2017 년). 인간과 설치류의 지구력 운동에 반응하여 호기성 근육 적응에 의해 유도 된 위성 세포 활성화. 생명 과학. 170, 33–40. 도이:10.1016/j.lfs.2016.11.016
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Ali,S.,And Garcia,J.M.(2014). Sarcopenia,악액질 및 노화:진단,메커니즘 및 치료 옵션-미니 검토. 노인학 60,294-305. doi:10.1159/000356760
PubMed 추상|CrossRef 전체 텍스트|Google 학술검색
항상,S.E.,마틴,J.K.,Ouyang,J.,Chaudhrai,A.,및 Murlasits,Z.S. (2003). Id2 expression during apoptosis and satellite cell activation in unloaded and loaded quail skeletal muscles. Am. J. Physiol. Regul. Integr. Comp. Physiol. 284, R540–R549. doi: 10.1152/ajpregu.00550.2002
PubMed Abstract | CrossRef Full Text | Google Scholar
Andrianjafiniony, T., Dupre-Aucouturier, S., Letexier, D., Couchoux, H., and Desplanches, D. (2010). Oxidative stress, apoptosis, and proteolysis in skeletal muscle repair after unloading. Am. J. Phys. Cell Physiol. 299, C307–C315. doi: 10.1152/ajpcell.00069.2010
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Aravamudan,B.,Mantilla,C.B.,Zhan,W.Z. 및 Sieck,G.C.(2006). 쥐 격막 섬유의 근핵 도메인 크기에 대한 신경 분포 효과. J.Appl. Physiol. 100, 1617–1622. doi:10.1152/japplphysiol.쨈챘짹쨀째쩔징 쨈챘쩔짤 쨘쨍쨀쨩쩔징 쨈챘쩔짤 쨘쨍쨀쨩쩔징 쨈챘쩔짤 쨘쨍쨀쨩쩔징 쨈챘쩔짤 쨘쨍쨀쨩쩔징 쨈챘쩔짤 쨘쨍쨀쨩쩔징 쨈챘쩔짤 쨘쨍쨀쨩쨈쨈. (2018). Prepubertal 골격근 성장은 Pax7 발현 위성 세포 유래 근핵 기여를 필요로합니다. 개발 145:167197.쩔짭짹쨍짱쨘째쩍 짹쨍쨌짹쨍 쨉챨철쨌 32 짹챈 30,13 첸 쩔짙쩔징징쩔짙째챠쨉쨉()째챠째쨈쩌쩐(1688-7662 뚜렷한 근육 세포 사멸 경로는 중요한 질병 근병증의 쥐 모델에서 섬유 유형이 다른 근육에서 활성화됩니다. J. 근육 Res. 세포 Motil. 36, 243–253. doi:10.1007/s10974-015-9410-8
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Beaulaton,J.,and Lockshin,R.A.(1977). Anthereae polyphemus 와 manduca sexta(insecta,lepidoptera)의 intersegmental 근육의 정상적인 퇴행의 ultrasstructural 학문은 세포질 autophagy 의 특정한 참고를 가진. J. 모폴. 154, 39–57. doi:10.1002/jmor.1051540104
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Bentzinger,C.F.,von Maltzahn,J.,Dumont,N.A.,Stark,D.A.,Wang,Y.X.,Nhan,K.,et al. (2014). Wnt7a 는 개량한 근력의 결과로 myogenic 줄기 세포 운동성 및 engraftment 를 자극합니다. J. 셀 바이올. 205, 97–111. doi:10.1083/jcb.쨈챘짹쨀째쩔징 쨉청쨋처 쨘쨍쩔징 쨈챘쩔짤 쨘쨍쩔징 쨈챘쩔짤 쨘쨍쩔징 쨈챘쩔짤 쨘쨍쩔징 쨈챘쩔짤 쨘쨍쩔징 쨈챘쩔짤 쨘쨍쨈쨈. 노화와 함께 재생 실패에서 근육 줄기 세포의 중심 역할. 냇. 메드. 21, 854–862. doi:10.1038/nm.3918
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Bonaldo,P.,And Sandri,M.(2013). 근육 위축의 세포 및 분자 메커니즘. 디스. 모델. 기계화. 6, 25–39. doi:10.1242/dmm.쩔짤쨌짱쨘째쩍 짹쨍쨌짹쨍 쨉챨철쨌 32 짹챈 30,13 첸 쩔짙쩔징징쩔짙째챠쨉쨉()째챠째쨈쩌쩐(1688-7662 조직 특이 적 줄기 세포:골격근 위성 세포로부터의 교훈. 세포 줄기 세포 10,504-514. doi:10.1016/j.줄기.2012.04.001
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Bruusgaard,J.C.,Egner,I.M.,Larsen,T.K.,Dupre-Aucouturier,S.,Desplanches,D.,and Gundersen,K.(2012). 근육 하역 및 재 장전 중 근핵 수의 변화는 없습니다. J.Appl. Physiol. 113, 290–296. doi:10.1152/japplphysiol.나는 이것이 내가하는 일이 아니라는 것을 알고 싶다. (2008). 생체 내 시간 경과 현미경 검사는 근육 위축의 주 동안 뮤린 근핵의 손실을 나타내지 않습니다. J.Clin. 투자하십시오. 118, 1450–1457. doi:10.1172/JCI34022
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Bruusgaard,J.C.,Johansen,I.B.,Egner,I.M.,Rana,Z.A.,And Gundersen,K.(2010). 과부하 운동에 의해 획득 된 근핵은 비대를 선행하고 detraining 에 손실되지 않습니다. 프록. 나틀. 아카드. Sci. 미국 107,15111-15116. doi:10.1073/pnas.쨩챌쨋첨쨉챤쨌쨔첩짙:070-779-779 이러한 유형의 치료법은 질병의 발병을 예방하는 데 도움이 될 수 있습니다. 생체 내에서 연구 된 정상 마우스의 근육 섬유에서 핵의 수와 공간 분포. J.Physiol. 551, 467–478. doi:10.1113/jphysiol.나는 이것이 내가 할 수있는 일이 아니라는 것을 알고 있지만,나는 이것이 내가 할 수있는 일이 아니라는 것을 알고 있다고 생각한다. (1999). 인간 골격근 cytosols 는 type-II caspases 의 cytochrome c 의존성 활성화에 내화성이며 APAF-1 이 부족합니다. 세포 사멸은 다릅니다. 6, 256–261. 도이:10.1038/sj.cdd.4400489
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Cabric,M.,And James,N.t.(1983). 운동 훈련 및 훈련받지 않은 개 근육에 대한 형태 측정 분석. 오전. 제이 아낫. 166, 359–368. 도이:10.1002/아자.1001660309
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Cheema,N.,Herbst,A.,McKenzie,D.,and Aiken,J.m.(2015). 세포 사멸 및 괴사는 연령 유발 미토콘드리아 효소 적 이상에서 골격근 섬유 손실을 매개한다. 노화 세포 14,1085-1093. 도이:10.1111/아셀.12399
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Clarke,P.G.(1990). 발달 세포 사멸:형태 학적 다양성과 여러 메커니즘. 아낫. 에브리올. 181, 195–213.쨈챘짹쨀째쩔징 쨉청쨋처 쨘쨍쨍챕 쨈챘짹쨀째쩔징 쨈챘 쨘쨍쨍챕 쨈챘짹쨀째쩔징 쨉청쨋처 쨈챘짹쨀째쩍쨈쨈. 질병에서 낭비되는 근육:분자 메커니즘 및 유망한 치료법. 냇. Rev. 마약 Discov. 14, 58–74. doi:10.1038/nrd4467
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Duddy,W.J.,Cohen,T.,Duguez,S.,And Partridge,T.A.(2011). Disuse atrophy 의 모델로서 분리 된 근육 섬유:F-actin 을 정량화하는 방법 인 PhAct 를 이용한 특성 분석. 특급. 세포 Res.317,1979-1993. 도이:10.1016/j.yexcr.2011.05.013
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Dumont,N.A.,Wang,Y.X. 및 Rudnicki,M.A.(2015). 위성 세포 기능을 조절하는 내재적 및 외적 메커니즘. 개발 142,1572-1581. doi:10.1242/dev.114223
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Egner,I.M.,Bruusgaard,J.C.,Eftestol,E.,And Gundersen,K.(2013). 세포질 기억 기계장치는 신진대사 스테로이드에 일시적인 노출 후에 근육에 있는 하중 초과 비대를 오랫동안 원조합니다. J.Physiol. 591, 6221–6230. doi:10.1113/jphysiol.2013.264457
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Egner,I.M.,Bruusgaard,J.C.,And Gundersen,K.(2016). 위성 세포 고갈은 골격근에서 섬유 비대를 예방합니다. 개발 143,2898-2906. doi:10.1242/dev.134411
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Fitts,R.H.,Metzger,J.M.,Riley,D.A. 및 Unsworth,B.R. (1986). 폐기의 모델:hindlimb 서스펜션과 고정화의 비교. J.Appl. Physiol. 60, 1946–1953.쩔짤쨌짱쨘째쩍 짹쨍쨌짹쨍 쨉챨철쨌 32 짹챈 30,13 첸 쩔짙쩔징징쩔짙째챠쨉쨉()째챠째쨈쩌쩐(1688-7662 (2014). 질식 된 용어 신생아와 쥐의 시상에서 죽어가는 뉴런은 autophagic 입니다. 앤. 뉴롤. 76, 695–711. 도이:10.1002/아나.24257
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Goh,Q. 및 Millay,D.P.(2017). 골격근 비대에 대한 myomaker 매개 줄기 세포 융합의 요구 사항. 엘리프 6. 도이:10.7554/eLife.20007
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Gregory,T.R.(2001). 우연의 일치,공동 해결 또는 인과 관계? DNA 내용,세포 크기 및 C 값 수수께끼. 바이올. 목사 캠브. 필로스. Soc. 76, 65–101. doi:10.1017/s1464793100005595
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Guerci,A.,Lahoute,C.,Hebrard,S.,Collard,L.,Graindorge,D.,Favier,M.,et al. (2012). 근섬유에 의해 생성 된 Srf 의존성 파라 크린 신호는 위성 세포 매개 골격근 비대를 제어합니다. 세포 메탑. 15, 25–37. doi:10.1016/j.cmet.2011.12.001
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Gundersen,K.(2016). 근육 기억과 근육 위축과 비대에 대한 새로운 세포 모델. 제이 특급. 바이올. 219, 235–242. doi:10.1242/jeb.124495
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Gundersen,K.,And Bruusgaard,J.C.(2008). 근육 위축 중 핵 도메인:핵이 손실되거나 패러다임이 손실 되었습니까? J.Physiol. 586, 2675–2681. doi:10.1113/jphysiol.2008.154369
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Guo,B.S.,Cheung,K.K.,Yeung,S.S.,Zhang,B.T.,And Yeung,E.W.(2012). 전기 자극은 마우스에서 하역 유발 근육 위축에서 위성 세포 증식 및 세포 사멸에 영향을 미친다. PLoS 하나 7:e30348. doi:10.1371/저널.폰.0053523
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Jackson,J.R.,Mula,J.,Kirby,T.J.,Fry,C.S.,Lee,J.D.,Ubele,M.F.,et al. (2012). 위성 세포 고갈은 하역 유발 위축에 따른 성인 골격근 재성장을 억제하지 않습니다. 오전. J.Phys. 세포 Physiol. 303,C854-C861. doi:10.1152/ajpcell.00207.2012
PubMed 추상|CrossRef 전체 텍스트|Google 학술검색
Joubert,Y.,그리고 Tobin,C.(1995). 테스토스테론 처리는 쥐 levator ani 근육에 있는 세포 주기로 활성화되고 모집되는 고요한 인공위성 세포에 있는 유래합니다. 데브. 바이올. 169, 286–294. doi:10.1006/dbio.나는 이것이 내가 할 수있는 일이 아니라는 것을 알았습니다. 개구리의 근육 스핀들에있는 구 심성 신경 섬유의 말단. 필로스. 트랜스. R.Soc. 론드. 비 바이올. Sci. 243, 221–240.
PubMed Abstract|Google Scholar
Kletzien,H.,Hare,A.J.,Leverson,G.,And Connor,N.P.(2018). 혀 근육의 섬유 형태 및 수에 대한 세포 사멸의 연령 관련 효과. 근육 신경 57,E29-E37. 도이:10.1002/뮤스.25671
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Kole,A.J.,Annis,R.P. 및 Deshmukh,M.(2013). 성숙한 뉴런:생존을 위해 갖추고 있습니다. 세포 사멸 디스. 4:e689. 도이: 10.1038/cddis.2013.220
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Li,T.S.,Shi,H.,Wang,L.,And Yan,C.(2016). 쥐의 고정화 유도 근육 위축에서 위성 세포 증식 및 세포 사멸에 대한 골수 중간 엽 줄기 세포의 효과. 메드. Sci. 모니 트. 22, 4651–4660. doi:10.12659/MSM.898137
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Lockshin,R.A.,And Williams,C.M.(1965). 프로그램 된 세포 사멸-I.Pernyi silkmoth 의 intersegmental 근육에서 퇴행의 세포학. J. 곤충 Physiol. 11, 123–133. 도이: 10.1016/0022-1910(65)90099-5
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Longtine,M.S.,Barton,A.,Chen,B.,And Nelson,D.M.(2012). 라이브 셀 이미징을 보여줍 apoptosis 시작하는 로컬로 전파로에 걸쳐 syncytiotrophoblasts 에서의 기본 문화 human placental 융모 trophoblasts. 태반 33,971-976. doi:10.1016/j.태반.2012.09.013
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Mauro,A.(1961). 골격근 섬유의 위성 세포. 제이 바이오피스. 바이오켐. 사이톨. 9, 493–495.쩔짤쨌짱쨘째쩍 짹쨍쨌짹쨍 쨉챨철쨌 32 짹챈 30,13 첸 쩔짙쩔징징쩔짙째챠쨉쨉()째챠째쨈쩌쩐(1688-7662 임신 13-41 주에 villous trophoblast 에서 증식,분화 및 세포 사멸(annulate lamellae 및 핵 기공 복합체에 대한 관찰 포함). 태반 20,407-422. doi:10.1053/plac.1999.0399.
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
McCall,G.E.,Allen,D.L.,Linderman,J.K.,Grindeland,R.E.,Roy,R.R.,Mukku,V.R.,et al. (1998). 과부하 및 성장 호르몬/IGF-I 치료 후 쥐 soleus 에서 myonuclear 도메인 크기의 유지. J.Appl. Physiol. 84, 1407–1412.쩔짤쨌짱쨘째쩍 짹쨍쨌짹쨍 쨉챨철쨌 32 짹챈 30,13 첸 쩔짙쩔징징쩔짙째챠쨉쨉()째챠째쨈쩌쩐(1688-7662 (2007). 기계적 환기 유도 위축 동안 횡격막 근핵 도메인의 카스파 제 -3 조절. 오전. J.Respir. 치명타. 케어 메드. 175, 150–159. 도이:10.1164/rccm.200601-142OC
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Metter,E.J.,Talbot,La,Schrager,M. 그리고,Conwit,R.(2002). 건강한 남성의 모든 원인 사망률의 예측 인자로서의 골격근 강도. 제이 제론 톨. 비올. Sci. 메드. Sci. 57,B359–B365. 도이:10.1093/제로나/57.10.B359
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Minnaard,R.,Drost,M.R.,Wagenmakers,A.J.,van Kranenburg,G.P.,Kuipers,H.,and Hesselink,M.K.(2005). 패혈증 쥐의 골격근 낭비 및 수축 성능. 근육 신경 31,339-348. 도이:10.1002/뮤스.20268
PubMed 추상|CrossRef 전체 텍스트|Google Scholar
모스,F.P. (1968). 국내 닭에서 골격근의 정상적인 성장 동안 섬유의 치수와 핵의 수 사이의 관계. 오전. 제이 아낫. 122, 555–563. 도이:10.1002/아자.1001220308
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Murach,K.A.,Englund,D.A.,Dupont-Versteegden,E.E.,McCarthy,J.J.,And Peterson,C.A.(2018). 근핵 도메인 유연성은 골격근 섬유 비대에 대한 위성 세포 기여에 대한 엄격한 가정에 도전합니다. 앞. Physiol. 9:635. 도이:10.3389/fphys.2018.00635
CrossRef 전체 텍스트|Google Scholar
Nevalainen,M.,Kaakinen,M.,및 Metsikko,K.(2013). 골격 근섬유에서의 mRNA 성적표 및 번역 활동의 분포. 세포 조직 Res.353,539-548. doi:10.1007/s00441-013-1659-x
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
O’Leary,M.F.,Vainshtein,A.,Carter,H.N.,Zhang,Y.,And Hood,D.A.(2012). 세포 사멸 결핍 동물의 골격근에서 신경 분포 유발 미토콘드리아 기능 장애 및자가 포식. 오전. J.Phys. 세포 Physiol. 303,C447-C454. 도이:10.1152/ajpcell.00451.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Palumbo, C., Rovesta, C., and Ferretti, M. (2012). Striated muscle fiber apoptosis after experimental tendon lesion in a rat model. J. Anat. 221, 358–363. doi: 10.1111/j.1469-7580.2012.01554.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Qaisar, R., and Larsson, L. (2014). What determines myonuclear domain size? Indian J. Physiol. Pharmacol. 58, 1–12.
PubMed Abstract | Google Scholar
Ross, J. A., Levy, Y., Svensson, K. 그 결과,그 결과,그 결과는 다음과 같습니다. SIRT1 은 골격근 섬유에서 핵 수와 도메인 크기를 조절합니다. J. 셀. Physiol. 233, 7157–7163. doi:10.1002/jcp.26542
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Schiaffino,S.,Dyar,K.A.,Ciciliot,S.,Blaauw,B.,and Sandri,M.(2013). 골격근의 성장과 위축을 조절하는 메커니즘. FEBS J.280,4294-4314. 도이:10.1111/febs.12253
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Schmalbruch,H.,And Hellhammer,U.(1977). 위성 세포에 대한 특별한 참조가있는 성인 쥐 근육의 핵 수. 아낫. 레크. 189, 169–175. 도이:10.1002/아칸소.1091890204
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Schwartz,L.m.(2008). 골격근의 위축과 프로그램 된 세포 사멸. 세포 사멸은 다릅니다. 15, 1163–1169. doi:10.1038/cdd.나는 이것이 내가 할 수있는 일이 아니라는 것을 알고 있지만,나는 이것이 내가 할 수있는 일이 아니라는 것을 알고 있다고 생각한다. 근핵 도메인은 위축 또는 프로그램 된 세포 사멸 동안 골격근에서 유지되지 않습니다. 오전. J.Phys. 세포 Physiol. 311,C607-C615. doi:10.1152/ajpcell.쨈챘짹쨀째쩔징 쨈챘쩔짤 쨘쨍쨀쨩쩔챘짹쨀째쩔징 쨈챘쩔짤 쨘쨍쨀쨩쩔챘짹쨀째쩔징 쨈챘쩔짤 쨘쨍쨀쨩쩔챘짹쨀째쩍쨈쨈. 발달 적으로 프로그램 된 위축과 사망시 골격근의 수축 특성의 변화. 오전. J.Phys. 세포 Physiol. 282,C1270-C1277. doi:10.1152/ajpcell.쩔짤쨌짱쨘째쩍 짹쨍쨌짹쨍 쨉챨철쨌 32 짹챈 30,13 첸 쩔짙쩔징징쩔짙째챠쨉쨉()째챠째쨈쩌쩐(1688-7662 그리고 오스본,B.A.(1993). 모든 프로그램 된 세포 사멸은 세포 사멸을 통해 발생합니까? 프록. 나틀. 아카드. Sci. 미국 90,980-984.쩔짤쨌짱쨘째쩍 짹쨍쨌짱쨘쨍 쨉챨철쨌 32 짹챈 30,13 첸 쩔짙쩔징징쩔짙째챠쨉쨉()째챠째쨈쩌쩐(1688-7662 담배 hornworm Manduca sexta 에서 변성 발달 속도의 호르몬 조절. 데브. 바이올. 99, 103–114. 도이: 10.1016/0012-1606(83)90257-9
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Schwartz,L.M.,And Truman,Jw(1982). 곤충에 있는 근육 변성의 펩티드 그리고 스테로이드 규칙. 과학 215,1420-1421. 도이:10.1126/과학.6278594
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Smith,H.K.,Maxwell,L.,Martyn,J.A.,And Bass,J.J.(2000). 단기 고정화 후 성인 토끼 골격근의 핵 DNA 단편화 및 형태 학적 변화. 세포 조직 Res.302,235-241. doi:10.1007/s004410000280
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Smith,M.I.,Huang,Y.Y. 및 Deshmukh,M.(2009). 골격근 분화는 apoptotic 경로를 제한하기 위해 내인성 XIAP 를 불러 일으킨다. PLoS 하나 4:e5097. 도이: 10.1371/저널.폰.0005097
CrossRef 전체 텍스트/Google 학술검색
스타론,R.S.,알베르고 델 세나토,M.J.,Karapondo,D.L.,Malicky,E.S.,Falkel,J.E.,해거먼,C.F.,et al. (1991). Detraining 과 재교육 후 무거운 저항 훈련을받은 여성의 힘과 골격근 적응. J.Appl. Physiol. 70, 631-640.나는 이것이 내가 할 수있는 유일한 방법이라고 생각한다. 핵의 작용 영역과 세포 크기. 히스톨 베이트르. 5, 97-124.나는 이것이 내가 할 수있는 유일한 방법이라고 생각한다. 이러한 유형의 치료법은 질병의 발병을 예방하는 데 도움이 될 수 있습니다. 연령 의존성 세포 사멸 및 횡문근 세포의 손실. 제이 우롤. 164, 1781–1785. doi:10.1016/S0022-5347(05)67106-6
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Tedesco,F.S.,Dellavalle,A.,Diaz-Manera,J.,Messina,G.,및 Cossu,G.(2010). 골격근 복구:골격근 줄기 세포의 재생 잠재력. J.Clin. 투자하십시오. 120, 11–19. doi:10.1172/JCI40373
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Wada,K.I.,Takahashi,H.,Katsuta,S.,And Soya,H. (2002). 성숙한 마우스에서 장기 신경 분포 후 근핵 수의 감소는 없었다. 오전. J.Phys. 세포 Physiol. 283,C484–C488. doi:10.1152/ajpcell.00025.2002
CrossRef 전체 텍스트|Google 학술검색
Winje,M.I.,모리,X.,한손,K.A.,Solbrå,A.,Tennøe,S.,Saatcioglu,F.,et al. (2018a). 악액질은 생쥐에서 제노 이식 된 전립선 암 동안 근핵구 또는 근육 섬유의 손실을 유도하지 않습니다. Acta Physiol. e13204. 도이:10.1111/apha.쩔짤쨌짱쨘째쩍 짹쨍쨌짹쨍 쨉챨철쨌 32 짹챈 30,13 첸 쩔짙쩔징징쩔짙째챠쨉쨉()째챠째쨈쩌쩐(1688-7662 그 결과,그 결과,그 결과,그 결과,그 결과,그 결과,그 결과,그 결과,그 결과,그 결과,그 결과,그 결과,그 결과,그 결과,그 결과. 골격근 조직 섹션에서 pericentriolar 물질 1 에 대한 항체에 의한 myonuclei 의 특정 라벨링. Acta Physiol. 223:e13034. 도이:10.1111/apha.쨩챌쨋첨쨉챤쨌쨔첩짙:070-779-779-779-779-779-779-779-779-779-779-779-779-779-779-779-779-779-779-779-779 사르코페니아. 클린입니다. 노인병. 메드. 33, 305–314. 도이:10.1016/j.cger.2010.02.012
CrossRef 전체 텍스트|Google Scholar
Xiao,R.,Ferry,A.L. 및 Dupont-Versteegden,E.E.(2011). 분화 된 myotubes 의 세포 사멸 저항성은 myoblasts 와 비교하여 강화 된 항 apoptotic 메커니즘과 관련이있다. 아폽토시스 16,221-234. doi:10.1007/s10495-010-0566-9
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Yang,D.,Morris,S.F. 및 Sigurdson,L.(1998). Sartorius 근육:재건 외과 의사를위한 해부학 적 고려 사항. 수술 라디 올. 아낫. 20, 307–310. 도이:10.1007
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Zhong,H.,Roy,R.R.,Siengthai,B.,And Edgerton,V.R.(2005). 쥐 솔레 우스 근육에서 섬유 크기 및 근핵 수에 대한 비활성 효과. J.Appl. Physiol. 99, 1494–1499. doi:10.1152/japplphysiol.쩔짭짹쨍짱쨘째쩍 짹쨍쨌짹쨍 쨉챨철쨌 32 짹챈 30,13 첸 쩔짙쩔징징쩔짙째챠쨉쨉()째챠째쨈쩌쩐(1688-7662 (2010). Act RIIB 길항 작용에 의한 암 악액질과 근육 낭비의 역전은 장기간 생존을 유도합니다. 세포 142,531-543. doi:10.1016/j.세포.2010.07.011
PubMed Abstract|CrossRef 전체 텍스트|Google Scholar
Ziaaldini,M.M.,Marzetti,E.,Picca,A.,and Murlasits,Z.(2017). Sarcopenia 의 생화학 적 경로와 신체 운동에 의한 조절:서술 적 검토. 앞. 메드. 4:167. doi:10.3389/fmed.2017.00167
CrossRef 전체 텍스트|Google 학술검색