はじめに
数年間、Aeromonas sppの意義。 いくつかの研究では、細胞毒素の産生を含む多くの病原性因子が関与しているため、Aeromonasの病原性メカニズムは多因子性であることが示された(Castro-Escarpulli et al., 2002, 2003). これらの毒素は下痢または出血性大腸炎を引き起こす可能性があり、溶血性尿毒症症候群(HUS)およびTTP発症において主要な役割を果たし得る(Bogdanović et al. ら、1 9 9 1;Fang e t a l. ら、1 9 9 9;Monforte−Cirac e t a l., 2010).
これらの疾患に関与する細胞毒素には、志賀毒素および密接に関連するStxが含まれる。 Stx変異体は、赤痢菌、Enterobacter、Citrobacter、Acinetobacter、Campylobacter、およびHamiltonella細菌種において発現される(MauroおよびKoudelka、2 0 1 1)。 AlperiおよびFigueras(2010)は、Aeromonas sppの臨床分離株におけるStx1およびStx2の存在を記載した。、胃腸炎、出血性大腸炎およびHUSと関連付けられる。 これらの毒素をコードする遺伝子は、この株を溶解生成する異なるランブドイドバクテリオファージに位置している。 さらに、属AeromonasはOMVsと呼ばれるゼロ分泌システムを持っています。 OMVは、いくつかのタンパク質、RNA、ペリプラズム空間成分および病原性に関連する他の成分が、他の属に水平に移動され得る手段であり得る;したがって、omvは、病原性において重要な役割を果たすと考えられている(Guerrero−Mandujano e t a l.,2015a,b).
このため、本研究の目的は、Vero細胞培養におけるメキシコシティの子供から単離された株によるStxの産生による損傷を評価することであった。
材料および方法
株
この研究には、INPからの66の臨床分離株、腸から得られた54および腸外感染からの12が含まれていました。 上記の病院での定期検査のために得られた標本から株を単離したため、両親または子供の法定後見人からのインフォームドコンセントは必要なかった。 全ての株は、1 6S rDNA−RFLPによって遺伝的に同定された(Hernandez−Cortez e t a l., 2011). 陽性対照として、escherichia coli O1 5 7:H7CECT4 0 7 6の型付け株を使用し、medical Bacteriology Laboratory(Escuela Nacional d e Ciencias Biologicas,IPN)のコレクションからのe.coli K1 2株(5 5 1 2ENCCB)を毒素産生の陰性対照として使用した。 より長い貯蔵のために、それらを−7 0℃で2 0%(w/v)グリセロール−Todd−Hewitt broth(Oxoid,Mexico)中で凍結するか、または7中で凍結乾燥させた。5%の馬のブドウ糖の血清。各株のゲノムDNAは、製造業者によって提供される説明書に従って、InstaGene Matrix(BioRad(登録商標)、Mexico)を介して得られた。
DNA抽出
すべての培養物を、トリプ DNA純度および量は、Ampli Quant A Q−0 7分光光度計を用いて決定した。 DNAを使用するまで−2 0℃で保存した。
stx1およびstx2PCR増幅
OMVsおよびゲノムDNAのDNAからのstx1およびstx2の存在は、それぞれ144および217bp産物を有するプライマー STX1F/STX1RおよびSTXF/STXRを用いた単一PCR反応によって検出された。 (2 0 1 3)、陽性(e.coli O1 5 7:H7)および陰性(e.coli K1 2)対照を用いた。PURELINK Quick Gel Extraction Kit(Invitrogen(登録商標)、Mexico)を使用して、製造業者の説明書に従って精製した。</p><h3>DNA Sequencing</H3><p>Polymerase chain reaction生成物を精製した。 製造業者の説明書に従って、PCRに使用した順方向および逆方向プライマーを使用して、ABI−PRISM3 1 0Genetic Analyzer(Applied Biosystems,Foster City,C A,USA)上で、生成物を直接配列決定した。 配列決定は、Instituto d e Biologia,UNAM(Mexico)で行った。 シーケンス解析を行い、基本的な地方整合検索ツール(ブラスト)の国立バイオテクノロジー情報センター(NCBI).この手順は、10%v/vウシ胎児血清(FBS;Invitro®,Mexico)を補充した最小必須培地(MEM;Invitro®,Mexico)を添加し、80%コンフルエンスを有するVero(ATCC CCL81)細胞単層を有する96ウェルマイクロプ細胞懸濁液を均質化し、Neubauerチャンバーを用いて1 0 5〜1 0 6細胞/mlに調整した。</p><p>細胞懸濁液を均質化し、1 0 5〜1 0 6細胞/mlに調整した。 調整後、懸濁液を2 0 0μ Lウェル中に沈着させた。 マイクロプレートを3 7℃で5%CO2下で2 4時間インキュベートした(CO2Incubator,VWR Scientific,USA)(Giono−Cerezo e t a l., 1994).
無細胞細菌製剤
各血液寒天プレートからの五つのコロニーをクレイグ培地(0.4%酵母抽出物、3%カザミノ酸、0.05%K2HPO4)3mLに接種した。 これらを37℃で24時間インキュベートし、使用された細菌培養物の光学密度は600nmで0.25であった。 無細胞調製物は、培養物を14,000gで4℃で10分間遠心分離し、続いてメンブレンフィルター(細孔サイズ0.45pm、Sartorius Minisart NML)を通して上清を濾過することによっ このようにして合計6 6個の無細胞細菌調製物が得られ、陽性対照(E.coli O1 5 7:H7)および陰性対照(e.coli K1 2)も同様に得られた(Giono−Cerezo e t a l., 1994).
細胞傷害性アッセイおよびLD50測定
無細胞濾液(20μ l)を、細胞を含むウェルおよび抗生物質を含まないそれぞれの増殖培地に接種した。
無細胞濾液(20μ l)を、抗生物質を含まないウェルに接種した。 接種した細胞を96時間37℃で5%CO2でインキュベートし、倒立顕微鏡で24時間ごとに観察した。 細胞毒性効果は,厚い造粒を伴う細胞の丸めと収縮,そして最終的には単分子層の進行性および不可逆的破壊として現れることが期待された。 全ての試験を重複して実施した;MEMおよびCraig培地による生存率対照もまた実施した(Giono−Cerezo e t a l., 1994).
LD50は、Vero細胞における細胞傷害性損傷を引き起こす陽性として検出されたAeromonas株において決定された。 Vero細胞を含む標準9 6ウェルのマイクロプレートを、2.6に示されるように調製したが、培地を、1%BFSを含む1 0 0μ LのMEMに変更した。 この調製物を1 0 0μ lの無細胞細菌調製物に曝露し、連続希釈をプレートの列全体で行った。 3 7℃で5%CO2で2 4時間インキュベーションした後、倒立顕微鏡下でLD5 0を測定した。 LD5 0を、Vero細胞の5 0%が損傷し、5 0%が未損傷であるウェルに割り当てた(Marques e t a l., 1986).
封鎖および毒素の中和の試金
この損傷がStxの指標であるのでveroの細胞毒性の損傷を引き起こした緊張で毒素の中和の試金は行われました。 この試験のために、各無細胞細菌調製物のLD5 0と9 0〜1 0 0%の合流点まで成長させたVero細胞を用いて、マイクロプレートを調製した。 Stx作用の結果として産生された細胞損傷を示すための中和アッセイを行うために、大腸菌O1 5 7:H7から得られた2つのモノクローナル抗体(Universidad Nacional Autonoma d e Mexico)を使用した。
各Abについて、Bradfordタンパク質定量を製造業者の指示書(Biorad)に従って行い、抗Stx1および抗Stx2Aのそれぞれ78.2および74.8μ g/μ lの結果を得た。 次いで、1 0μ lのA B(抗STX1または抗STX2)を、1 9 0μ lの無細胞上清と共に、LD5 0の濃度で3 7℃で1時間インキュベートした。, 1986).
OMVs調達およびOMVsからのDNA抽出
外膜小胞は、Aeromonas hydrophila F-0050から得た。 このプロトコルは、Guerrero−Mandujanoらによって以前に記載されたように実施された。 (2015a)。Omvs’DNAは、製造業者によって提供される説明書に従って、Instagene Matrix(Biorad(登録商標)、Mexico)を介して得た。</p><p>OMVS’DNAは、製造業者によって提供される説明書に従っ 次いで、OMVS’DNAをDNA抽出フェノール−クロロホルム法(Guerrero−Mandujano e t a l.、2015b)。
結果
stx1およびstx2遺伝子PCR増幅
ポリメラーゼ連鎖反応スクリーニング66臨床Aeromonas株の22/66(33.3%)株はstx1遺伝子を含んでいたことを示した、42/66(63.6%)株は両方の遺伝子を含んでいた、ない株はstx2遺伝子のみを含んでいなかった、と2/66(3%)株は両方の遺伝子に対して陰性であった。BLASTn分析は、大腸菌O157:H7のstx-1/stx-2遺伝子とAeromonas sppからのアンプリコンとの間に79-99%の類似性と3e-16/2e-97の期待値を示した。
DNA配列決定
BLASTn分析は、大腸菌O157:H7のstx-1/stx-2遺伝子とAeromonas sppからのアンプリコンとの間に79-99%の類似性と3e-16/2e-97の期待値を示した。、株。
細胞毒性アッセイとLD50決定
Vero細胞培養で行われた細胞毒性試験では、17/66(25.7%)の無細胞細菌製剤が細胞毒性損傷を引き起こし、Stxによる特徴的な損傷によって明らかにされたアクティブなStx(図1)の産生を示唆していることが示された。
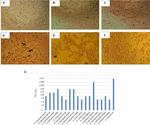
図1. 細胞毒性アッセイおよびLD50決定は、Vero細胞培養で行われます。 (A)最小限の必須培地を用いたVero細胞培養(生存率試験)。 (B)Craigmediumを用いたVero細胞培養(生存率試験)。 (C)e.coli K1 2による陰性対照。 (D)大腸菌O157:H7による陽性対照は、細胞単層の破壊および”古いレース”効果による細胞傷害性損傷が示されている(矢印)。 (E)A.hydrophila F−0 0 5 0株の細胞傷害性損傷。 (F)A.caviae4 2 1 4 2 3株の細胞傷害性損傷。 (G)全株のLD5 0力価のグラフ表示。LD50力価を決定するための結果は以下の通りであった:6/17(35.2%)無細胞細菌製剤は1:16の力価を示した;5/17(29.4%)無細胞細菌製剤は1:8の力価を示した;3/17(17.6%)無細胞細菌製剤は1:64の力価を示した;2/17(11.7%)無細胞細菌製剤は1:64の力価を示した。3 2;および1:2 5 6の力価を有する1/1 7(5.8%)の無細胞細菌製剤(図1G)。
毒素中和
11/17における抗STX1Abの適用(64。7%)株上清中の細胞への損傷は39.1μ g/μ l Ab濃度で完全に阻害され、4/17(23.5%)無細胞細菌製剤では同じ濃度で細胞損傷の減少が観察され、2/17(11.7%)無細胞細菌製剤では78.2μ g/μ lの濃度で細胞損傷が完全に阻害された。 Ab抗STX2を使用すると、9/17(52.9%)無細胞細菌製剤では、細胞損傷が37.4μ g/μ lで完全に阻害され、6/17(35.2%)無細胞細菌製剤では同じ濃度で細胞損傷が減少し、2/17(11.7%)無細胞細菌製剤では、細胞損傷は74.8μ g/μ lのAb濃度で完全に阻害された(図2および3)。

Aeromonas sppの無細胞細菌製剤によるVero細胞培養において誘導される細胞傷害効果の阻害。 stx1またはstx2遺伝子を保有する株。
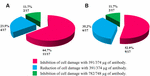
図3. 細胞損傷の阻害または減少を示した株の割合。 (A)抗Stx1Abによる中和。 (B)抗Stx2Abによる中和。
omvsからのstx1遺伝子PCR増幅
A.hydrophila F-0050のOMVs’DNAのポリメラーゼ連鎖反応は、omvsにstx1遺伝子が含まれていることを明らかにした;したがって、OMVsは水平病原性遺伝子移入のための潜在的なビヒクルである可能性がある(図4)。
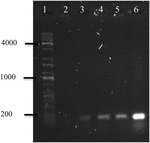
図4. OMVs’DNAからのstx1遺伝子増幅の電気泳動図。 (1)Kapa Universal Ladder、(2)陰性対照、(3)A.hydrophila F−0 0 5 0のOmv、(4)A.hydrophila F−0 0 5 0のOmv、(5)e.coli O1 5 7のOmv、(6)A.hydrophila F−0 0 5 0のomv。:および(6)e.coli O1 5 7:H7。Stxの生産者としてのAeromonas属は、主に小児患者に下痢を引き起こす創発性病原体である可能性がある(Hernández-Cortez et al. ら,2 0 1 1;FiguerasおよびBaez−Idalgo,2 0 1 4)。 それにもかかわらず、この属は、HUSを引き起こす病原体であるため、医療分野においてより関連性が高まっている(San Joaquín and Pickett,1988;Bogdanović et al. ら、1 9 9 1;Robson e t a l. ら、1 9 9 2;Fang e t a l. ら、1 9 9 9;Monforte−Cirac e t a l., 2010).本研究では、stx1およびstx2遺伝子のPCR増幅により、22/66(33.Aeromonad株の3%)はstx1遺伝子を含み、42/66(63.6%)株は両方の遺伝子を含み、stx2のみを含む株はなかった。 このことから,この遺伝子は小児患者から単離されたAeromonas株に広く分布しており,これらの患者はHUSを発症するリスクがあることが示唆された。
Stx遺伝子がスペインの異なる病院から単離されたAeromonas株で研究された唯一の以前の報告があり、得られた結果は19/80(23.7%)株がstx1遺伝子を有し、1/80(1.2 5%)株は両方の遺伝子に対して陽性であった(Alperi and Figueras,2 0 1 0)。 これらの結果は,メキシコ株における遺伝子の分布がより大きいことを示しているが,スペインではAeromonas属は胃腸プロファイルを有する患者において日常的に単離された既知の胃腸病原体であることを考慮すべきであり,したがって,この属に立ち向かうために適切な治療が与えられている。
メキシコでは、この属は下痢を引き起こす病原体のリストに含まれておらず、日常的に単離されていません; その結果、患者に治療と良好な生活の質を与えることは困難であり、さらに、その有病率に関する統計はない。 さらに、この属は、水不足を含むメキシコの人口の社会経済的条件のためにより関連性が高くなり、これはその伝達を容易にし、HUSが公衆衛生上の問題になる可能性を増加させる。
アンプリコンの配列決定を行い、Blast検索を行い、大腸菌O157:H7と比較して79-99%の類似性と遺伝子stx1/stx2の間の3e-16/2e-97の期待値を示した。
LD50は、Vero細胞培養における細胞傷害性損傷を評価するために決定された;このパラメータを用いて、Marques et al. (1986),株は、低(2×101へ6×102),中程度(103-104),高(105-108)生産にグループ化することができます(図1G). Marques et al. (1986)は、彼らが本研究のそれと同様のアッセイを行った研究を行ったが、STECの異なる株で、彼らは262/400(63%)株が低Stx生産者としてグループ化され、48%が細胞傷害性; それにもかかわらず、これらの株の40%において、細胞傷害性損傷は抗Stx抗体で阻害された。
本研究では、無細菌製剤の25.7%がVero細胞におけるStxの特徴的な細胞傷害性損傷を引き起こし、活性Stxの産生を示唆し、すべてのAeromonas株はStxの低生産者とし 細胞損傷が減少した無細胞上清は、上清中に存在する毒素中の二つの変異体のためであった可能性があり、結果的に、それらは免疫学的に異なるので、Stxは完全に阻害されることができず、細胞損傷が残っていた(Marques et al., 1986).
二つの以前の研究(Haque et al. 1996;Alperi and Figueras,2010)は、それぞれ10.2%および10.53%のStx1産生Aeromonas株を得た。 活性Stxを産生するAeromonas株の割合が高い理由は、StxバクテリオファージのいくつかのSTEC株キャリアが処理場からの都市排水、屠殺場からの排水および牛の便から単離されているため、培養内のStxバクテリオファージの可用性が高いためである可能性がある(García-Aljaro et al., 2004, 2009). 同様に形質導入研究は、腸内微生物叢細菌に感染することができ、以前に感染していなかった株に毒素原性の特徴を与える大腸菌由来のStxファージを用いて、インビボで実施されている(Acheson e t a l.,2 0 0 2)。 ら、1 9 9 8;Schmidt e t a l. ら、1 9 9 9;Gamage e t a l., 2003). 胃腸プロファイルを誘導するときに同じことがAeromonas属で起こる可能性があり、aeromonas属がそのゲノムに病原性因子を捕捉して統合する能力を有し、そのうちの一つがStxをコードする遺伝子であるという事実が続く。
株の残りの部分は、おそらくStx以外の異なる毒素の産生を示唆し、細胞内の細胞分裂損傷を引き起こしました,aeromonasは二つの細胞分裂性エンテロトキシンを産生することができる属であるため、,thermostable(AST)とthermolabile(ALT)(Figueras and Baez-Hidalgo,2014),これは、Vero細胞に細胞分裂損傷を引き起こす可能性があります; 別の可能性は、二重溶解生成を有するSTEC株がバクテリオファージを調節して溶解サイクル誘導の能力を阻害することが実証されているため、Aeromonas株がゲノムに複数のバクテリオファージを挿入していることである(García-Aljaro et al. ることを示した。 したがって、Stxバクテリオファージの存在とStxの産生される量を相関させるためには、本研究を含めて、Aeromonas株に含まれるバクテリオファージの数を確立する
一方、誘導性エアロモナスにおけるStxバクテリオファージの存在は、stx遺伝子の水平移動機構を表すが、それだけではない。 より最近の研究では、アエロモナスがOmvを産生することができることが決定されている(Guerrero−Mandujano e t a l. これらのOmvは、集積DNAを輸送することが可能である(Guerrero−Mandujano e t a l.,2 0 1 5a)。、2015b)。 本研究では、臨床起源の一つのA.hydrophila株のOMVsから抽出されたDNAからstx1遺伝子を増幅し、Vero細胞に細胞傷害性損傷を誘導し、この損傷は抗Stx抗体で阻害された。 これは、Stxバクテリオファージがstx遺伝子の輸送機構であることを示しており、さらに、OMVsおよび最近呼ばれる輸送システムタイプ0は、stx遺伝子の種間ま それにもかかわらず、OMVsに含まれる遺伝子が完全であるかどうかを確認する必要があります。 本研究で得られた結果は、stx遺伝子がOMVsを介して転送されるかもしれないAeromonasの別の推定病原性因子であるという仮説を支持する。 これは、他のAeromonas株および/または他の細菌属へのstx遺伝子の水平輸送のための別のメカニズムを表すことができます。このため、この属は、原因物質を特定しようとするときに胃腸炎の可能性のある原因物質として含まれるべきであり、標準的な健康監視手順の一部と
著者の貢献
IP-MとAG-Mは実験を行い、MR-Rはバイオインフォマティクス分析を行い、原稿を起草しました。CH-Cはプライマーを設計し、VB-G、JM-Lは批判的に原稿をコメントし、改訂しました。GC-Eは研究を考案し、その設計と調整に参加し、データを評価し、原稿を起草しました。 すべての著者が最終原稿を読み、承認しました。 私たちは、親切に原稿のスタイルを修正するためのソフィアMarteli Muliaに感謝したいと思います。
資金調達
GC-EおよびVB-Gは、Estímulos al Desempeño en InvestigaciónおよびComisión y Fomento de Actividades Académicas(Instituto Politécnico Nacional)およびSistema Nacional de Investigadores(SNI、CONACyT)から支援を受けました。 この研究は、国立工科大学(SIP20160609)の研究と大学院の事務局によって資金を供給されました。 SIP-IPNは、研究デザインの開発、データの収集、分析、解釈、報告書の執筆、出版のための論文の提出の決定には関与していませんでした。 IP-MとAG-MはCONACyTとBEIFIから奨学金を受けました。
利益相反に関する声明
著者らは、この研究は、利益相反の可能性と解釈される可能性のある商業的または財政的関係がない場合に行われたと宣言している。
謝辞
私たちは、株分離株を提供するための博士Patricia Arzate Barbosaとモノクローナル抗体を提供するための博士Armando Navarroに感謝します。Ab,抗体;HUS,溶血性尿毒症症候群;INP,Instituto Nacional de Pediatria Mexico;LD50,致死量中央値; OMVs, Outer membrane vesicles; PCR, Polymerase chain reaction; STEC, Shiga toxin-producing E. coli; Stx, Shiga-like toxin; TTP, Thrombotic thrombocytopenic purpura.
Acheson, D. W., Reidl, J., Zhang, X., Keusch, G. T., Mekalanos, J. J., and Waldor, M. K. (1998). In vivo transduction with shiga toxin 1-encoding phage. Infect. Immun. 66, 4496–4498.
Google Scholar
Alperi, A., and Figueras, M. J. (2010). Aeromonasのヒト分離株は、志賀毒素遺伝子(stx1およびstx2)を有し、大腸菌の橋毒性遺伝子変異体と非常に類似している。 クリン ミクロビオール 感染した 16, 1563-1567. ドイ:10.1111/j.1469-0691.2010.03203.x
CrossRef全文/Google Scholar
Bogdanovic,R.,Šobeljić,M.,Markovic,M.,Nikolic,V.,Ognjanović,M.,Sarjanović,l.,et al. (1991). Aeromonas hydrophila腸炎に関連する溶血性尿毒症症候群。 小児科 ネフロール 5, 293-295. 土井:10.1007
CrossRef全文|Google Scholar
Castro-Escarpulli,G.,Aguilera-Arreola,M.G.,Giono-Cerezo,S.,Hernández-Rodríguez,C.H.,Rodriguez-Chacon,M.,soler,F.L.,ET AL. (2002). 属Aeromonas>メキシコの重要な病原体ですか? エンフ インフェック マイク 22, 206–216.
Google Scholar
Castro-Escarpulli,G.,Figueras,M.J.,Aguilera-Arreola,M.G.,Soler,L.,Fernández-Rendón,E.,Aparicio,G.O.,et al. (2003). Aeromonas sppの特性評価。 メキシコで人間の消費を目的とした冷凍魚から分離されました。 Int. J.食品マイクロバイオール。 84, 41–49. doi:10.1016/S0168-1605(02)00393-8
CrossRef全文/Google Scholar
Fang,J.S.,Chen,J.B.,Chen,W.J.,Hsu,K.T.(1999). Aeromonas hydrophila腸炎を有する成人男性における溶血性尿毒症症候群。 ネフロール ダイヤル 移植だ 14, 439–440. doi:10.1093/ndt/14.2.439
CrossRef全文|Google Scholar
Figueras,M.J.,And Baez-Hidalgo,R.(2014). 「Aeromonas」、Encyclopedia o f Food Microbiology,eds C.
Gamage,S.D.,Strasser,J.E.,Chalk,C.L.,And Weiss,A.A.(2003). 非病原性大腸菌は志賀毒素の産生に寄与することができる。 感染した イムン 71, 3107–3115. 土井:10.1128/IAI.71.6.3107-3115.2003
CrossRef全文|Google Scholar
García-Aljaro,C.,Muniesa,M.,Jofre,J.,And Blanch,A.R.(2004). 水生環境からの大腸菌群におけるstx2遺伝子の有病率。 Appl. エンビロン ミクロビオール 70, 3535–3540. ドイ:10.1128/AEM。70.6.3535-3540.2004
CrossRef全文|Google Scholar
García-Aljaro,C.,Muniesa,M.,Jofre,J.,And Blanch,A.R.(2009). 環境大腸菌株から誘導された、stx2を運ぶバクテリオファージの間で遺伝子型および表現型の多様性。 Appl. エンビロン ミクロビオール 75, 329–336. ドイ:10.1128/AEM。01367-08
CrossRef全文/Google Scholar
Giono-Cerezo,S.,Rodríguez-Ángeles,M.G.,Rodríguez-Cadena,M.J.,And Valdespino-Gómez,J.L.(1994). Vero細胞培養および固相ハイブリダイゼーション(コロニーブロット)による大腸菌のエンテロトキシンおよび細胞毒素の同定。 ラティーノ-ラティーノ-ラティーノ-ラティーノ ミクロビオール 36, 231–241.
Google Scholar
Guerrero-Mandujano,A.,López-Villegas,E.O.,Longa-Briseño,A.,And Castro-Escarpulli,G.(2015a). Aeromonas hydrophilaの臨床株における外膜小胞の産生。 エクリプス所属。 1, 113–117.
Google Scholar
Guerrero-Mandujano,A.,Palma-Martínez,I.,And Castro-Escarpulli,G.(2015b). Aeromonas hydrophilaの外膜小胞によってDNAを輸送する。 エクリプス所属。 2, 354–357.
Google Scholar
Haque,Q.M.,Sugiyama,A.,Iwade,Y.,Midorikawa,Y.,And Yamauchi,T.(1996). Aeromonas sppの下痢および環境分離株。 志賀様毒素1に類似した毒素を産生する。 カー ミクロビオール 32, 239–245. doi:10.1007/s002849900043
CrossRef全文|Google Scholar
Hernández-Cortez,C.,Aguilera-Arreola,M.G.,Chávez-Méndez,Y.,Arzate-Barbosa,P.,Lara-Hernandez,A.,そして、castro-escarpulli、g.(2011)。 Aeromonas sppの株の遺伝的同定。 国立小児科研究所で隔離されています。 エンファー牧師 ——— 小児科… 24, 157–165.
Google Scholar
Hernández-Cortez,C.,Méndez-Tenorio,A.,Aguilera-Arreola,M.G.,And Castro-Escarpulli,G. (2013). 胃腸疾患を引き起こす細菌を検出するための四つの多重ポリメラーゼ連鎖反応の設計と標準化。 Afr. J.Microbiol. 7,2673-2681 doi:10.5897/AJMR2013.5452
CrossRef全文/Google Scholar
Imamovic,L.,And Muniesa,M.(2011). 牛肉およびサラダにおける志賀毒素をコードするバクテリオファージの感染性の定量化および評価。 Appl. エンビロン ミクロビオール 77, 3536–3540. ドイ:10.1128/AEM。02703-10
CrossRef全文|Google Scholar
Marques,L.R. とができることを明らかにした。 大腸菌による志賀様毒素の産生。 J.インフェクトス… Dis。 154, 338–341. doi:10.1093/infdis/154.2.338
CrossRef全文/Google Scholar
Mauro,S.A.,And Koudelka,G.B.(2011). 志賀毒素:発現、分布、および環境におけるその役割。 3,608-625 doi:10.3390/toxins3060608
CrossRef全文|Google Scholar
Monforte-Cirac,M.L.,Palacian-Ruiz,M.P.,Aisa-Iriarte,M.L. およびEspuelas-Monge、M.(2010)。 Aeromonasによる溶血性尿毒症症候群:臨床例について。 クリン牧師 スピリット 210, 206–207. 土井:10.1016/j.cer.2009.08.002
CrossRef全文/Google Scholar
Robson,W.L.M.,Leung,A.K.C.,And Trevenen,C.L.(1992). Aeromonas hydrophila腸炎に関連する溶血性尿毒症症候群。 小児科… ネフロール 6, 221–222. doi:10.1007
CrossRef全文/Google Scholar
San Joaquin,V.H.,And Pickett,D.A.(1988). 小児におけるAeromonas関連胃腸炎。 小児科 感染した Dis。 J.7,53-57. doi:10.1097/00006454-198801000-00013
CrossRef全文|Google Scholar
Schmidt,H.,Bielaszewska,M.,And Karch,H.(1999). 大腸菌O157:H7から単離された志賀毒素2コードバクテリオファージf3538の誘導体と腸溶性大腸菌の形質導入。 Appl. エンビロン ミクロビオール 65, 3855–3861.