正常な細胞代謝は、血液phの維持に依存する非常に狭い限界(7.35-7.45)以内である。
この正常なpHの範囲の外の比較的穏やかなexcursionsはティッシュへの減らされた酸素配達、electrolytedisturbancesおよび心筋のcontractilityの変更を含むdeleteriouseffectsを、持つことができます;存続israre血pHが6.8の下に下るか、または7.8の上に上昇すれば。メカニズムこの問題を克服し、正常な血液pHを維持するのに役立ちます(すなわち、酸-塩基恒常性を維持する)は、血液中の化学バッファー、血液中を循環する赤血球(赤血球)、および肺、腎臓および脳の機能を含む複雑な相乗作用である。
これらの五つの要素が血液pHの全体的な維持にどのように寄与するかを説明する前に、いくつかの基本的な概念をすばやく見直すことが役立酸とは何ですか、塩基とは何ですか、pHとは何ですか?
酸とは何ですか?
酸は、溶液中で解離すると水素イオン(H+)を放出する物質である。たとえば
: 塩酸(HCl)は水素イオンと塩化物イオンに解離します
HCl![]() H++Cl-
H++Cl-
炭酸(H2CO3)は水素イオンと重炭酸イオンに解離します
H2CO3![]() H++HCO3–
H++HCO3–
塩酸のような強酸と炭酸のような弱酸を区別します。 違いは、強い酸弱い酸よりも解離する。 その結果,強酸の水素イオン濃度は弱酸のそれよりもはるかに高い。
塩基は溶液中で受容する物質である水素イオン。例えば、塩基重炭酸塩(HCO3–)は、炭酸を形成するために水素イオンを受け入れる:
HCO3–+H+![]() H2CO3
H2CO3
pHは、酸性度とアルカリ性の0-14のスケー 純粋な水は7のpHを持ち、中立(酸性アルカリ)ではないです。 アルカリ7isの上のそして酸性7の下のpH。 したがって、血液のpH(7.35-7.45)はわずかにアルカリ性ですが、臨床医学では、おそらく紛らわしいことに、血液pHが7より大きいために予約されています。45そして言葉のアシドーシスは血pHのために7.35よりより少し予約されます。pHは水素イオン濃度(H+)の測定値です。
pHは水素イオン濃度(H+)の測定値です。
この式から
pH7.4=H+40nmol/Lの濃度
pH7.0=h+100nmol/Lの濃度
pH6.0=H+1000nmol/Lの濃度
ph6.0=H+1000nmol/Lの濃度
pH7.4=H+40nmol/Lの濃度
pH7.0=h+1000nmol/Lの濃度
pH7.0=h+1000nmol/Lの濃度
pH7.0=h+1000nmol/Lの濃度
pH7.0=h+1000nmol/Lの濃度
pH7.0=h+1000nmol/Lの濃度
pH7.0=H+1000nmol/Lの濃度
pH7.0=H+1000nmol/Lの濃度
それは明らかである:
- 二つのパラメータは反比例して変化します; 水素イオン濃度が増加するにつれてpHが低下する
- 対数関係のために、水素イオン濃度の大きな変化は実際にはpHの小さな変化です。 -重炭酸塩の緩衝システム
緩衝は酸が水素イオンを”拭くことによって”加えられるとき起こるpHのthechangeを最小にする解決の化学薬品です。 緩衝液は、弱酸の溶液であり、その共役塩基。 血液中では、原理的な緩衝系は弱い酸、炭酸(H2CO3)およびその共役塩基、重炭酸塩(HCO3–)である。 HowthisシステムがpHの変更を最小にする説明するためには、私達が重炭酸塩の緩衝に強い酸、例えばHClを、加えることを仮定しなさい:
酸は水素イオンを解放し、解離する:
HCl
 H++Cl–
H++Cl–重炭酸塩の緩衝はそれから水素イオンを吸収し、プロセスのcarbonic酸を形作る:
HCO3–+H+
 H2CO3(炭酸)
H2CO3(炭酸)重要な点は、HClhaveからの水素イオンが弱い炭酸に組み込まれているため、溶液中の水素イオンの総数は容易に解離しないため、phはバッファがない場合に発生するほど変化しないということである。
緩衝液はph変化を大幅に最小限に抑えますが、弱酸(炭酸など)でもある程度解離するので排除しません。 緩衝液のpH溶液は、弱酸とその共役塩基の相対濃度の関数である。Henderson-Hasselbalch方程式として知られているこの関係は、pHが塩基(HCO3-)濃度と酸(H2CO3)濃度の比によって支配されることを示しています。
pH=6.1+log(/)
ここで、=炭酸塩の濃度
=炭酸の濃度Henderson–Hasselbalch方程式として知られているこの関係は、pHが塩基(HCO3-)濃度と酸(H2CO3)濃度の比によって支配されることを示しています。
水素イオンが重炭酸塩緩衝液に添加されるように:
H++HCO3–
 H2CO3
H2CO3重炭酸塩(塩基)が消費され(濃度が低下する)、カルボン酸が生成される(濃度が増加する)。 水素イオンが添加され続けると、すべての重炭酸塩は最終的に(炭酸に変換される)beconsumedになり、nobuffering効果があります–より多くの酸が添加された場合、pHは急激に
但し、炭酸がシステムから絶えず取除かれ、重炭酸塩が絶えず再生すれば、thebuffering容量および従ってpHは水素イオンのdespitecontinued付加維持できます。
の生理学のより詳細に明らかになるように酸-塩基バランス、すなわち、実際には、体内で何が起こるか。 Inessence、肺は炭酸の取り外しを(carbondioxideとして)保障し、腎臓は連続的な再生のofbicarbonateを保障します。
肺のこの役割は、重炭酸塩緩衝系の特異的特性に依存しており、それは炭酸が二酸化炭素および水に変換される能力である。
次の式は、それがthebodyで動作するように重炭酸塩緩衝システムの対立要素の関係を概説します
H++HCO3–
 H2CO3
H2CO3 h2O+CO2
h2O+CO2リバーシブル。方向は各要素の相対濃度に依存します。 したがって、例えば、炭素二酸化濃度の上昇は、炭酸および最終的に水素イオンの形成を増加させて左への反応を強制する。
これは、二酸化炭素の酸性電位を説明し、肺と赤血球が全体的な酸ベースランスにする重要なcontributionに私たちをもたらします。
肺機能、CO2および酸ベースバランスの輸送
正常な酸ベースバランスに不可欠な血液中のCO2の一定量は、組織細胞代謝の結果として産生されたものと肺によって排泄されたものとの間のバランスを反映している。
二酸化炭素が排出される速度を変化させることにより、肺は血液の二酸化炭素含有量を調節する。組織中の二酸化炭素生成から期限切れの空気中での除去までの一連の事象を図に記載する。 1.二酸化炭素は、組織細胞から周囲の毛細血管の血液に拡散する(図10)。 1a)。 小さな割合は血プラズマに溶解し、変化せずに肺に輸送される。しかし、ほとんどの拡散それは炭酸を形成するために水と結合する赤血球に。
しかし、それは炭酸を形成するために水と結合します。
しかし、酸は水素イオンの生成とともに解離し、炭酸塩。 水素イオンは脱酸素化されたヘモグロビン(ここではヘモグロビンが緩衝剤として作用している)と結合し、細胞pHの危険な低下を防ぎ、重炭酸塩は赤血球から血漿に濃縮された濃度に沿って拡散する。
したがって、組織中に産生された炭素二酸化物の大部分は、血漿中の重炭酸塩として肺に輸送される。
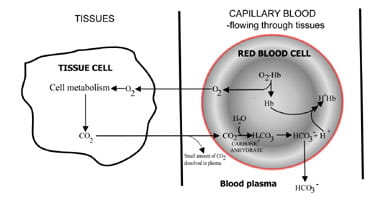
図。 1a.組織で生産されたCO2肺への輸送のために重炭酸塩に変換された。
- O2 oxygen
- CO2 carbon dioxide
- H2CO3 carbonic acid
- HCO3- bicarbonate ions
- H+ hydrogen ions
- Hb hemoglobin
- H+Hb reduced hemoglobin
(hemoglobin acting as a buffer) - O2 – Hb oxyhemoglobin
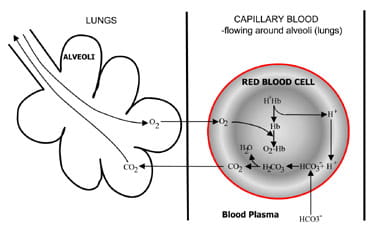
Fig. 1b. At the lungs bicarbonate convertedback to CO2 and eliminated by the lungs.
肺の肺胞では、プロセスが逆転する(図。 1b)。水素イオンは空気中の酸素を吸収するため、ヘモグロビンから移動します。 水素イオンは現在、プラズマから赤血球に拡散する炭酸塩によって緩衝され、炭酸酸が形成される。 これの濃度が上昇するにつれて、それは水と二酸化炭素に変換されます。 最後に、二酸化炭素は期限切れの空気のforexcretionに赤い細胞からの肺胞への集中勾配の下で拡散します。
脳幹の呼吸器化学受容体は、血液中の二酸化炭素濃度の変化に応答し、二酸化炭素濃度が上昇すると換気(呼吸)が増加し、二酸化炭素が低下すると換気が減少する。
腎臓と酸-塩基バランス
正常な細胞代謝は連続的に結果水素イオンの生成。 我々は、これらの水素イオンと組み合わせることによって、血液中の重炭酸塩緩衝液がそれらの効果を最小限に抑えることを見た。 しかし、緩衝は短期的にのみ有用であり、最終的には水素イオンを体内から除去しなければならない。さらに、使用される重炭酸塩緩衝水素イオンは連続的に置換される。
これらの2つの課題、水素イオンの除去および重炭酸塩の再生は、腎臓によって完了する。 腎尿細管細胞は、炭素の形成を容易にする酵素炭酸脱水酵素が豊富である二酸化炭素および水からの酸。 炭酸は炭酸塩と水素イオンを解離させる。 重炭酸塩はに再吸収されます血液と水素イオンは尿細管の内腔に入り、尿中の体内から排除されます。
この尿の排泄は、緩衝液、主にリン酸塩およびアンモニアイオンの尿中の存在に依存する。
酸-塩基バランスの障害
ほとんどの酸-塩基障害は、酸-塩基恒常性に正常な機能が必要な臓器(腎臓、肺、脳)への疾患または損傷、恒常性メカニズムが圧倒されるような代謝酸の産生が異常に増加する疾患
- 医学的介入(例えば、酸-塩基の恒常性メカニズムが必要である)に起因する。 機械換気、いくつかの薬)
動脈血ガスは、特定するために使用される血液検査であり、monitor酸-塩基障害。 血液ガス分析中に測定された三つのパラメータ、動脈血pH(pH)、動脈血中の二酸化炭素分圧(pco2(a))および重炭酸塩(HCO3–)の濃度は、重要である(参照(正常)範囲については表Iを参照)。これらの三つの結果は、四つの病因のカテゴリのいずれかに酸ベースの障害の分類を可能にします:
- Respiratory acidosis
- Respiratory alkalosis
- Metabolic acidosis
- Metabolic alkalosis
|
Adults |
Neonates |
|
|
pH |
7.35-7.45 |
7.30-7.40 |
|
pCO2 (kPa) |
4.7-6.0 |
3.5-5.4 |
|
Bicarbonate |
22-28 |
15-25 |
TABLE I. おおよその参照(正常)範囲
pH、pco2(a)および重炭酸塩の結果がこの中の酸-塩基擾乱を分類するためにどのように使用されるかを理解するために、Henderson-Hasselbalch方程式
pH=6.1+log(/)
phおよび重炭酸塩を測定するが、炭酸(H2CO3)は測定しない。 しかし、血液ガス分析中に測定された三つのパラメータ(pH、pco2(a)と炭酸塩)のヘンダーソン-ハッセルバルチ方程式のintermsの再表現を可能にするh2Co3とpco2(a)とH2Co3の間に関係がある。
pH=6.1+log(/(pco2(a)×0。23))
この式からすべての定数を削除することにより、三つの測定されたパラメータ間の関係をより単純にすることができます。
pH≤/pco2(a)
この関係は、酸塩基障害に関するすべてのことを理解するために重要であり、動脈血液pHは重炭酸塩濃度とpco2(a)の比に比例すると述べている。 PCO2(a)が正常である限り、pHは正常のままです。pco2(a)が増加するか、またはpCO2(a)が減少すると、pHが増加します(つまりアルカローシスが発生します)。
酸-塩基障害は、主にいずれかに影響を与えますpco2(a),その場合には、それが呼気障害と呼ばれています,または,その場合には、それが呼気またはmetabolicdisturbance:
- 一次障害が上昇したpco2(a)(アシドーシスを引き起こす–上記参照)の場合、状態は呼吸性アシドーシスと呼ばれます
- 一次障害が減少したpco2(a)(アルカローシスを引き起こす–上記参照)の場合、状態は呼吸性アルカローシスと呼ばれます
- 一次障害が減少した重炭酸塩(アシドーシスを引き起こす–上記参照)の場合、状態は代謝性アシドーシスと呼ばれます
- 一次障害が減少した重炭酸塩(アシドーシスを引き起こす–上記参照)の場合、状態は代謝性アシドーシスと呼ばれます
- 一次障害が減少したpco2(a)(アルカローシスを引き起こす-上記参照)の場合、状態は呼吸性アルカローシスと呼ばれます
- 一次障害が減少した重炭酸塩(アシドーシスを引き起こす-上記参照)の場合隆起した重炭酸塩(アルカローシスをもたらす-上記を参照)に関連して、状態は以下のように呼ばれる 代謝性アルカローシス
酸-塩基障害の原因
呼吸性アシドーシス–(pco2(a)の上昇、pHの低下)
呼吸性アシドーシスは、不十分な肺胞換気(低換気)に起因するpco2(a)の増加、およびその結果として血液からのco2の排除の減少を特徴とする。 呼吸器疾患、such asbronchopneumonia、気腫、喘息および慢性閉塞性airwaysdiseaseはすべてhypoventilationの十分なtocauseの呼吸のアシドーシスと、関連付けられるかもしれません。
いくつかの薬(例えば モルヒネのandbarbituratesは頭脳でtherespiratory中心を憂鬱にすることによって)呼吸のアシドーシスを引き起こすことができます。 胸壁への損傷か外傷呼吸の機械工にかかわるmusculature mayreduceの換気率。 これは呼吸性酸性症を説明するそれは、ポリオ、ギラン-バレー症候群および重度の胸部外傷からの回復などの疾患の経過を複雑にする可能性がある。対照的に、呼吸性アルカローシスは、過剰な肺胞換気のためにpco2(a)が減少し、血液からのCO2が過剰に排除されることを特徴とする。
呼吸性アルカローシス–(減少したpco2(a)、pHの増加)
対照的に、呼吸性アルカローシスは、過剰な肺胞換気のためにpco2(a)が減少し、血液からのCO2が過剰に排除される。血液中の酸素の減少(低酸素血症)のために、呼吸中心が刺激される疾患は、呼吸アルカローシスを引き起こす可能性がある。
ここでの例には、重度の貧血、肺塞栓症および成人呼吸器症候群が含まれる。 呼吸アルカローシスが不安発作の特徴であり、重度の痛みに対応する。 サリチル酸塩(アスピリン)のあまり歓迎されない特性の一つは、呼吸器に対するその刺激効果である。 この効果は、サリチル酸塩の過剰摂取後に起こる呼吸アルカローシスを説明する。 最後に、過度の熱機械的換気は、呼吸アルカローシスを引き起こす可能性があります。
代謝性アシドーシス–(減少したhco3–、pHの低下)
重炭酸塩の減少は、常に代謝性アシドーシスの特徴である。 これは2つの理由の1つのために起こります:ボディからの異常な酸負荷か高められたlossesofの重炭酸塩を緩衝することの高められた使用のofbicarbonate。 糖尿病性ケトアシドーシスおよび乳酸アシドーシスは、代謝酸の過剰産生および重炭酸塩の結果としての枯渇を特徴とする二つの状態である。
最初のケースでは、ケト酸(b-hydroxybutyric酸およびアセト酢酸)の異常に高い血中濃度は、insulindeficiencyに起因する深刻な代謝障害を反映しています。
すべての細胞は、酸素が不足している場合に乳酸を産生するため、乳酸産生の増加およびその結果として生じる代謝性アシドーシスは、組織への酸素
例には、心停止および血液量減少性ショック(例えば、大量の流体損失)に関連する任意の状態が含まれる。 肝臓は、正常な細胞代謝の間に産生される乳酸の少量を除去する上で主要な役割を果たすので、乳酸アシドーシスは肝臓障害の特徴となり得る。
身体からの重炭酸塩の異常な喪失は、重度の下痢。 チェックされていない場合、これは代謝性アシドーシスにつながる可能性があります。重炭酸塩を再生し、水素イオンを排泄する失敗renalfailureに起こる新陳代謝のアシドーシスを説明します。
代謝性アルカローシス–(増加したhco3–、pHの増加)
重炭酸塩は常に代謝性アルカローシスで発生します。 まれに、重炭酸塩の過剰投与または重炭酸塩制酸剤の摂取は、代謝性アルカローシスを引き起こす可能性があるが、これは通常一過性である。 身体からの水素イオンの異常な損失は、主な問題である。 そうでなければ、これらの失われた水素イオンを緩衝することになる重炭酸塩は、結果的に血液中に蓄積する。 胃液は酸性であり、胃液は胃液または胃内容物がある任意の疾患プロセス身体からの喪失は水素イオンの損失を表す。
例えば、胃液のProjectile嘔吐は、幽門性狭窄症の患者に起こり得る代謝性アルカローシスを説明する。 重度のカリウム枯渇は、代謝性アルカロシスを引き起こす可能性があります水素とカリウムの相互関係のために。
補償–酸塩基バランスの結果
pHが正常からあまりにも遠く離れていないことは人生にとって不可欠であり、酸-塩基バランスが乱されたときに体は常に異常なpHを正常に戻そうとする。 補償は、この生命維持プロセスに与えられる名前です。 理解するためにphはtheratioによって支配されることを思い出すことが重要です:pco2(a)。
pHが低い代謝性アシドーシスの患者を考慮する重炭酸塩が低いためである。 正常の方の低速およびrestoretheのすべて重要な比率のためのTocompensateは患者hispco2を下げなければなりません(a)。 脳の呼吸器中心の化学受容体は、水素イオン濃度の上昇(低pH)に応答し、換気の増加(過換気)を引き起こし、二酸化炭素の除去を増加させる。
これとは対照的に、高い代謝性アルカローシスの補償には、呼吸の抑制およびそれによってpco2(a)が増加に一致するように上昇するように炭素ジオ酸の保持が含まれる。 しかし、呼吸の抑制は、組織の適切な酸素化を脅かす歓迎されない副作用を有する。 このため、代謝性アルカローシスの呼吸補償は限られている。
pco2(a)の一次妨害(respiratoryacidosisおよびalkalosis)はpco2(a)の適切なforprimary変更を補うことの変更で起因する水素イオン排泄物の腎臓の調節によって償われます。 従って呼吸のアシドーシス(raisedpco2(a))のためのrenalcompensationは高められたreabsorptionのofbicarbonateを含み、呼吸のalkalosis(減らされたpco2(a))のための腎臓の補償は減らされたbicarbonatereabsorptionを含みます。
補償中の酸-塩基バランスの概念図に視覚的に伝えられている。 2. 表IIは、補償前および補償後の四つの酸塩基障害すべてを特徴付ける血液ガス結果をまとめたものである。
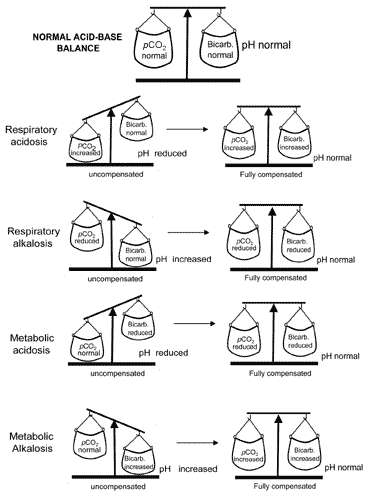
図2
図2 2. “酸-塩基バランス” : compensationrestores normal pH
|
Primary disturbance |
|||||||
|
Respiratory |
Repiratory |
Metabolic |
Metabolic |
||||
|
Some |
Emphysema |
Hyper- |
Renal failure |
Bicarbonate Potassium |
|||
|
Compen- |
RENAL |
RENAL |
RESPIRA- |
RESPIRA- |
|||
|
Initial blood |
pH |
pH |
pH |
pH |
|||
|
Blood gas |
pH pco2 |
pH pco2 |
ph pco2 |
ph |
ph pco2 |
限られた |
|
|
Blood gas |
pH normal |
pH normal |
pH normal |
Limited |
|||
表、pdfの印刷に便利なバージョン。
表II.血液ガスは、酸-塩基バランスの障害をもたらす
一次代謝障害に対する呼吸補償は、aprimary呼吸障害に対する代謝(腎臓)補償よりもはるかに迅速 後者の場合、補償数時間ではなく数日にわたって発生します。
補償が結果としてpHが正常に戻る場合、患者は完全補償されていると言われます。
補償されていると言われています。
補償されていると しかし、多くの場合、補償は実際に正常性を達成することなく、pHtowards normalを返します; そのような場合患者は部分的に補償されると言われている。
上記の理由により、代謝性アルカローシスは非常にまれに完全である補償される。
混合酸-塩基障害
上記の議論から、酸-塩基障害を有するすべての患者は、酸-塩基バランスの四つのカテゴリーの一つだけに苦しんでいると仮定 これはよくそうであるかもしれませんが、特定の状況では、患者はより多くの障害を提示することができます。
例えば、慢性肺気腫のような慢性肺疾患を有する患者を考えてみましょう。 この患者が彼の正常なインシュリンの線量を取らなかったし、糖尿病性のketoacidosisの状態のresultwasが呼吸のアシドーシスのandmetabolicアシドーシス両方の結合された効果を反映
このような混合酸-塩基障害は頻繁ではなく、動脈血液ガス結果のみに基づいて解明することは困難である可能性がある。
概要
正常な血液pHの維持には、いくつかの臓器系が含まれ、循環器の完全性に依存する。 それは驚くべきことではありません酸-塩基バランスの乱れは、身体の多くの部分への外傷だけでなく、広く多様な疾患の経過を複雑にする可能性が 体は血液のpHを維持するためにかなりの力を持っており、disturbancesは、通常、重度の慢性疾患または急性の病気のいずれかを意味します。
動脈血ガス分析の結果は、酸–塩基障害を特定し、その原因として貴重な情報を提供する。
いくつかの提案されたfurtherreading
- Thomson WST、Adams JF、Cowan RA。 臨床酸-塩基バランス。 Oxford:Oxford Medical Publications1997
- Harrison RA. 酸-塩基バランス。 Respir Care Clin N.America1995;1,1:7-21
- Woodrow P.動脈血ガス分析。 看護標準2004;18,21:45-52
- Sirker AA,Rhodes A,Gounds RM,Bennet ED. 酸-塩基生理学:”伝統的”と”現代”のアプローチ。 麻酔2002;57:348-56