9.5 Violazioni della Regola dell’Ottetto
Obiettivo di Apprendimento
- Riconoscere i tre principali tipi di violazioni della regola dell’ottetto.
Per quanto importante e utile sia la regola dell’ottetto nel legame chimico, ci sono alcune violazioni ben note. Ciò non significa che la regola dell’ottetto sia inutile, al contrario. Come per molte regole, ci sono eccezioni o violazioni.
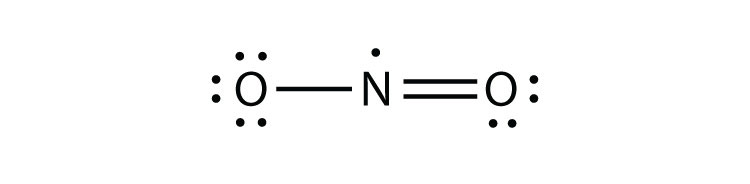
Ci sono tre violazioni alla regola dell’ottetto. Molecole di elettroni dispariunA molecola con un numero dispari di elettroni nel guscio di valenza di un atomo. rappresenta la prima violazione della regola dell’ottetto. Sebbene siano pochi, alcuni composti stabili hanno un numero dispari di elettroni nei loro gusci di valenza. Con un numero dispari di elettroni, almeno un atomo nella molecola dovrà violare la regola dell’ottetto. Esempi di molecole di elettroni dispari stabili sono NO, NO2 e ClO2. Il diagramma di Lewis electron dot per NO è il seguente:
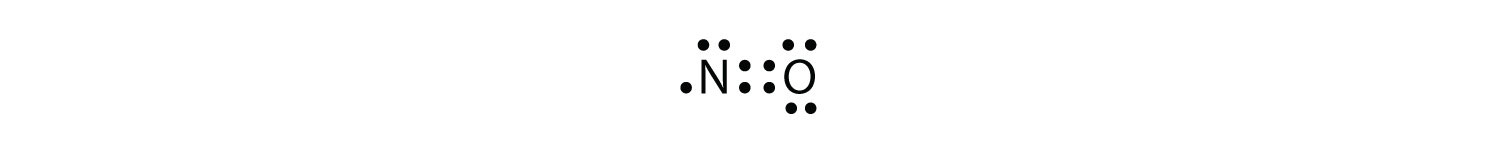
Sebbene l’atomo O abbia un ottetto di elettroni, l’atomo N ha solo sette elettroni nel suo guscio di valenza. Sebbene NO sia un composto stabile, è molto chimicamente reattivo, come lo sono la maggior parte degli altri composti di elettroni dispari.
Molecole elettron-carentiuna molecola con meno di otto elettroni nel guscio di valenza di un atomo. rappresenta la seconda violazione della regola dell’ottetto. Questi composti stabili hanno meno di otto elettroni intorno a un atomo nella molecola. Gli esempi più comuni sono i composti covalenti di berillio e boro. Ad esempio, il berillio può formare due legami covalenti, causando solo quattro elettroni nel suo guscio di valenza:
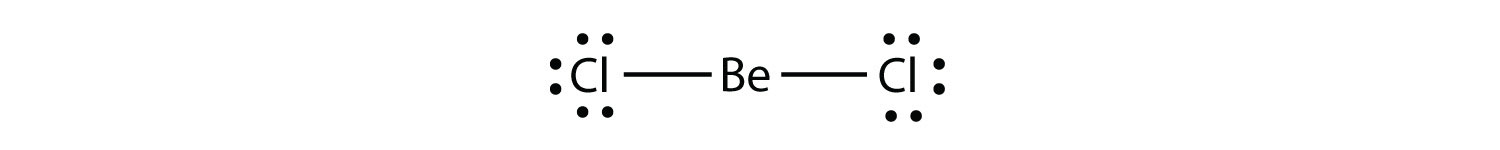
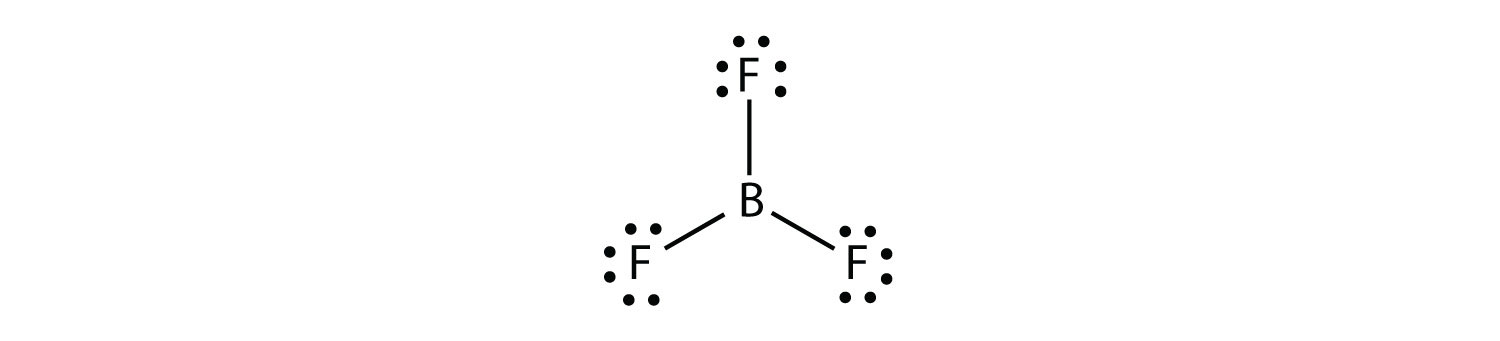
Il boro produce comunemente solo tre legami covalenti, producendo solo sei elettroni di valenza attorno all’atomo B. Un esempio ben noto è BF3:
La terza violazione della regola dell’ottetto si trova in quei composti con più di otto elettroni assegnati al loro guscio di valenza. Questi sono chiamati molecole di shell di valenza espansiuna molecola con più di otto elettroni nel guscio di valenza di un atomo.. Tali composti sono formati solo da atomi centrali nella terza fila della tavola periodica o oltre che hanno orbitali d vuoti nei loro gusci di valenza che possono partecipare al legame covalente. Uno di questi composti è PF5. L’unico diagramma di Lewis electron dot ragionevole per questo composto ha l’atomo P che crea cinque legami covalenti:
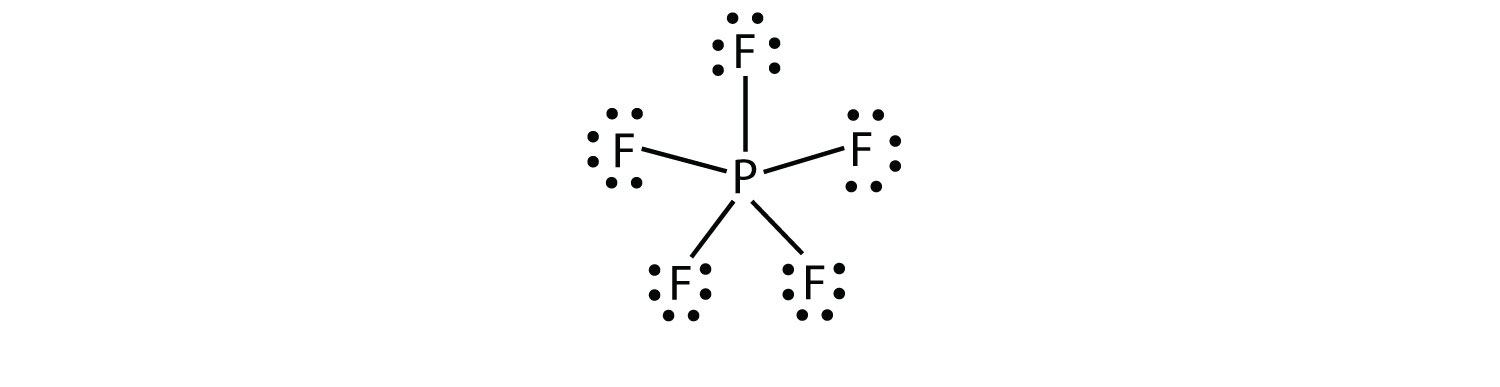
Formalmente, l’atomo P ha 10 elettroni nel suo guscio di valenza.
Esempio 9
Identifica ogni violazione della regola dell’ottetto disegnando un diagramma a punti di Lewis electron.
- ClO
- SF6
Soluzione
-
Con un atomo Cl e un atomo O, questa molecola ha 6 + 7 = 13 elettroni di valenza, quindi è una molecola di elettroni dispari. Un diagramma di Lewis electron dot per questa molecola è il seguente:

-
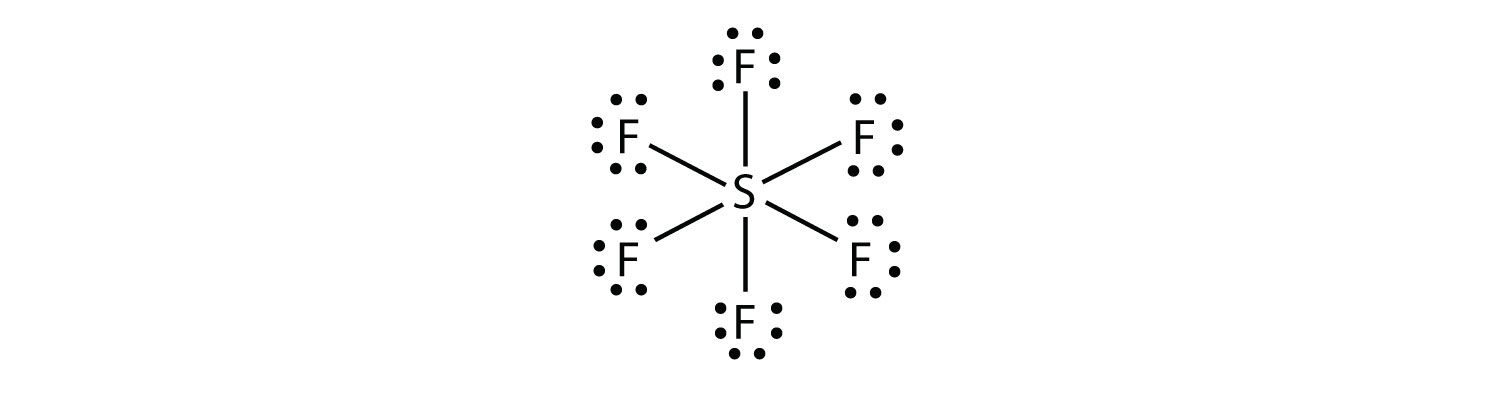
In SF6, l’atomo S centrale crea sei legami covalenti ai sei atomi F circostanti, quindi è una molecola di shell di valenza espansa. Il suo diagramma di Lewis electron dot è il seguente:
Mettiti alla prova
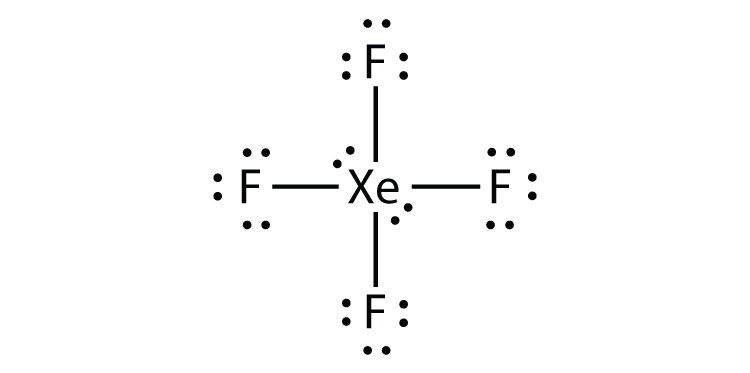
Identifica la violazione della regola dell’ottetto in XeF2 disegnando un diagramma a punti di Lewis electron.
Risposta
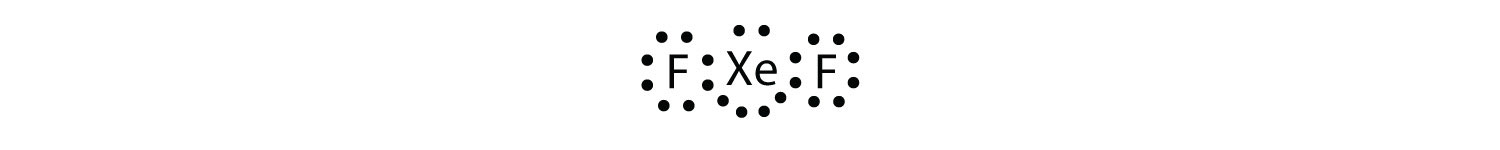
L’atomo Xe ha un guscio di valenza espanso con più di otto elettroni attorno ad esso.
Key Takeaway
- Ci sono tre violazioni alla regola dell’ottetto: molecole di elettroni dispari, molecole di elettroni carenti e molecole di shell di valenza espansa.
Esercizi
-
Perché una molecola di elettroni dispari non può soddisfare la regola dell’ottetto?
-
Perché un atomo nella seconda fila della tavola periodica non può formare molecole di shell di valenza espansa?
-
Disegna un diagramma di Lewis electron dot accettabile per queste molecole che violano la regola dell’ottetto.
- NO2
- XeF4
-
Disegna un diagramma di Lewis electron dot accettabile per queste molecole che violano la regola dell’ottetto.
- BCl3
- ClO2
-
Disegna un diagramma di Lewis electron dot accettabile per queste molecole che violano la regola dell’ottetto.
- POF3
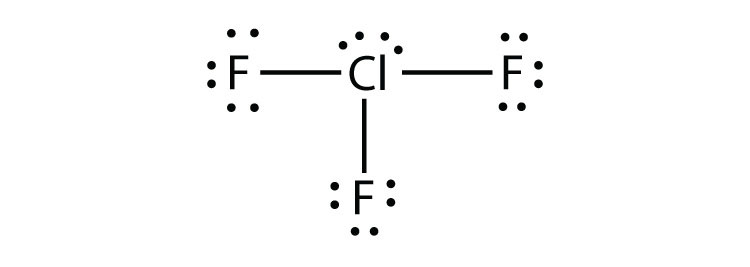
- ClF3
-
Disegna un diagramma di Lewis electron dot accettabile per queste molecole che violano la regola dell’ottetto.
- SF4
- BeH2
Risposte
-
Non c’è modo che tutti gli elettroni possano essere accoppiati se ce ne sono un numero dispari.
-
-
-
-